Введение. Острая кишечная непроходимость стабильно занимает ведущее место в структуре хирургической летальности, являясь одним из наиболее тяжелых осложнений заболеваний и повреждений органов брюшной полости, имеющая клиническую картину самостоятельного заболевания и представляющая собой комплекс нарушений со стороны всех органов и систем организма из-за развития энтеральной недостаточности [2, 4, 5].
Заживление кишечного анастомоза, формированного в условиях острой кишечной непроходимости, безусловно, протекает в отягощенных условиях из-за факторов, препятствующих нормальному течению процесса регенерации [1].
В настоящее время важное значение в замедлении заживления тканей кишечного анастомоза отводится энтеральной недостаточности, при которой пролонгируется эндогенная интоксикация, происходит транслокация микроорганизмов в крово- и лимфоток, а также в свободную брюшную полость [6].
В последние годы особый интерес представляют сведения о значимости процесса перекисного окисления липидов в заживлении кишечного анастомоза в отягощенных условиях, в частности при перитоните [3]. Показано, что этот патологический процесс может быть одним из значимых в срыве репаративной регенерации, а активность его зависит от многих факторов, в том числе от конструкционных особенностей соустья [1, 4].
Целью исследования явилось изучение процесса заживления тканей толстокишечного анастомоза в условиях острой кишечной непроходимости; установление сопряженности течения репаративного процесса с изменениями метаболизма регенерирующих тканевых структур.
Материалы и методы исследования. В основу работы положены результаты хронических опытов на 25 взрослых беспородных собаках, которые разделены на 2 группы. В первой группе (n=10) изучалось заживление толстокишечного анастомоза после резекции толстой кишки в неосложненных условиях. Во второй группе (n=15) исследовалось заживление толстокишечного анастомоза после резекции толстой кишки в условиях острой кишечной непроходимости.
Экспериментальные опыты проводились в соответствии с нравственными требованиями к работе с экспериментальными животными («Правила проведения работ с использованием экспериментальных животных» (приказ МЗ СССР № 755 от 12.08.1987 г.), Федеральный закон «О защите животных от жестокого обращения» от 01.01.1997 г., приказ МЗ РФ от 19.06.2003 г. № 267 «Об утверждении правил лабораторной практики»), одобрены локальным этическим комитетом.
Эксперименты проведены по следующей схеме. Животным первой группы под наркозом выполняли срединный разрез вентральной стенки брюшной полости. В рану выводили толстую кишку, производили резекцию на протяжении 6–8 см, а затем восстанавливали непрерывность желудочно-кишечного тракта путем наложения кишечного анастомоза «конец в конец». Брюшную полость ушивали наглухо.
Во второй (контрольной) группе животным под наркозом выполняли срединный разрез вентральной стенки брюшной полости. В рану выводили толстую кишку, на расстоянии 8–10 см от ануса ее перевязывали толстой лигатурой, создавая кишечную непроходимость. Брюшную полость ушивали наглухо. Через 2-е суток выполняли релапаротомию, резекцию кишки на протяжении 6–8 см, наложение первичного анастомоза «конец в конец», ушивали наглухо брюшную полость.
При формировании анастомоза во всех группах опытов был использован классический двухрядный шов Ламбера – Альберта. Оба ряда соустья образовывали узловым викриловым (3/0 – 4/0) швом: внутренний ряд – через все слои кишечной стенки; наружный ряд – серозно-мышечный. Брюшную полость промывали изотоническим раствором хлорида натрия (0,89 %) и ушивали наглухо.
Во время операции после резекции толстой кишки и формирования кишечного соустья, а также на контрольных этапах периода наблюдения оценено функционально-метаболическое состояние тканей кишки в зоне анастомоза. С этой целью изучен их электрогенез путем измерения окислительно-восстановительного потенциала (редокс-метрия) и оценена диффузионная способность тканей для кислорода путем определения коэффициента диффузии кислорода. Для этого электрод (платиновый) помещали в ткани области анастомоза по его периметру в пяти точках. Полученные данные позволяли оценить трофику тканей соустья сразу же после его формирования и в динамике раннего послеоперационного периода.
В послеоперационном периоде животным указанных групп проводили антибактериальную и инфузионную терапию: внутримышечные инъекции 2 раза в сутки раствора гентамицина из расчета 0,8 мг/кг массы тела; внутривенно 1 раз в сутки 5 % раствор глюкозы и 0,89 % раствор хлорида натрия из расчета 50 мл/кг.
В раннем послеоперационном периоде наблюдали за общим состоянием животного, его поведением, аппетитом, характером и частотой стула, измеряли температуру тела, пальпировали брюшную полость. Этапы периода наблюдения за животными: 1, 3, 5, 7-е сутки. В контрольные этапы наблюдения животным под наркозом производили релапаротомию.
В работе использовали следующие методы исследования.
- Макроскопия на аутопсии и во время релапаротомии.
- Определение редокс-потенциала (окислительно-восстановительного потенциала (ОВП)) для изучения электрогенеза тканей.
- Определение коэффициента диффузии кислорода (КДК) в тканях на основе учета темпа падения диффузного тока восстановления по уравнению И.М. Эпштейна (Труфанов Л.А., 1991).
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием критерия t Стьюдента. Вычисления и построение диаграмм, отражающих динамику изученных показателей, совершали с поддержкой программы Microsoft Excel XP. Применен текстовый процессор Microsoft Word XP.
Результаты исследования и их обсуждение. Отметим, что выбранный способ воспроизведения острой кишечной непроходимости полно и адекватно моделирует исследованную патологию. Наложение лигатуры на толстую кишку через двое суток приводило к формированию выраженной острой обтурационной толстокишечной непроходимости. Клинически отмечались основные признаки илеуса. В раннем послеоперационном периоде у животных отсутствовал стул, отмечалось увеличение живота, в ряде случаев была рвота. Подопытные животные отказывались от пищи, но воду охотно принимали. Они постоянно лежали, с трудом передвигались по вольеру.
Под внутривенным тиопентал-натриевым наркозом (0,04 г/кг веса) животным выполнялась операция: устранение острой кишечной непроходимости путем резекции толстой кишки с последующим восстановлением непрерывности желудочно-кишечного тракта посредством анастомозирования. При релапоротомии в брюшной полости выявлялось незначительное количество серозного экссудата. Толстая кишка выше препятствия была увеличена в диаметре за счет скопления в ней большого количества содержимого твердого характера.
Толстую кишку мобилизовывали в зависимости от массы животного на протяжении от 10 до 15 см: 2–3 см ниже зоны препятствия и 6–10 см – выше обтурации. В указанном объеме производили резекцию толстой кишки, а затем восстанавливали непрерывность пищеварительной трубки путем формирования толстокишечного анастомоза по типу «конец в конец». Брюшную полость промывали изотоническим раствором хлорида натрия (0,89 %) и ушивали наглухо.
При исследовании резецированного отдела толстой кишки выявлено, что в зоне наложения лигатуры в стенке органа возникали достаточно выраженные воспалительные явления как со стороны серозной, так и слизистой оболочек.
Отметим, что в приводящем отделе толстой кишки (выше зоны обтурации) видимые макроскопические изменения были особенно выраженными, причем как со стороны серозной, так и слизистой оболочек.
Хирургическую операцию животные перенесли удовлетворительно. Через 2–3 ч после вмешательства собаки просыпались. Они лежали в клетке, мало реагировали на попытку контакта с ними, не пытались встать. Через 12–18 ч начинали лакать воду.
Через одни-двое суток после хирургического вмешательства собаки поднималась, у них была одышка, повышалась температура тела до субфебрильных или фебрильных цифр (реже).
В первые двое-трое суток у собак отмечалось увеличение живота из-за вздутия, задержка стула и газов – признаки послеоперационного пареза кишечника. В последующие сроки состояние подопытных животных заметно улучшалось, регистрировались признаки активизации кишечной деятельности. Они начинали принимать пищу, передвигаться по вольеру, появлялся стул, который был полуоформлен с незначительным количеством крови и слизи.
Нами, как указано выше, изучен процесс заживления тканей по линии толстокишечного анастомоза в динамике. Оказалось, что заживление толстокишечного соустья протекало по типу вторичного натяжения или приближалось к этому типу.
При релапаротомии через сутки после операции резекции толстой кишки и формирования анастомоза установлено, что в брюшной полости имелся выраженный спаечный процесс. К области анастомоза были припаяны пряди большого сальника, которые легко отделялись от толстой кишки. В брюшной полости имелось незначительное количество экссудата серозного характера, который располагался в области анастомоза и малом тазу.
В области анастомоза после отделения спаек от толстой кишки выявлялись обширные кровоизлияния и гиперемия тканей. Видимых дефектов по линии швов не определялось.
На аутопсии во время исследования толстой кишки со стороны слизистой оболочки выявлено, что по линии швов вершины шовного валика, который был ориентирован в просвет органа, имелись участки некроза тканей с образованием обширного тканевого (язвенного) дефекта. Эти явления особенно четко определялись в области наложения внутреннего ряда швов.
Через трое суток после операции при оценке морфологического состояния брюшной полости выявлено, что в ней регистрировался достаточно выраженный спаечный процесс, особенно в области толстокишечного соустья. При отделении спаек от толстой кишки выявлено, что по линии швов анастомоза конец в конец со стороны серозной оболочки воспалительные явления сохранялись. Эта область кишечника была гиперемирована, с участками кровоизлияний, покрыта фибрином, особенно по линии швов.
При исследовании зоны толстокишечного анастомоза со стороны слизистой оболочки по линии швов определялся выраженный язвенный дефект, воспалительные явления в тканях, прилежащих к области соустья, уменьшались.
Через 5–7 суток после операции воспалительные явления в брюшной полости и толстой кишке, несущей анастомоз, существенно уменьшались. При релапаротомии установлено, что спаечный процесс регистрировался во всех случаях. К этому сроку раннего послеоперационного периода в брюшной полости экссудата не обнаруживалось. При разделении спаек по линии швов наружного ряда отмечались явления гиперемии, кровоизлияний.
Следует подчеркнуть, что толстокишечный анастомоз конец в конец, формированный по способу Ламбера – Альберта в условиях толстокишечной непроходимости, не всегда оказывался надежным. В трех наблюдениях отмечена несостоятельность швов с развитием местного или общего перитонита.
На аутопсии двух животных при разделении спаек по линии швов выявлен некроз тканей с развитием дефекта в стенке толстой кишки. Отметим, что в начальные сроки после операции дефект в стенке ограничивался спаечным перипроцессом. Поэтому общего перитонита у этих животных не возникало.
Таким образом, в условиях острой толстокишечной непроходимости после резекции толстой кишки и формирования первичного двухрядного анастомоза по способу Ламбера –Альберта заживление соустья протекало по типу вторичного натяжения и с развитием в ряде случаев несостоятельности швов.
Перед нами стояла задача исследовать причины такого неблагоприятного течения репаративного процесса в отягощенных острой кишечной непроходимостью условиях. Для решения этой задачи применены биофизические исследования, оценивающие трофику тканей по линии соустья. Такого рода исследования позволили достаточно углубленно определить сопряженность репаративного процесса с трофикой тканей регенерирующих структур.
Уже во время операции после резекции толстой кишки и формирования кишечного соустья выявлены существенные нарушения трофики тканей анастомоза. Установлено, что окислительно-восстановительный потенциал в области соустья после его формирования существенно падал и составил –48,14 ± 1,24 мВ, что было ниже нормы на 27,2 % (р<0,05), диффузионная способность тканей для кислорода в этот срок достоверно ухудшалась: коэффициент диффузии снижался до 1,45 ± 0,17 см2/с 10-2, что по сравнению с нормой было меньше на 44,8 % (р<0,05) (рис. 1).
Оказалось, что через сутки после операции редокс-потенциал тканей толстокишечного соустья был значительно снижен до –54,13 ± 1,17 мВ, что на 35,2 % (р<0,05) было меньше, чем в норме. До 0,86 ± 0,08 см2/с 10-2 происходило снижение коэффициента диффузии кислорода, которое было на 73,6 % (р<0,05) ниже нормального показателя. На третьи сутки после операции в области анастомоза происходило достоверное снижение редокс-потенциала и коэффициента диффузии кислорода на 24,1 и 60,9 % (р<0,05) соответственно относительно нормы.
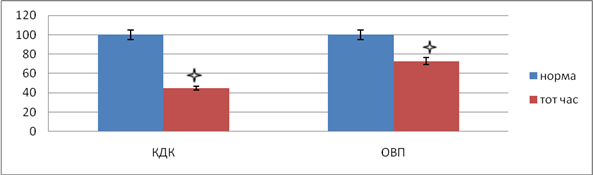
Рис. 1. Изменения окислительно-восстановительного потенциала, коэффициента диффузии кислорода тканей толстокишечного анастомоза сразу после операции. * – достоверность по отношению к норме при р<0,05
К пятым суткам наблюдения диффузионная способность тканей для кислорода также была снижена: коэффициент диффузии был равен 2,14 ± 0,17 см2/с 10-2, что по сравнению с нормой было меньше на 33,8 % (р<0,05). Установлено, что окислительно-восстановительный потенциал в области соустья в этот срок незначительно восстановился, но был ниже нормы на 14,7 % (р<0,05) и составлял –41,12 ± 1,24 мВ (рис. 2).
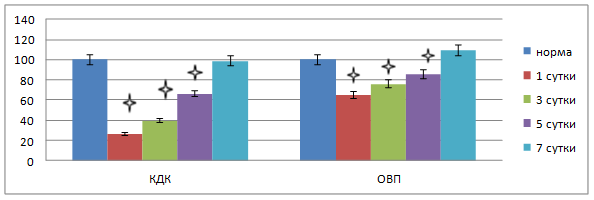
Рис. 2. Изменения окислительно-восстановительного потенциала, коэффициента диффузии кислорода тканей толстокишечного анастомоза в раннем послеоперационном периоде. * – достоверность по отношению к норме при р<0,05
На завершающем этапе наблюдения трофика тканей полосы анастомоза толстой кишки восстановилась, что подтверждалось восстановлением электрогенеза тканей.
Отметим, что в первой группе животных, в которой изучен процесс заживления тканей толстокишечного соустья в неосложненных условиях, репаративная регенерация толстокишечного соустья протекала благоприятнее. Несостоятельности швов анастомоза не было.
В целом заживление тканей по линии швов приближалось к типу первичного натяжения. На вершине шовного валика в начальные сроки раннего послеоперационного периода имелись небольшие участки некроза тканей.
Отметим и тот факт, что в неосложненных условиях в раннем послеоперационном периоде в брюшной полости формировалось незначительное количество спаек. Спаечный процесс был преимущественно в зоне толстокишечного соустья и был представлен единичными спайками прядей большого сальника к линии анастомоза.
При сравнительной оценке метаболических процессов в тканях соустья в неосложненных условиях и при острой толстокишечной непроходимости нами выявлено, что исследованные биофизические показатели в первой группе животных были изменены на 12,1– 22,3 % (р<0,05), что меньше, чем во второй группе животных.
Заключение. Анализ полученных данных показывает, что в отягощенных острой толстокишечной непроходимостью условиях двухрядный толстокишечный анастомоз не всегда является надежным. Как показали наши исследования, основой низкой герметичности соустья лежит несовершенный процесс заживления тканей по линии внутреннего ряда швов. Как правило, в этой области анастомоза отмечается некроз тканей, особенно захваченных шовным материалом, что вызывает образование массивного язвенного дефекта, из-за которого создаются затруднительные условия для полноценного репаративного процесса.
Выявлено, что в основе ухудшения процесса заживления тканей по линии швов толстокишечного анастомоза лежат нарушения их трофики. Этот факт получен благодаря использованию редокс-метрии и оценки диффузионной способности тканей для кислорода.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.
Чалык Ю.В., д.м.н., профессор, кафедра общей хирургии, профессор, Саратовский государственный медицинский университет, г. Саратов.
Библиографическая ссылка
Власов А.П., Аброськин Б.В., Шибитов В.А., Власов П.А., Кудрявцев П.В. РЕПАРАТИВНАЯ РЕГЕНЕРАЦИЯ ТКАНЕЙ ТОЛСТОКИШЕЧНОГО АНАСТОМОЗА ПРИ ОСТРОЙ КИШЕЧНОЙ НЕПРОХОДИМОСТИ // Современные проблемы науки и образования. 2014. № 1. ;URL: https://science-education.ru/ru/article/view?id=12077 (дата обращения: 18.08.2025).



