Удаление части нижней челюсти по поводу лечения новообразований, травматических повреждений или диффузных воспалительных процессов челюстно-лицевой области (ЧЛО) сопровождается формированием объемного костного дефекта, приводящего к функциональным и эстетическим нарушениям [1, 4, 5, 6, 7, 9].
Успех восстановления объемного костного дефекта нижней челюсти после хирургического лечения в целом зависит от конструктивных особенностей имплантата, замещающего дефект, иммунной инертности материалов и особенностей их взаимодействия с окружающими тканями [4, 5, 6, 10].
Сегодня при устранении объемных костных дефектов нижней челюсти широко используют различные имплантаты. Не все предлагаемые имплантаты позволяют восстановить функциональные и эстетические нарушения одномоментно [8, 11, 14, 17].
Объём дефекта определяется количеством вовлеченных в патологический процесс тканей и их анатомо-физиологической значимостью для организма. Характер функциональных нарушений и сроки адаптации поражённого органа во многом зависят от сохранённой функциональной активности анатомических образований. Так, имплантат суставной головки, лишенный мышечной активности в период адаптации к суставной ямке черепа, подвержен не прогнозируемому влиянию мышц антагонистов. Формирующиеся рубцовые ткани вокруг имплантатов оказывают негативное влияние на нижнеальвеолярный сосудисто-нервный пучок, провоцируя неврологическую симптоматику с локальными реологическими нарушениями, формируя порочный патологический замкнутый круг, что способствует различным осложнениям – вплоть до отторжения имплантата [2, 3, 9, 12, 14, 18]. Все существующие имплантаты-эндопротезы для замещения костных дефектов нижней челюсти изготавливаются в одном стандартном типоразмере без четкой индивидуализации по анатомо-топографическим показателям.
Цель исследования. Разработка щадящего внутриротового доступа и способа замещения дефекта после удаления объемных новообразований нижней челюсти с использованием индивидуального комбинированного имплантата, способного обеспечить раннюю адекватную морфофункциональную и анатомо-физиологическую активность органов ЧЛО.
Материалы и методы. Для разработки конструкции индивидуального комбинированного имплантат-эндопротеза (ИКИЭ) нижней челюсти использовали данные объемных математических параметров пораженных опухолью тканей нижней челюсти, полученных с помощью компьютерной томографии. При планировании резекции нижней челюсти с нарушением непрерывности кости без экзартикуляции для определения параметров имплантата выполняли компьютерные математические – резекцию тканей нижней челюсти, включающих опухоль, формирование на концах дефекта воспринимающего ложа, наложение на полученный дефект параметров симметричной здоровой ткани, полученных симметрическим компьютерным преобразованием с получением разностной оценки параметров резецированной и здоровой части нижней челюсти, которые и являлись параметрами имплантата.
При планировании резекции нижней челюсти с нарушением непрерывности кости с экзартикуляцией для определения параметров имплантата выполняли компьютерные математические – резекцию тканей нижней челюсти, включающих опухоль, формирование на конце дефекта воспринимающего ложа, наложение на полученный дефект математических параметров симметричной здоровой ткани, полученных симметрическим компьютерным преобразованием, адаптации суставной головки имплантата к суставной ямке черепа и контактной поверхности имплантата к воспринимающему ложу сохраненного фрагмента челюсти. Путем разностной оценки параметров резецированной и здоровой части нижней челюсти получали объемные параметры имплантата-эндопротеза [4].
С 2010 по 2013 гг. прооперировано 26 пациентов. Средний возраст больных – 46 лет (от 18 до 66 лет), из них 15 (57,7%) женщин и 11 (42,3%) мужчин. Изготовлено 20 стереолитографических моделей.
Для остальных больных исследование ограничено получением трехмерной математической модели. Пациентов разделили на три группы: с опухолями (11 случаев – 42,3%), травмами (13 случаев – 50%) и воспалительным процессом (2 случая – 7,7%). В работе использовали рентгеновский томограф Siemens Somatom-CR4. После первичной компьютерной обработки цифровых данных их преобразовывали в STL-файлы (специальный стереолитографический формат), непосредственно использовавшиеся для создания биомоделей. Уровень контраста для визуализации костных структур отдельно от мягких тканей при построении трехмерной математической модели объекта подбирали в каждом случае индивидуально. Для формирования моделей использовали стереолитографическую установку 3D-Systems SLUC-550 (США). В качестве исходной композиции жидких мономеров применяли ФПК ОКМ-2. В качестве фотоинициатора радикальной полимеризации использовали Irgacure 671.
Полученные изделия спекались на лазерной технологической установке «Квант-60», излучение от которой фокусировалось в пятно D~50 мкм, при мощности от 2 до 20 Вт. Для спекания использовали порошок готового никелида титана марки ПВН55Т45 (ОАО «Полема», Россия) с дисперсностью исходного порошка ~100 мкм.
Результаты исследования. ИКИЭ для замещения объемного дефекта нижней челюсти получали по данным компьютерной томографии с помощью симметрического компьютерного преобразования, путем передачи параметров на устройство автоматического прототипирования. ИКИЭ представляет собой монолитный пустотелый блок, выполненный из никелида титана (фиг. 1), он имеет тело нижней челюсти (1) с двумя перфорированными фиксаторами под титановые винты (2), угол челюсти (3), ветви челюсти (4) с мыщелковым отростком сферической формы (5), венечным отростком (6) с фиксатором для сухожилия височной мышцы (7). Наружная поверхность тела (1) и ветви челюсти (4) имеет борозду (8) глубиной 3 мм для размещения нижнеальвеолярного сосудисто-нервного пучка. Перфорированный фиксатор под титановые винты (2) изготовлен из двух титановых пластин с перфорационными отверстиями для фиксации имплантата к костной ткани. Мыщелковый отросток сферической формы (5) позволяет установить его в суставную ямку височной кости и обеспечить максимальную амплитуду движений нижней челюсти. Ветвь имплантата нижней челюсти, с одной стороны, имеет мыщелковый отросток сферической формы, венечный отросток имеет фиксатор сухожилия височной мышцы.
Имплантат-эндопротез имеет объёмную конфигурацию и соответствует размерам устраняемого дефекта нижней челюсти от подбородочного симфиза до суставной ямки височной кости (фиг. 2).
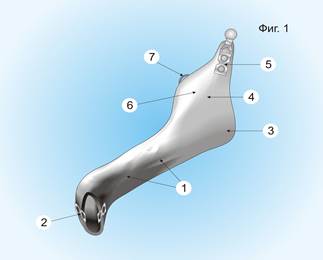
Фиг. 1.
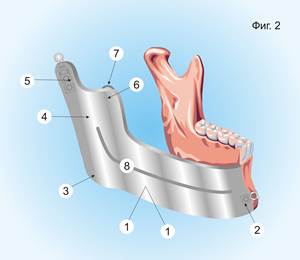
Фиг. 2
Объёмная, полая конструкция имплантата позволяет анатомически правильно распределить вокруг его поверхности отслоенные в ходе оперативного вмешательства мышечные волокна и адаптировать их с учётом функциональной направленности, что позволяет максимально точно восстановить мышечную активность в период реабилитации пациента. Кроме этого, такая конструкция позволяет в последующем восстановить зубные ряды с использованием дентальных имплантатов. Борозда (8) глубиной 3 мм на наружной поверхности тела и ветви имплантата-эндопротеза предназначена для размещения нижнеальвеолярного сосудисто-нервного пучка, позволяет минимизировать операционную травму сосудов и нерва, обеспечить быстрое восстановление иннервации, кровоснабжения и чувствительности в послеоперационном периоде.
Предложенная конструкция позволяет оптимально адаптировать вокруг элементов титанового имплантата сухожильно-мышечные структуры, что создаёт благоприятные условия для репаративной регенерации, что в целом позволяет восстановить их раннюю функциональную активность.
Кроме того, опытные экспериментальные исследования на животных показали, что использование иных материалов (например, силикона или пластмассы) для изготовления имплантата-эндопротеза нецелесообразно из-за снижения прочности всей конструкции в процессе жевания. Клиническая эффективность использования титанового имплантата-эндопротеза при реконструкции дефектов нижней челюсти подтверждена клиническими испытаниями.
Клинический пример. Больная Ф., 28 лет, поступила в отделение челюстно-лицевой хирургии «Ставропольского краевого клинического центра специализированных видов медицинской помощи» г. Ставрополя, 25.09.2008 г., история болезни 1477/4. Диагноз: опухоль нижней челюсти с поражением тела, ветви, мыщелкового и венечного отростков справа (рис. 1).
a 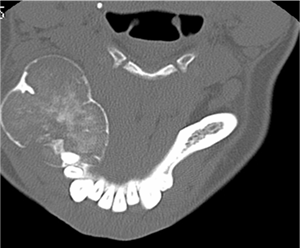 b
b 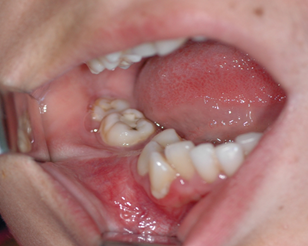
Рис. 1. а) Компьютерная томограмма больной Ф. b) Вид в полости рта
После выполнения компьютерной томографии с помощью симметрического компьютерного преобразования путем передачи параметров на устройство автоматического прототипирования произведено проектирование и моделирование стереолитографической модели нижней челюсти. В плане предоперационной подготовки изготовлен полноразмерный ИКИЭ.
Ход операции. Под эндотрахеальным наркозом внутриротовым доступом в преддверии полости рта выполнен разрез от 32 зуба по переходной складке и продлен до крыловидно челюстной складки справа. Скелетирован поражённый участок нижней челюсти в пределах здоровых тканей, произведено удаление пораженного опухолью фрагмента в пределах здоровых тканей с сохранением венечного и суставного отростков (рис. 2).
Уточненный диагноз после гистологического исследования: амелобластома нижней челюсти. В ходе операции участки мышц, отсеченных от соответствующих поверхностей удаленного фрагмента челюсти, взяты на лигатуры: подподбородочно-подъязычные, дна полости рта, переднего брюшка двубрюшной мышцы; медиальной крыловидной, латеральной крыловидной; жевательной, костного фрагмента ветви нижней челюсти.
В проекции подбородочного симфиза сформировано воспринимающее ложе под перфорированные пластины фиксатора. В дистальном участке операционной раны с точной топографической ориентировкой припасовывали титановый шаблон ИКИЭ. После полной установки ИКИЭ производили фиксацию дистальных отделов всех вышеперечисленных групп мышц вокруг поверхности имплантата в местах их физиологического прикрепления, устанавливали активные дренажи, накладывали швы в полости рта - послойно в три этажа.
a 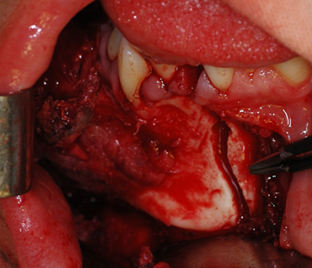 b
b 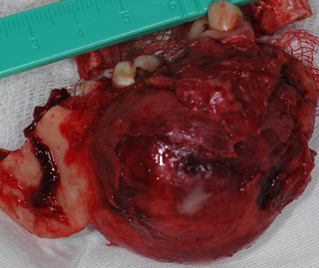
Рис. 2. a) Ход операции. b) Удаленная опухоль вместе с фрагментом челюсти
Послеоперационный период протекал на фоне медикаментозной терапии без воспалительных осложнений. Конфигурация нижней челюсти восстановлена, состояние прикуса адекватное, объем основных функциональных движений челюсти стабилизировался через 2 месяца.
Период отдаленных наблюдений составляет более 5 лет. Данные функционального и клинического обследования достоверно подтверждают прирост мышечной массы, наличие функционального тонуса и взаимодействие синергетических и антагонистических групп мышц, прикрепленных к поверхности ИКИЭ в 96,2% случаев.
Вывод. Использование разработанного индивидуального комбинированного имплантата-эндопротеза при замещении дефекта после внутриротового удаления объемных новообразований нижней челюсти позволяет оптимально адаптировать костные, сухожильно-мышечные и нервные структуры и восстановить их раннюю функциональную активность.
Рецензенты:
Водолацкий М.П., д.м.н., профессор, заведующий кафедрой челюстно-лицевой хирургии и стоматологии детского возраста ГБОУ ВПО «Ставропольский государственный медицинский университет» Минздрава России, г. Ставрополь.
Порфириадис М.П., д.м.н., профессор кафедры стоматологии общей практики СтГМУ, главный врач МБУЗ «Городская стоматологическая поликлиника», г. Ставрополь.
Библиографическая ссылка
Сирак С.В., Слетов А.А., Елизаров А.В., Мебония Т.Т., Арутюнов А.В., Казиева И.К. ИМПЛАНСТРУКЦИЯ ОБЪЕМНЫХ КОСТНЫХ ДЕФЕКТОВ НИЖНЕЙ ЧЕЛЮСТИ // Современные проблемы науки и образования. 2013. № 6. ;URL: https://science-education.ru/ru/article/view?id=11002 (дата обращения: 05.04.2025).



