Переломы вертлужной впадины составляют от 7% до 25% от повреждений таза [1]. Частота встречаемости подобной патологии составляет 3 случая на 100 000 населения в год [2]. За последние 100 лет, в связи с ростом количества ДТП, их количество увеличилось в 20 раз. Последствия подобных травм значительно снижают качество жизни и являются причиной стойкой утраты трудоспособности. Несмотря на успехи современной травматологии, разработку новых алгоритмов и методов оперативного лечения, устройств для остеосинтеза и способов их применения, по данным современной литературы можно сделать заключение, что даже проведение стабильного остеосинтеза с анатомическим восстановлением суставной поверхности вертлужной впадины в раннем посттравматическом периоде не гарантирует удовлетворительного результата [3; 4].
Дегенеративно-дистрофические изменения тазобедренного сустава, требующие хирургического лечения, развиваются у 12-88% пострадавших [1; 2; 5]. При развитии посттравматического коксартроза возможности оперативного лечения ограничены артродезированием и эндопротезированием тазобедренного сустава. Формирование анкилоза тазобедренного сустава приводит к нарушению не только позвоночно-тазовых отношений, но механических осей дистальных суставов нижних конечностей, что приводит к развитию гонартрозов и крузартрозов, значительному нарушению походки, снижению качества жизни. В связи с этим наиболее предпочтительным способом хирургического лечения является тотальное эндопротезирование тазобедренного сустава [6; 7]. Однако, несмотря на широкое использование данной методики, результаты лечения посттравматического коксартроза хуже, чем при лечении идиопатического коксартроза [2; 8; 9]. К основным сложностям, с которыми сталкивается хирург в ситуации лечения посттравматического коксартроза, в первую очередь относятся дефекты костной ткани вертлужной впадины, не позволяющие достичь прочной первичной фиксации стандартных вертлужных компонентов. В тех случаях, когда перелом вертлужной впадины сросся, высока вероятность порочной консолидации отломков, что приводит к нарушению анатомических взаимоотношений в суставе. Предшествующие многократные и объемные операции приводят к наличию выраженного мягкотканного рубцового процесса не только в проекции доступа, но и в области параартикулярных тканей, что увеличивает время оперативного вмешательства, снижает реабилитационный потенциал, повышает риск септических осложнений. Наличие металлоконструкций также ограничивает варианты использования имплантатов, увеличивает риск развития параимплантной инфекции, при необходимости удаления металлоконструкций увеличивается тяжесть интраоперационного травматического воздействия. Вследствие выраженного изменения анатомических осложнений у пациентов с посттравматическим коксартрозом определяется сформированный порочный мышечный стереотип ходьбы, что также снижает реабилитационный потенциал. Асептический некроз головки бедренной кости, развившийся вследствие перенесенной травмы, ограничивает возможность замещения посттравматических дефектов путем аутоостеопластики [1; 10]. Выбор метода оперативного лечения зависит от величины костных дефектов, качества костной ткани, наличия интактных колонн вертлужной впадины или нарушенной целостности тазового кольца, что определяет возможность обеспечения надежной фиксации и достаточной площади контакта с жизнеспособной костью [11].
Цель исследования: оценить результаты лечения пациентов с посттравматическим коксартрозом 3 стадии в сочетании с дефектами вертлужной впадины.
Материал и методы исследования. За 2012-2018 гг. в ННИИТО был пролечен 221 пациент с коксартрозом 3 стадии и посттравматическими дефектами вертлужной впадины. Учитывая отсутствие общепринятой классификации посттравматических дефектов вертлужной впадины, оценку дефектов мы проводили по одной из самых распространенных и наиболее цитируемой в современной литературе – классификации W.G. Paprosky. Выбор данной классификации был обусловлен не только ее распространенностью, но и относительной универсальностью, которая позволяет использовать данную классификацию для оценки дефектов любой этиологии и определить тактику оперативного лечения согласно алгоритму, предложенному авторами [12]. При проведении анализа также учитывали тип перелома вертлужной впадины по классификации АО, способ предшествующего лечения (восстановление суставной поверхности вертлужной впадины, проведение стабильного остеосинтеза, сроки проведения оперативного вмешательства), срок, прошедший после травмы до проведения эндопротезирования, тип дефекта по классификации W.G. Paprosky. Критериями включения в исследование были следующие параметры: возраст старше 18 лет, наличие посттравматического коксартроза 3 стадии и дефекта вертлужной впадины IIa и обширнее по классификации W.G. Paprosky. Критерием исключения являлись пациенты младше 18 лет, а также пациенты с наличием хронического инфекционного процесса в области тазобедренного сустава. Пациенты были разделены на 2 группы: в I группу включены 189 пациентов, которым оперативное лечение по поводу перелома вертлужной впадины либо не проводилось, либо суставная поверхность не была восстановлена, либо операция была выполнена в срок более 21 дня с момента травмы. Во II группу включены 32 пациента, которым в срок до 21 дня с момента травмы был проведен стабильный остеосинтез с восстановлением суставной поверхности вертлужной впадины.
Половой состав групп был неоднороден, в обеих группах преобладало количество мужчин – соотношение женщины/мужчины: 1 к 5.
В I группе было 46 женщин и 143 мужчины, средний возраст составил 49+1 год (min 24, max 78, медиана 51), во II группе 4 женщины и 28 мужчин, средний возраст составил 50+2 года (min 28, max 79, медиана 53).
При анализе типа и характера переломов вертлужной впадины было выявлено, что в группе I чаще всего были диагностированы переломы типа A, а в группе II – чаще всего встречались переломы типа B по классификации AO (табл. 1).
Таблица 1
Распределение пациентов в группах по типу перелома по шкале AO ASIF
|
Тип перелома |
A |
B |
C |
|
Группа I (n=189) |
52% (99 случаев) |
42% (79 случаев) |
6% (11 случаев) |
|
Группа II (n=32) |
19% (6 случаев) |
62% (20 случаев) |
19% (6 случаев) |
Диагностированные при поступлении посттравматические дефекты в I группе были обширнее, преобладали дефекты с повреждением заднего края вертлужной впадины, в группе II дефекты были менее обширными, дефектов с нарушением целостности тазового кольца выявлено не было (табл. 2).
Таблица 2
Распределение пациентов в группах по типу посттравматического дефекта по классификации W.G. Paprosky
|
Тип дефекта |
IIa |
IIb |
IIc |
IIIa |
IIIb |
Pelvic discontinuity |
|
Группа I (n=189) |
14% (n=26) |
25% (n=47) |
24% (n=45) |
15% (n=28) |
15% (n=29) |
7% (n=14) |
|
Группа II (n=32) |
44% (n=14) |
33% (n=10) |
8% (n=3) |
15% (n=5) |
0 |
0 |
При выполнении эндопротезирования ориентировались на характер дефекта и плотность опороспособной костной ткани. Выполнение только рентгенографии, даже в дополнительных проекциях, не позволяет достоверно оценить степень и характер дефектов вертлужной впадины [13]. Для этого всем пациентам проводили МСКТ таза, полученные данные конвертировали в 3D-модель. Для моделирования дефекта и измененной анатомии вертлужной впадины использовали метод индивидуальной контурной пластики с оценкой плотности костной ткани по шкале Хаунсфилда. Разработанная методика подразумевает проведение нескольких последовательных этапов, в результате которых оцениваются данные об истинной геометрии дефекта и плотности костной ткани. Оценивая полученную информацию, моделируется геометрия, пространственное положение, опорная поверхность с учетом опороспособной кости. При имплантации использовали компоненты press-fit фиксации, для достижения первичной биологической фиксации, при необходимости, вертлужные компоненты дополнительно фиксировались винтами. Для минимизации травматичности вмешательства, уменьшения интраоперационной кровопотери и времени оперативного вмешательства, во всех случаях, мы старались выполнить как можно более «рутинное» эндопротезирование. По данным термином мы понимаем минимально возможный оперативный доступ, при наличии металлоконструкций, винты и пластины удаляли только в случаях, когда они мешали имплантации компонентов эндопротеза либо проведению фиксирующих винтов. Для удаления металлоконструкций специальных доступов не применялось. Компоненты цементной фиксации и антипротрузионные кольца не использовались, так как во всех случаях мы стремились добиться не только прочности, но и биологичности первичной фиксации. Для замещения дефектов использовали опорные аугменты различных форм из пористого титана, проводили костную аутопластику из головки бедренной кости, костную стружку, полученную при обработке ацетабулярной впадины фрезами. В случае неудовлетворительного качества костной ткани головки бедренной кости либо при объеме дефекта, превышающем возможности имеющейся аутокости, применяли аллопластику с использованием как депротеинизированной костной ткани, так и структурных донорских трансплантатов. В I группе в 14 случаях были использованы индивидуальные вертлужные компоненты, напечатанные на 3D-принтере. Индивидуальными конструкциями мы пользовались в случаях, когда геометрия дефекта вертлужной впадины не позволяла заместить его с помощью стандартных конструкций, либо если направление винтов стандартных заводских конструкций не позволило бы добиться прочной фиксации имплантатов.
Результаты исследования и их обсуждение. При анализе срока, прошедшего со времени получения травмы до обращения в клинику эндопротезирования по поводу выраженного деформирующего остеоартроза, было выявлено, что развитие посттравматического коксартроза 3 стадии в I группе наступало статистически достоверно быстрее, чем во II группе (табл. 3).
Таблица 3
Срок развития посттравматического коксартроза 3 стадии
|
Наименование группы |
Срок в годах |
Min |
Max |
Медиана |
|
Группа I (n=189) |
5,2+0,6 |
1 |
40 |
2 |
|
Группа II (n=32) |
7,8+1,7 |
1 |
21 |
5 |
Среднее время операции в I группе 81+3 минуты, кровопотеря 314+36 мл, во II группе кровопотеря 300+24 мл, среднее время операции 75+16 минут. Данные показатели в обеих группах статистически значимо не различались ввиду выполнения оперативных вмешательств одними и теми же хирургами, с использованием идентичного предоперационного планирования и хирургической тактики. Однако средний срок продолжительности стационарного лечения в I группе составил 27,7+16 койко-дня, медиана – 18,8; а во II группе 8,2+0,3 койко-дня, медиана – 8 койко-дней. Данные показатели были связаны с длительным предоперационным периодом вследствие изготовления индивидуальных конструкций, а также с тем, что у пациентов первой группы реабилитационный потенциал был ниже, что потребовало более продолжительного послеоперационного восстановления. Процент осложнений в I группе составил 17% (32 случая), во II группе 6% (2 случая) (рисунок).
При анализе осложнений было выявлено, что наиболее часто встречаемым осложнением являлись нейропатии различных порций седалищного нерва. Столь большое количество связано с тем, что мы учитывали как вновь возникшие нейропатии (6 случаев в I группе), так и рецидивы уже имеющихся неврологических нарушений (17 случаев в обеих группах). Согласно данным проведенных нейрофизиологических исследований, не было выявлено ни одного случая интраоперационного анатомического перерыва седалищного нерва. На фоне проводимой медикаментозной нейропротекторной терапии, физиолечения, лечебной физкультуры в течение 6 месяцев все неврологические нарушения были купированы, необратимых изменений выявлено не было. На втором месте по частоте встречаемости находились вывихи бедренного компонента, связанные с нарушением мышечного баланса и патологическим стереотипом ходьбы у пациентов I группы. Данный вид осложнений возникал до 2015 г., так как с этого периода в нашей клинике были внедрены методики баланс-тренинга и использование вертлужных компонентов с двойной мобильностью.
Количество инфекционных осложнений – как ранних (3 случая), так и поздних (5 случаев), коррелирует с цифрами, приводимыми в современной мировой литературе.
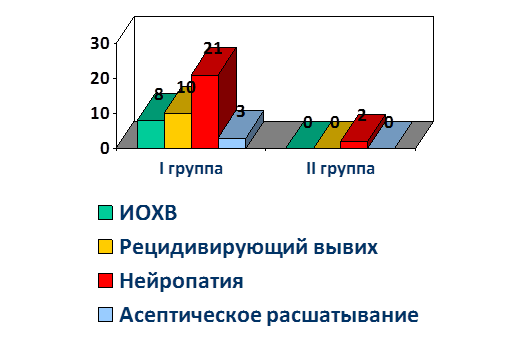
Структура послеоперационных осложнений
Отдаленные результаты от 6 до 27 месяцев отслежены у 182 пациентов – у 153 пациентов I группы и у 25 пациентов II группы. В I группе через 6 месяцев уровень функции сустава по шкале Харриса составил 80,7+17,2, во II группе 83,25+18,6 балла. Ревизионное эндопротезирование в раннем и отдаленном периоде понадобилось 21 пациенту I группы: 10 - по причине рецидивирующего вывиха бедренного компонента (проводилась замена пары трения, замена вертлужного компонента на компонент с двойной мобильностью – 7 человек, и различные варианты миопластики – 3 случая); 8 - по причине глубокой парапротезной инфекции – проведены двухэтапные реэндопротезирования, в течение сроков наблюдения, рецидивов инфекционного процесса выявлено не было. 3 пациентам I группы понадобилось реэндопротезирование по поводу раннего асептического расшатывания компонентов. 2 пациентам проведена замена вертлужного компонента, в 1 случае расшатывание было тотальным. Во II группе ревизионных вмешательств не потребовалось.
Заключение. Раннее оперативное восстановление суставной поверхности у пациентов с переломами вертлужной впадины позволяет замедлить скорость развития посттравматического коксартроза, уменьшает риск развития массивного дефекта вертлужной впадины, что позволяет провести более рутинное первичное эндопротезирование тазобедренного сустава без использования индивидуальных конструкций, уменьшить продолжительность стационарного лечения и снизить количество осложнений. Наиболее часто встречаемым осложнением является рецидив неврологических нарушений, что требует от хирурга проведения тщательного предоперационного планирования, щадящей хирургической техники и проведения широкого комплекса реабилитационных мероприятий.



