Рак желудка в течение последних 10 лет в мире и в России стабильно находится в пятерке самых распространенных злокачественных новообразований с высоким уровнем смертности [1]. Неутешительный прогноз данного заболевания обусловлен агрессивным течением патологического процесса с развитием отдаленных метастазов у 85% больных в течение 3 лет. Метастатическое поражение при раке желудка может развиваться лимфогенным, гематогенным и имплантационным путями. При этом метастатическое поражение брюшной полости, включая брюшину и большой сальник, происходит более чем у 55–60% пациентов [2]. Для совершенствования результатов лечения рака желудка предлагаются методы комбинированного и комплексного лечения [3], однако значимое улучшение возможно только при понимании патогенетических процессов биологического поведения опухоли [4, 5] и при разработке соответствующей направленной терапии. Такой подход требует проведения фундаментальных исследований, что и определило актуальность нашего исследования.
Важную роль в опухолевом росте и диссеминации играет состояние иммунной системы. По современным представлениям взаимодействие злокачественной опухоли и организма-опухоленосителя имеет ряд последовательных фаз: элиминация опухолевых клеток под действием факторов врожденного и адаптивного иммунитета, равновесие с формированием клонов дормантных опухолевых клеток и ускользание опухолевых клеток от действия клеток иммунной системы, сопровождающееся формированием ростостимулирующего и иммуносупрессивного микроокружения [6]. Неотъемлемой частью последнего являются цитокины и факторы роста.
Цитокины – молекулы, продуцируемые активированными иммунокомпетентными и некоторыми другими, в частности опухолевыми и эндотелиальными, клетками, являются регуляторами межклеточных взаимодействий по каскадному пути. Многие из них могут выступать как факторы усиления опухолевой прогрессии, активирующие ангиогинез (IL-1ß, TNF-α), миграцию опухолевых клеток (IL-1ß, IL-6, IL-8), метаплазию эпителиальных клеток (IL-6), некоторые являются стимуляторами и продуктами Т regs (IL-10) [7-9]. В то же время они способны проявлять и антионкогенные эффекты, например IL-1ß, IL-6, IL-8 – путем вовлечения различных звеньев иммунной системы в противоопухолевый ответ, TNF-α – будучи индуктором апоптоза, а IL-10 – за счет антагонизма по отношению к провоспалительным интерлейкинам и повышения продукции в опухоли токсичных молекул (например, оксида азота NO), препятствующих росту новообразования [10].
В последние годы предметом пристального внимания онкоиммунологов является IL-18. Как и у большинства цитокинов, у него выявлены двойственные эффекты на опухолевый рост. С одной стороны, он принадлежит к семейству IL-1ß и стимулирует продукцию интерферона-гамма [11], с другой – дисрегуляция его синтеза в микроокружении некоторых опухолей (таких как множественная миелома, рак предстательной железы) рассматривается как ключевой драйвер опухолевой прогрессии, в связи с чем он является кандидатной мишенью для дальнейшей таргетной терапии [12]. В недавней работе сообщается, что именно IL-18 внутриопухолевого происхождения связан с отрицательным прогнозом при тройном негативном раке молочной железы, что реализуется через стимулирование иммуносупрессивной (незрелой) фракции естественных киллеров и экспрессии на них PD-1 [13].
Для проявления перечисленных разнонаправленных эффектов представляются важными именно локальные концентрации цитокинов, поскольку характер их действия является короткодистантным. Взаимодействие «опухоль – организм» с участием цитокинов имеет место и является объектом исследования при различных опухолях, причем изучается возможность использования цитокиновых показателей в качестве прогностических. Ранее нами была показана прогностическая значимость локального цитокинового состава в опухоли и перитуморальной зоне при меланоме кожи и раке пищевода [14, 15], подобные исследования проводятся и в других странах при различных опухолях [16, 17].
В последние годы появились единичные исследования тканевых цитокинов и при раке желудка [18], в ходе которых авторами сделаны интересные находки; высказано мнение о несомненной, хотя и противоречивой роли цитокинов в процессах канцерогенеза в желудке [19].
Целью данной работы является изучение содержания цитокинов при различных аденокарциномах желудка в опухоли и перитуморальной зоне.
Материал и методы исследования
Проанализированы данные о 31 больном раком желудка в возрасте от 31 до 81 года. Среди них было 18 мужчин, 13 женщин. Гистологически у всех больных были определены аденокарциномы средней и низкой степени дифференцировки. Больные подвергались лечению в ФГБУ «РНИОИ» МЗ РФ в период с 2017 по 2019 гг. В группу М0 были включены 23 больных без отдаленного метастатического поражения T1-4N0-2M0; оперативные вмешательства у них проводились в полном объеме с выполнением лимфодиссекции D2 и носили радикальный характер. В группу М1 были включены 8 больных раком желудка T2-4N0-3M1 с отдаленным метастатическим поражением брюшины, в том числе большого сальника, из них 4 больным были выполнены циторедуктивные операции, а у 4 больных оперативные вмешательства носили диагностический характер.
Для исследования цитокинового состава в тканях фрагменты удаленной опухолевой ткани и перитуморальной зоны (ПЗ) дезинтегрировали с помощью дезагрегирующего устройства BD Medimachine. Полученные клеточные суспензии центрифугировали; в супернатантах определяли уровни провоспалительных и противовоспалительных цитокинов (TNF-α, IL-1ß, IL-2, IL-6, IL-8, IL-10) методом ИФА с тест-системами «Вектор-Бест» (Новосибирск) и IL-1RA (eBioscience, Austria) в соответствии с инструкциями фирмы-производителя. Результаты выражали в виде удельного содержания в пересчете на 1 г белка гомогената, оцениваемого биуретовым методом (пг/мл/г белка).
Статистическая обработка результатов проводилась с использованием пакета программ Statistika 6.0 по t-критерию Стьюдента для двух независимых выборок. Различия считали статистически значимыми при p<0,05, а при 0,1>p>0,05 – на уровне статистической тенденции к значимости. Предварительно проводили проверку выборок на соответствие нормальному распределению по W-критерию Шапиро–Уилка и критерию Колмогорова–Смирнова.
Результаты исследования
Результаты исследования представлены в таблицах 1, 2 и на рисунках 1–3.
Как видно из таблицы 1, при сравнении показателей опухоли и ПЗ для М0 виден ряд различий: в опухолях статистически значимо выше, чем в ПЗ, были уровни IL-6, IL-8, IL-18 и ниже – уровни IL-1RА и IL-10.
Таблица 1
Удельные уровни цитокинов в образцах тканей опухолей и перитуморальных зон при разной распространенности рака желудка (пг/мл/г)
|
Цитокины |
Образцы тканей |
|||
|
ОП |
ПЗ |
|||
|
М0 (n=23) |
М1 (n= 8) |
М0 (n=23) |
М1 (n= 8) |
|
|
IL-1β |
108,3±40,1 |
65,0±24,8 |
37,7±6,3 |
25,8±3,3 |
|
IL-2 |
5,5±1,8 |
5,6±2,0 |
7,1±1,2 |
5,48±1,53 |
|
IL-6 |
63,0±27,5* |
58,0±21,0 ** |
8,3±2,3* |
6,6±1,9 ** |
|
IL-8 |
93,3±34,6* |
88,8±31,8 ** |
22,9±7,7* |
8,5±3,0 ** |
|
TNF-α |
3,3±0,8 |
3,7±0,5 |
4,3±0,5 |
4,3±0,7 |
|
IL-18 |
260,2±69,1* |
134,9±65,1 |
88,0±22,1* |
47,7±11,9 |
|
IL-10 |
4,1±1,0* |
6,9±2,3 |
9,3±2,8* |
6,6±1,6 |
|
IL-1RA |
4643,4±930,1* |
7573,0±3327,5 |
9418,7±1533,6* |
9529,9±2282,8 |
Примечание: * – статистически достоверные различия между показателями опухоли и ПЗ при опухолях М0 (t>2); ** – статистически достоверные различия между показателями опухоли и ПЗ при опухолях М1 (t>2)
При опухолях М1 отмечены статистически значимые различия между опухолью и ПЗ по удельным уровням двух цитокинов, а именно в опухоли по сравнению с ПЗ отмечается более высокое содержание IL-6 и IL-8. Уровни IL-1β и IL-18 при опухолях М1, хотя и не демонстрируют статистически достоверных различий между опухолью и ПЗ, имеют тенденцию к более высоким показателям в ткани опухоли. При анализе без разделения на G2 и G3 различий между тканевыми уровнями цитокинов в зависимости от распространенности процесса не наблюдалось ни в опухоли, ни в ПЗ.
В таблице 2 представлены данные по содержанию цитокинов в образцах тканей опухолей G2 при наличии и отсутствии метастазирования.
Таблица 2
Удельные уровни цитокинов в образцах тканей опухолей и перитуморальных зон при степени дифференцировки G2 и разной распространенности рака желудка (пг/мл/г)
|
Цитокины |
Образцы тканей |
|||
|
Опухоль |
ПЗ |
|||
|
М0 |
М1 |
М0 |
М1 |
|
|
G2 (n=23) |
G2 (n= 5) |
G2 (n=23) |
G2 (n=5) |
|
|
IL-1β |
79,2±20,8* |
70,7±34,2 |
31,8±8,1* |
21,3±2,0 |
|
IL-2 |
6,0±2,4 |
3,0±0,9 |
8,3±1,7*** |
3,3±0,8*** |
|
IL-6 |
43,1±14,2* |
30,4±20,7 |
8,9±3,1* |
3,9±0,6 |
|
IL-8 |
68,8±15,7* |
63,8±16,7 * ** |
23,8±11,6* ** |
5,1±1,0** |
|
TNF-α |
2,7±0,4* |
3,9±0,6 |
4,6±0,6* |
4,4±0,9 |
|
IL-18 |
340,2±105,4* |
183,6±104,8 |
101,9±35,4* |
38,8±7,4 |
|
IL-10 |
4,1±1,0 |
3,9±1,5 |
10,1±4,2 |
5,6±2,0 |
|
IL-1RA |
4453,3±708,5 |
4299,6±696,9 |
7284,0±1700,9 |
6373,3±1320,0 |
Примечание: * – статистически достоверные различия между показателями опухоли и ПЗ при опухолях М0 (t>2); ** – статистически достоверные различия между показателями опухоли и ПЗ при опухолях М1 (t>2); *** – статистически достоверные различия между показателями ПЗ при опухолях М0 и М1 (t>2).
Как видно из приведенных в таблице результатов, в опухолях М0 степени дифференцировки G2 выявлены статистически значимые различия по содержанию IL-1ß, IL-6, IL-8, IL-18 и TNF-α, причем последний был выше в ПЗ, а остальные – в опухоли. Обнаружено единственное статистически значимое различие между М0 и М1 опухолями – в ПЗ последних содержание IL-2 оказалось в 2,5 раза ниже. По остальным показателям можно говорить только о тенденции, которая не нашла статистически значимого выражения в связи с немногочисленностью наблюдений в группе М1 G2 и существенной индивидуальной вариабельности, присущей цитокиновым показателям.
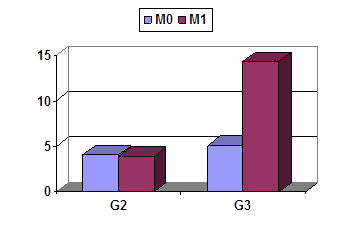
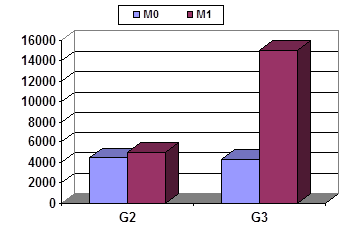
Сравнительная характеристика содержания некоторых цитокинов, содержащихся в опухоли и в ПЗ, метастазирующих и неметастазирующих опухолей с разной степенью дифференцировки представлена на рисунках 1–3. В ткани опухоли различия выявляются только при G3 и касаются удельных уровней IL-10 (рис. 1А) и IL-1RА (рис. 1Б), которых в опухолях М1 содержится в 3 раза больше, чем в опухолях М0.
Показатели для IL-10 составляют 5,1±2,4 и 14,3±3,3 пг/мл/г, для IL-1RА – 4996,4±2435,3 и 15756,7±1157,2 пг/мл/г соответственно; в обоих случаях t>2.
A
Б
Рис. 1. Удельные уровни некоторых цитокинов в опухолях желудка G2 и G3 с разной распространенностью. Ось Y – пг/г/мл
А – IL-10; Б – IL-1RA
В ткани ПЗ выявляются разнонаправленные различия между М0 и М1 в зависимости от степени дифференцировки по удельному уровню IL-2 (рис. 2). Степень дифференцировки G2 сопровождается более высоким уровнем этого цитокина в ПЗ неметастазирующей опухоли, а G3 – в ПЗ метастазирующей опухоли, что может свидетельствовать о его возможном значении не только в индукции иммунного ответа, но и диссеминации опухоли. По крайней мере в ПЗ его количество оказалось наибольшим (11,9±1,5 пг/мл/г) при наиболее агрессивных опухолях из исследованных нами – низкодифференцированных аденокарциномах стадии М1, хотя в опухолевой ткани подобных различий не наблюдается.
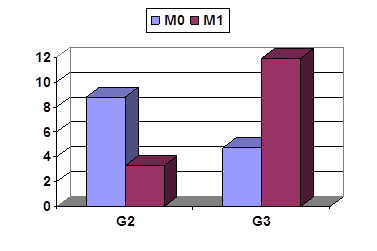
Рис. 2. Удельные уровни IL-2 в ПЗ опухолей желудка G2 и G3 с разной распространенностью. Ось Y – пг/г/мл
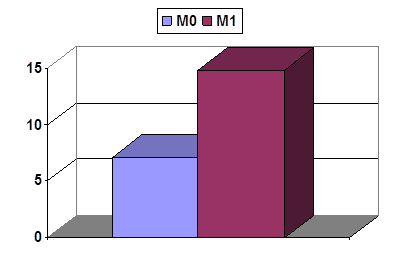
Рис. 3. Удельные уровни IL-6 в ПЗ опухолей желудка G3 разной распространенностью. Ось Y – пг/г/мл
Как видно из рисунка 3, на котором представлены уровни IL-6 в ПЗ опухолей М0 и М1 со степенью дифференцировки G3, в метастазирующих опухолях данный показатель оказался статистически достоверно выше, чем в неметастазирующих (14,9±1,1 и 7,1±3,1 пг/мл/г соответственно, t>2), что представляется объяснимым с учетом известных видов его биологической активности, связанной с индукцией пролиферации, метапластических изменений и неоангиогенеза.
Обсуждение результатов исследования
Несмотря на системный характер опухолевой болезни, микроокружение опухоли является той средой, в которой происходят наиболее тонкие и тесные взаимодействия между ней и защитными системами организма, основной из которых является иммунная система [20]. Проведенное нами исследование позволило выявить некоторые различия показателей цитокинового микроокружения в аденокарциномах желудка в зависимости от их распространенности и степени дифференцировки.
На основании полученных результатов можно предположить, что прогрессирование опухоли, а именно ее диссеминация, связано, в частности, с изменением содержания в опухоли и в ПЗ ряда исследованных нами цитокинов. Гиперпродукция в опухолевом очаге IL-6 и IL-8 приводит к стимуляции опухолевого роста, миграции клеток, усилению неоангиогенеза [21]; нарастание их локальных концентраций способствует распространению опухоли [22], что наблюдалось нами при сравнительной оценке более агрессивных опухолей (М1 G3) с менее агрессивными (М0 G2).
Нарастание при низкодифференцированных аденокарциномах желудка уровня IL-1RА, по-видимому, реализуется в виде подавления иммунных реакций, связанных с инициальным интерлейкином иммунного ответа – IL-1ß; повышение уровня IL-10 свидетельствует о наибольшей выраженности локальной иммуносупрессии в них.
Как и другие ранее исследованные нами опухоли [23], аденокарцинома желудка отличается от прилежащих к ней неопухолевых тканей более высоким содержанием провоспалительных цитокинов, нарастающим при увеличении распространенности процесса. Однако мы считаем важными и изменения, наступающие в ПЗ при таких проявлениях агрессивности опухоли, как наличие метастазирования в сальник и брюшину, снижение степени дифференцировки. Нами установлено, что эти изменения характеризуются нарастанием уровня как IL-1ß, так и его рецепторного антагониста, а также IL-2 и IL-6. При опухолях без метастазирования различий цитокинового состава в ткани перитуморальной зоны в зависимости от степени дифференцировки не отмечено. Такие различия цитокинового состава ткани ПЗ свидетельствуют о важности изученных показателей не только в самой опухоли, но и в прилежащей к ней ткани.
Выводы
1. Исследованные показатели тканевых уровней цитокинов характеризуют как наиболее неблагоприятные из изученных опухолей аденокарциномы желудка с минимальной дифференцировкой и максимальной распространенностью: М1 G3.
2. Полученные данные о цитокиновом составе опухолей и перитуморальных зон могут иметь значение для оценки прогноза течения заболевания и могут быть использованы для разработки прогностических алгоритмов у больных аденокарциномами желудка.



