Ревматоидный артрит (РА) ассоциируется с повышенным риском сердечно-сосудистых заболеваний (ССЗ). Несмотря на достигнутые успехи по контролю над РА, примерно 50% случаев преждевременной смерти связано с ССЗ [1]. Известно, что хроническое воспаление предрасполагает к развитию эндотелиальной дисфункции и повышению жесткости артерий. Помимо этого, большинство традиционных факторов риска и ССЗ, в частности гипертоническая болезнь (ГБ), оказывают неблагоприятное влияние на артериальную жесткость [2]. Артериальная жесткость является важным маркером субклинического атеросклероза и повышенного кардиоваскулярного риска (КВР) [3–5]. Тем не менее механизмы артериальной ригидности при РА недостаточно определены, поскольку все еще остается высоким КВР, несмотря на применение базисных противовоспалительных препаратов (БПВП). Широкое их применение выявило вариабельность кардиоваскулярных эффектов у пациентов с РА [6].
Метотрексат (МТ) – синтетический БПВП, применяемый в качестве первой линии терапии РА, с подтвержденной многочисленными исследованиями клинической эффективностью. В то же время имеются сообщения о его способности снижать развитие ССЗ [6–8]. В настоящее время подкожная форма МТ – методжект (МТД) – приобретает тенденцию к широкому использованию, что связано с более высокой биодоступностью препарата в сравнении с пероральным приемом [9–11]. Ритуксимаб (РТМ) – биологический БПВП, который используется при недостаточном ответе на терапию синтетическими БПВП или их непереносимости. При лечении РТМ отмечались клинически значимые улучшения у пациентов с активным и многолетним течением РА, а также улучшение эндотелиального состояния [12–14]. Известно, что и МТ и РТМ снижают риск кардиоваскулярных событий [2, 15, 16].
Однако до сих пор продолжается поиск фармакотерапевтических подходов, включающих в себя контроль над РА-ассоциируемым провоспалительным состоянием и снижение риска ССЗ.
С учетом всех соображений целью настоящего исследования явилась оценка дозозависимого воздействия подкожной формы МТ в комбинации с ритуксимабом на артериальную жесткость у больных РА с коморбидной патологией.
Материал и методы исследования
В исследовании приняли участие 205 пациентов с установленным диагнозом РА, отвечающим классификационным критериям, среди которых были лица с ГБ 2-й степени (n=112) с низким и умеренным риском по модифицированной шкале SCORE. Продолжительность РА при нормотензии составляла 3,9±1,3 года; в группе с РА и ГБ 2-й степени – 4,7±1,9 года, а средняя длительность ГБ составляла 3,1±1,2 года. У всех пациентов ГБ зарегистрирована после дебюта РА. Пациенты до включения в исследование не получали МТ/МТД и биологические БПВП.
Группа контроля состояла из 31 условно здорового добровольца, соизмеримого по демографическим параметрам без хронических ревматических и кардиоваскулярных заболеваний.
Пациенты были распределены на следующие фармакотерапевтические когорты: 1-я получала лечение РТМ 1000 мг (по схеме) с МТД в дозе 10 мг/мл в неделю, в нее входили лица с нпРА по РФ (21–60 МЕ/мл) и АЦЦП (6–15 Ед/мл); 2-я когорта – РТМ 1000 мг (по схеме) с МТД в дозе 20 мг/мл в неделю с впРА по РФ (≥ 61 МЕ/мл) и АЦЦП (≥ 15 Ед/мл). При классификации иммунотипа РА в спорных случаях предпочтение отдавалось АЦЦП как более специфичному и чувствительному маркеру.
Оценка клинико-лабораторно-инструментальных данных проводилась до начала фармакологической коррекции и через 12 месяцев.
Критериями исключения служили: серонегативный вариант РА по РФ и АЦЦП, IV рентгенологическая стадия и ФК; индекс DAS28 <3,2 балла; наличие симптоматической артериальной гипертензии, ГБ 1-й и 3-й степени, высокий и очень высокий риск; наличие таких традиционных факторов риска, как дислипидемия, курение, ожирение, сахарный диабет; предшествующее лечение биологическими ГИБП; сопутствующие заболевания: любые формы ишемической болезни сердца, декомпенсированные заболевания сердца, печени и почек, декомпенсированные формы дыхательной недостаточности.
Для исследования жесткости периферических артерий использовались анализ данных пульсовой волны с оценкой индексов жесткости (SI), отражения (RI) и аугментации (AIp75), а также измерение центрального систолического давления (SPa, мм рт. ст.) на аппарате «АнгиоСкан-01», РФ. Оценка выраженности ЭД проводилась на основании фотоплетизмографических критериев, полученных в результате окклюзионной пробы: индекса окклюзии по амплитуде и сдвига фаз между каналами. Суточное мониторирование АД и артериальная жесткость исследовались на аппарате BPLab® («Петр Телегин», г. Нижний Новгород) с вычислением среднесуточных показателей систолического и диастолического АД, индекса аугментации (АIх, %).
Статистический анализ происходил с применением Microsoft Еxcel и статистической среды RStudio (версия 3.5.1, 2018). Данные презентированы как среднее значение и стандартное отклонение (М±σ) при нормальном распределении, при неоднородном – медиана с интерквартильным размахом [Ме25; Me75 процентиль]. При ненормальном распределении для установления значимости различий между признаками проводился корреляционный анализ по Спирмену, при упорядоченном – по Пирсону. Значимость различий «до и после лечения» проверяли по t-критерию Стьюдента (до 2 групп) или Ньюмена–Кейлса (несколько групп), при неупорядоченной совокупности – по критерию Манна–Уитни (до 2 групп) или Крускала–Уоллиса (несколько групп). Для сравнения качественных свойств в несвязанных группах применялся дисперсионный анализ (ANOVA).
Результаты исследования и их обсуждение
Зарегистрированные исходные значения индексов AIp75, SI, RI, а также суточного индекса AIp у всех пациентов с РА превышали таковые из контрольной группы.
Использование РТМ и МТД 10 мг/мл у пациентов с нпРА вызывало снижение AIp75 в 2,1 раза (р<0,01), при ЭД – в 1,6 раза (р<0,01), а у лиц с впРА с использованием РТМ и МТД 20 мг/мл – в 1,8 раза (р<0,01) и в 1,3 раза (р<0,05) без и с ЭД соответственно. Несмотря на положительную динамику, AIp75 оставался положительным, что говорит о сохраняющейся повышенной жесткости (рис. 1 а, в). При проведении фармакологической коррекции РТМ и МТД 10 мг/мл в группе нпРА с ГБ 2-й степени и умеренной ЭД AIp75 уменьшался в 1,6 раза (р<0,05), а при выраженной ЭД значимого снижения с исходными показателями не происходило. В группе с впРА и ГБ 2-й степени с использованием РТМ и МТД 20 мг/мл динамика AIp75 была менее показательной. Так, при умеренной ЭД уменьшение происходило в 1,3 раза (р<0,05), а при выраженной ЭД достоверного снижения не отмечалось (рис. 1 б, г).
а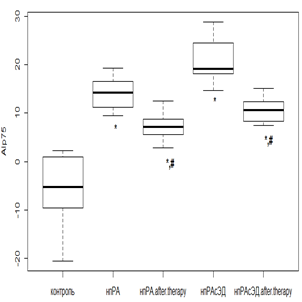 б
б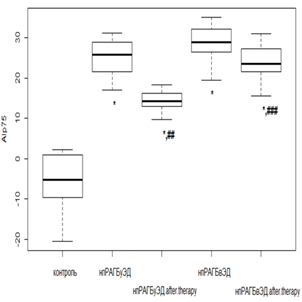
в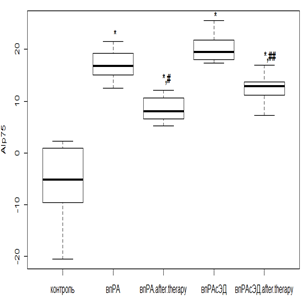 г
г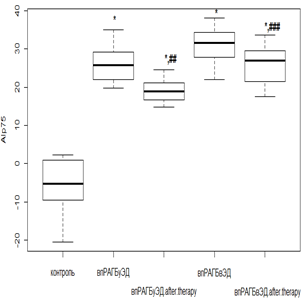
Примечание: Здесь и далее достоверное отличие от группы контроля: * – р<0,01; ** – р<0,05; *** – р>0,05. Достоверное отличие от исходных значений: # – р<0,01; ## – р<0,05; ### – р>0,05.
Рис. 1. Динамика индекса AIp75 на фоне лечения у пациентов с: а – нпРА; б – нпРА и ГБ 2-й степени; в – впРА; г – впРА и ГБ 2-й степени
Комбинированная терапия на суточный индекс AIx оказывала действие, аналогичное предыдущему показателю. Так, у нпРА пациентов при использовании РМТ и МТД 10 мг/мл происходило снижение AIx в 1,8 раза (р<0,01) при исходной ЭД, а в случае ее отсутствия показатель приобрел отрицательные значения (рис. 2а), но оставался выше значений группы контроля. Терапия РТМ и МТД 20 мг/мл у впРА пациентов при отсутствии ЭД способствовала снижению AIx в 1,7 раза (р<0,05), а в случае начальной ЭД отмечалась положительная реакция на лечение, но статистически не значимая (рис. 2в).
При ГБ 2-й степени у пациентов с нпРА с умеренной ЭД AIx уменьшался от исходных величин в 1,3 раза (р<0,05), а в случае выраженной ЭД – в 1,2 раза (р>0,05), но статистически не значимо (рис. 2б). Среди впРА с ГБ 2-й степени индекс AIx (рис. 2г) при умеренной ЭД уменьшался в 1,3 раза (р<0,05), а вот с выраженной ЭД динамика снижения AIx была минимальной и не претерпевала порога статистической значимости (р>0,05).
а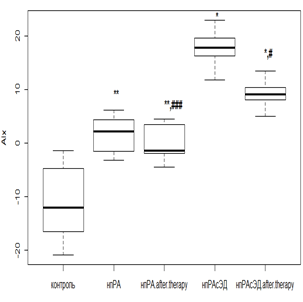 б
б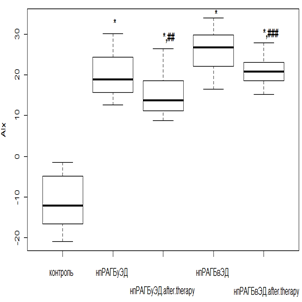
в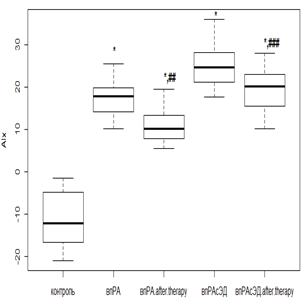 г
г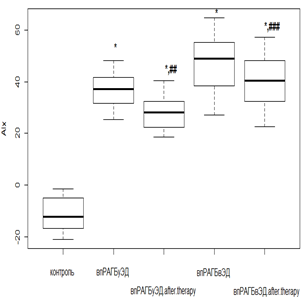
Рис. 2. Динамика индекса AIx на фоне лечения РМТ и МТД у пациентов с: а – нпРА; б – нпРА и ГБ 2-й степени в – впРА; г – впРА и ГБ 2-й степени
Уменьшение индексов AIp75, как и суточного AIx, достигалось у пациентов с РА при невыраженных функциональных расстройствах. Это является подтверждением того, что ранняя и агрессивная стартовая терапия приводит к улучшению состояния артериальной стенки. В то же время на стадии коморбидных осложнений при длительном воздействии аутоиммунного воспаления фармакологические вмешательства, направленные на коррекцию повышенной жесткости сосудистой стенки, не приводили к подобным результатам.
Фармакологическая коррекция РТМ с МТД 10 мг/мл у пациентов нпРА и исходным нормальным эндотелиальным состоянием не вызывала значимых колебаний индекса SI (р>0,05). В случае же первичного наличия ЭД при нпРА происходило падение SI в 1,2 раза (р<0,05). При использовании РТМ и МТД 20 мг/мл с впРА индекс SI с более высокими исходными показателями снижался в 1,3 раза (р<0,05), а при наличии ЭД – в 1,2 раза (р<0,05) (рис. 3 в, г).
Наименьший ответ на фармакологическую коррекцию был получен в группах с ГБ 2-й степени. Слабая положительная реакция проявлялась у лиц с умеренной ЭД при использовании как РТМ и МТД 10 мг/мл (рис. 3а), так и РТМ и МТД 20 мг/мл (рис. 3б), приводящем к снижению SI в среднем 1,2 раза (р<0,05) от исходных величин. Фармакологические вмешательства при более выраженных эндотелиальных расстройствах индекс SI снижался незначительно как при лечении РТМ и МТД 10 мг/мл (рис. 3в), так и при РМТ и МТД 20 мг/мл (рис. 3г).
а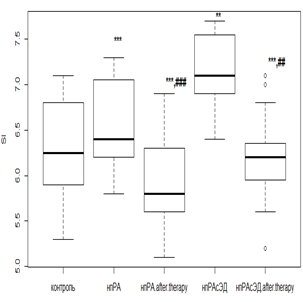 б
б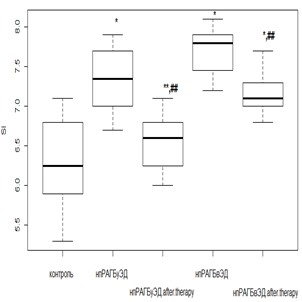
в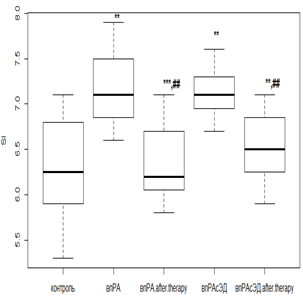 г
г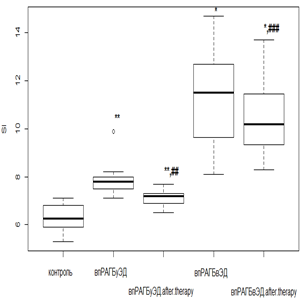
Рис. 3. Динамика индекса SI у пациентов с нпРА (а, б) и впРА (в, г) с ГБ 2-й степени на фоне лечения
Индекс SI определяет аорто-эластические свойства и коррелирует со скоростью распространения пульсовой волны, что может послужить альтернативой в поиске субклинического поражения сердечно-сосудистой системы. По результатам фармакологических вмешательств можно сказать, что при исходно не выраженных эндотелиальных расстройствах у пациентов с РА возможна коррекция индекса SI и, как следствие, улучшение эластических качеств аортальной стенки. Попытки фармакологической коррекции, предпринятые на этапе выраженных эндотелиальных расстройств независимо от иммунотипа РА и дозового режима МТД, не приводили к значимому улучшению показателей, характеризующих упруго-эластические свойства.
Индекс RI, наоборот, оценивает сосудистый тонус мелких артерий. Повышение данного показателя говорит о наличии вазоспазма в микрососудистом бассейне. Исходно RI в значительной степени был повышен у всех без исключения пациентов с РА по отношению к контрольной группе. Использование РТМ и МТД 10 мг/мл у пациентов с нпРА (рис. 4а) приводило к уменьшению RI в 1,4 раза (р<0,01), а при ЭД – в 1,6 раза (р<0,01). В то же время при лечении РТМ с МТД 20 мг/мл в группе с впРА (рис. 4б) снижение RI было в 2,1 раза (р<0,01) без ЭД, а при ее наличии – в 2,4 раза (р<0,01). Показатели RI после фармакологической коррекции у лиц без коморбидной патологии имели сопоставимые значения с показателями группы контроля.
Кроме того, использование РТМ и МТД 10 мг/мл у нпРА с ГБ 2-й степени и умеренной ЭД вызывало снижение RI (рис. 4в) в 1,7 раза (р<0,01), а при выраженной – в 1,3 раза (р<0,05). Применение РТМ и МТД 20 мг/мл с впРА и ГБ 2-й степени (рис. 4г) приводило к уменьшению RI в 1,6 раза (р<0,01) при умеренной ЭД и в 1,4 раза (р<0,01) – при выраженной ЭД. Учитывая эти данные, можно сказать, что противовоспалительная терапия в большей степени оказывает корригирующее влияние на функциональные изменения, происходящие в микрососудистом русле.
а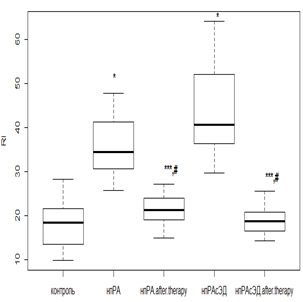 б
б 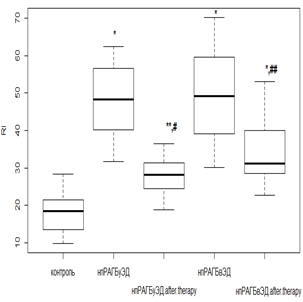
в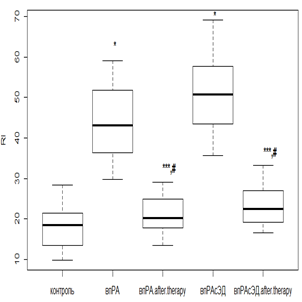 г
г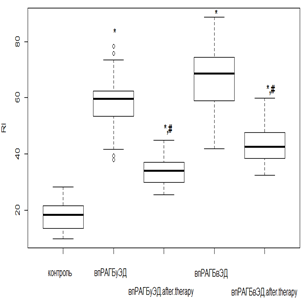
Рис. 4. Изменение индекса RI у пациентов с нпРА (а, б) и впРА (в, г) и ГБ 2-й степени на фоне лечения
Совместно с оценкой влияния терапии на жесткость артериальной стенки проводилась и оценка суточного профиля систолического и диастолического АД. Не выявлено существенной разницы между группами нпРА и впРА при исходной нормотензии, а также отличий от группы контроля. У участников исследования при коморбидном РА уровень систолического и диастолического АД статистически значимо был выше уровня в группе контроля (в среднем в 1,5 раза, р<0,05). При этом статистических различий между подгруппами не прослеживалось.
На фоне противовоспалительной терапии у лиц с нпРА и впРА при исходно нормальном уровне АД значимых колебаний суточного профиля АД не происходило.
Стоит подчеркнуть, что в группах с отягощенным течением РА, помимо противовоспалительной терапии, проводилась и гипотензивная терапия сартанами в эквивалентных дозах (валсартан 320 мг/сут). По результатам СМАД было зарегистрировано снижение и систолического (рис. 5а), и диастолического (см. рис. 5б) АД по сравнению с первичными показателями. В группе с нпРА и ГБ 2-й степени с умеренной ЭД с основным лечением РТМ и МТД 10 мг/мл снижение систолического АД достигало 1,3 раза (р<0,05), а при выраженной – 1,2 раза (р<0,05) по сравнению с исходным АД. При впРА с умеренной ЭД систолическое АД уменьшалось в 1,2 раза (р<0,05), а при выраженной ЭД статистически значимой разницы не выявлено (рис. 5а). Аналогичная динамика была зарегистрирована и для диастолического АД, где в группе нпРА с умеренной и выраженной ЭД уменьшение диастолического АД по сравнению с исходным в среднем составило 1,3 раза (р<0,05), а в группе впРА – 1,2 раза (р<0,05) соответственно (рис. 5б).
а б
б
Рис. 5. Суточный профиль систолического (а) и диастолического (б) АД у пациентов с РА и ГБ 2-й степени на фоне лечения
Уровень систолического АД, определяемого на плечевой артерии, не всегда сопоставим с аортальным. В исследовании ASCOT было установлено, что центральное аортальное давление – более чувствительный гемодинамический параметр, коррелирующий с риском развития неблагоприятных кардиоваскулярных исходов. Для этой цели испытуемым проводилось исследование контурного анализа пульсовой волны, в конце которого происходил расчет систолического аортального давления (SPa).
Как и в случае с суточным профилем АД, у пациентов с нормотензией не выявлено статистического повышения SPa (рис. 6а) по сравнению с контрольной группой, как и динамического изменения на фоне фармакологического вмешательства. При сопутствующей ГБ 2-й степени отмечалось статистически значимое увеличение SPa по отношению к контрольной группе и пациентам с РА и нормотензией. При использовании РТМ и МТД 10 мг/мл величина SPa (рис. 6б) у пациентов с нпРА в среднем снижалась в 1,3 раза (р<0,05) при умеренной и выраженной ЭД, а среди впРА – в 1,2 раза (р<0,05).
а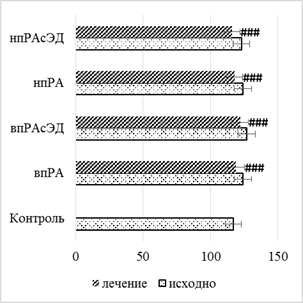 б
б
Рис. 6. Динамика SPa у больных с РА (а) и РА с ГБ 2-й степени (б) на фоне лечения РТМ и МТД
Заключение
Результаты данного исследования показали, что у пациентов с нпРА применение низкодозового режима (РТМ и МТД 10 мг/мл) приводило к улучшению артериально-эластических свойств, в то время как у пациентов с впРА терапия с использованием высоких доз МТД 20 мг/мл способствовала более выраженному васкулопротекторному эффекту. При коморбидных состояниях с умеренными эндотелиальными нарушениями лечение РТМ с МТД 10 мг/мл и РТМ с МТД 20 мг/мл оказывало благоприятное влияние на артериальную жесткость. При развитии выраженных сосудистых функциональных расстройств у пациентов как с нпРА, так и с впРА лечение сопровождалось развитием минимальных положительных реакций. Наблюдаемые различные воздействия противоревматического лечения на артериальную ригидность могут быть основаны на иммунотипах РА и степени сосудистого повреждения. Таким образом, полученные данные подтверждают, что раннее противоревматическое лечение важно не только для предотвращения костно-деструктивных изменений, но и для развития атеросклероза.



