Актуальность. В настоящее время отмечено увеличение количества пациентов с циррозом печени (ЦП). Течение заболевания негативно сказывается на качестве жизни и трудоспособности. Наряду с возросшим количеством случаев вирус-ассоциированного ЦП остается значительной доля больных с алкогольной и аутоиммунной этиологией заболевания. Повышение давления в системе воротной вены (ВВ) сопряжено с развитием ряда жизнеугрожающих осложнений. Портальная гипертензия (ПГ) приводит к варикозной трансформации вен эзофаго-кардиального перехода. Развитие пищеводно-желудочного варикоза наблюдается у подавляющего количества пациентов с ЦП (до 98 %) [1]. Пищеводно-желудочная геморрагия является ведущей причиной смерти у таких больных. При первом же эпизоде кровотечения погибает более половины из них, при второй и третьей геморрагии – до 80 % [2]. В свою очередь, течение внутрипеченочной ПГ в ряде случаев сопряжено и с возможностью развития печеночной энцефалопатии (ПЭ) и гепаторенального синдрома (ГРС) на фоне печеночно-клеточной недостаточности [3].
В настоящее время эффективным и малотравматичным методом лечения и профилактики осложнений ПГ считается операция трансъюгулярного внутрипеченочного портосистемного шунтирования (TIPS/ТИПС) [4]. В клинике РостГМУ в 2007–2017 гг. этому вмешательству подверглись 224 больных. Непосредственный хирургический успех при этой операции достигает 96 %. Отдельную проблему представляют тромбозы шунта при операции TIPS/ТИПС и повторные эндоваскулярные вмешательства. Ниже приведен клинический случай успешной повторной операции.
Пациентка П., 66 лет, поступила в хирургическое отделение клиники РостГМУ в марте 2016 г. Диагноз: аутоиммунный ЦП, портальная гипертензия, пищеводно-желудочный варикоз 3 степени. Первым проявлением заболевания стало пищеводное кровотечение в 2009 г., остановленное комплексом компрессионно-медикаментозных мероприятий. Степень фиброза при эластометрии печени составляла 23,4kPa (F4). С декабря 2014 г., после установления аутоиммунного генеза ЦП в комплекс лечебных мер добавлены кортикостероиды, позволившие в течение 6 месяцев добиться нормализации активности трансаминаз. В 2009–2016 гг. отмечено 3 эпизода варикозной геморрагии. Неоднократно выполнялось эндоскопическое лигирование пищеводных вариксов (рис.1).
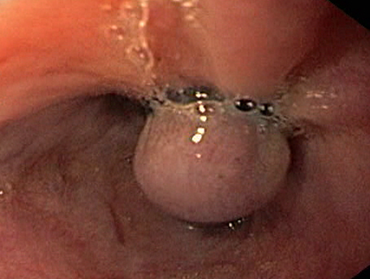
Рис. 1. Эндоскопическое лигирование пищеводных вариксов
В течение месяца, перед операцией, проводилась медикаментозная адаптирующая портальная декомпрессия препаратами пропронолол 10 мг 2 раза в сутки под контролем системного артериального давления и октреотид 100 мкг п/к 1 раз в сутки. Проведенная терапия позволила добиться некоторого снижения давления в системе воротной вены, что подтверждено уменьшением размеров селезенки и рядом других признаков, представленных в таблице.
Признаки снижения давления в системе воротной вены
|
Признак |
Исходно |
После мед. лечения |
|
Размер селезенки во фронтальной полоскости при УЗИ, мм. |
187 |
161 |
|
Диаметр ВВ, мм. |
16 |
14 |
|
Диаметр селезеночной вены, мм |
10 |
10 |
|
Максимальная линейная скорость кровотока по ВВ, см/сек |
16 см/с |
19 см/с |
Показанием к проведению операции TIPS/ТИПС явилась осложнение ПГ, наличие пищеводных вариксов 3 степени с признаками угрозы разрыва. В апреле 2016 г. выполнена операция TIPS/ТИПС, дополненная эмболизацией левой желудочной вены (ЛЖВ). ЛЖВ эмболизирована двумя спиралями Gianturco (рис. 2).
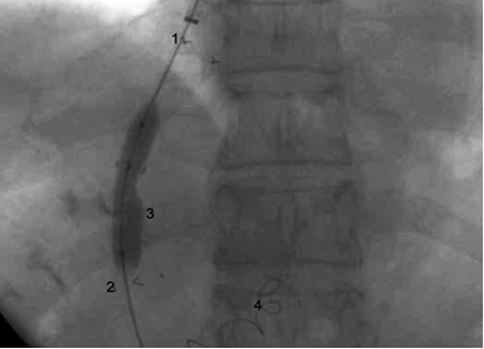
Рис.2. Интраоперационная ангиограмма, цифрами обозначены:
1. Печеночная вена; 2. Воротная вена; 3. Баллонная постдилятация стента, установленного в портосистемном канале; 4. Спирали Gianturco в левой желудочной вене
Интраоперационная манометрия выявила давление в ВВ 39 мм рт. ст. до и 13 мм рт. ст. после шунтирования, в правой печеночной вене до шунтирования 5 мм рт. ст., после -7 мм рт. ст. Таким образом, портосистемный градиент давления (ПСГД), составил до шунтирования 34 мм рт. ст., после – 6 мм рт. ст. Установлен стент-графт между правой печеночной и правой браншей воротной вены длиной 80 мм с шириной просвета 10 мм частично покрытый. Послеоперационный период протекал без осложнений. Коррекция гипераммониемии проводилась препаратами лактулозы, рифаксимина, орнитин-аспартата [5]. С целью профилактики тромбоза шунта назначены дезагреганты (ацетилсалициловая кислота 100 мг 1 раз в сутки) и антикоагулянты (энокссапарин 40 мг/сутки п/к 1 раз в день).
Отмечено уменьшение размеров селезенки до 9 см во фронтальной плоскости (по данным УЗИ).
Ухудшение состояния отмечено в ноябре 2016 г. – рецидив пищеводного кровотечения. Гемостаз достигнут комплексом компрессионно-медикаментозных мероприятий (гемостатическая терапия, установка зонда-обтуратора Блэкмора). Установлен тромбоз шунта, основываясь на отсутствии кровотока при доплерометрии сосудов печени.
13.12.16 г. в РостГМУ выполнена повторная операция портосистемного шунтирования реTIPS/ТИПС параллельной методикой (рис. 3).
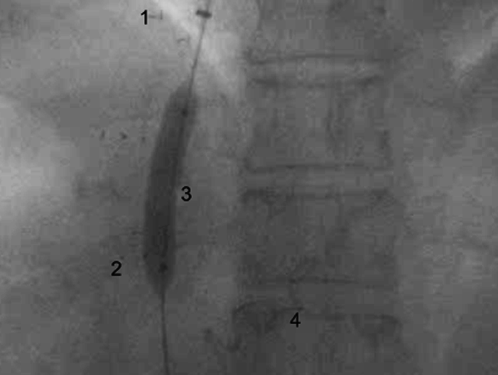
Рис.3. Формирование внутрипеченочного канала параллельной методикой, цифрами обозначены: 1.Проксимальный конец стента, установленный в печеночной вене (04.2016 г.);
2. Дистальный конец стента, установленный в воротной вене (04.2016 г.); 3.Формирование нового канала перед установкой стента параллельной методикой (балонная дилатация);
4. Спираль Gianturco, установленная в левую желудочную вену (04.2016 г.)
Выбор параллельной методики операции основывался на высокой вероятности возникновения тромбоэмболических осложнений при формировании канала внутри уже установленного, тромбированного стента.
Пункция воротной вены производилась из устья средней печеночной вены параллельно тромбированному стенту. Имплантирован стент-графт между средней печеночной веной и устьем правой бранши воротной вены длиной 80 мм с шириной просвета 10 мм частично покрытый. При прямой портографии контрастировались пищеводно-желудочные вариксы из бассейна частично реканализованной левой и преимущественно задней желудочных вен (ЗЖВ). Выполнена эмболизация этих вен двумя спиралями Gianturco. Завершающая прямая портография установила ламинарный кровоток по шунту, контрастирование стента без дефектов наполнения и отсутствие ретроградного кровотока по ЛЖВ и ЗЖВ (рис. 4).
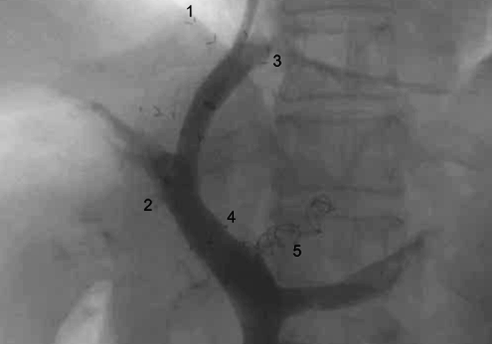
Рис.4. Прямая портография (контроль), цифрами обозначены:
1,2. Проксимальный и дистальные концы тромбированногостента (04.2016 г.);
3,4. Проксимальный и дистальные концы параллельного стента (реТИПС);
5. Спирали Gianturco в левой и правой желудочной вене
Для профилактики тромбоза шунта назначен эноксапарин 40 мг/сутки с переходом через 3 мес. на прием антикоагулянтов peros на фоне постоянного приема дезагрегантов.
В июле 2017 г. – рецидив пищеводной геморрагии, потребовавший мер медикаментозного и эндоскопического гемостаза. Выполнено дуплексное сканирование сосудов гепаторенальной зоны от 02.08.2017 г. между нижней полой веной и воротной веной в правой доле печени лоцируется два портокавальных шунта, при ЦДК кровоток не определен, стенты окклюзированы гетерогенными тромбомассами. Отмечено появление порто-кавальных и спленоренальных анастомозов, не диагностируемых раннее, что явилось спасительным для пациентки. В свою очередь анатомические пути обходного кровотока не обеспечивали достаточного снижения давления в системе ВВ, что подтверждено появлением спленомегалии (156 мм во фронтальной плоскости) с синдромом гиперспленизма (уровень тромбоцитов крови 56х109/л, эритроцитов 2,54х1012/л), и выраженными изменениями венозных структур пищеводно-желудочного перехода. ЭФГДС от 1.08.2017 г. В нижней трети пищевода визуализированы варикозно-расширенные вены до 0,8 см, полнокровные, мелкие эрозии, что соответствует ВРВП 3 ст.
30.08.17 г. поступила в хирургическое отделение РостГМУ.
Для визулизации кровотока по воротной вене произведена мезентерикопортография правым трансрадиальным доступом. В связи с отсутствием кровотока интраоперационно принято решение о выполнении шунтирующего пособия. Пункция воротной вены производилась из устья левой печеночной вены параллельно нефункционирующим шунтам. При прямой портографии контрастированы пищеводно-желудочные вариксы, заполняющиеся из бассейна коротких вен желудка и реканализованной ЗЖВ. Выполнена эмболизация этих вен спиралями Gianturco (рис.5). Затем имплантирован стент-графт между устьем левой печеночной вены и устьем левой бранши воротной вены, длиной 80 мм с шириной просвета 10 мм частично покрытый ПТФЭ. При контрольной прямой портографии кровоток ламинарный, стент контрастируется без дефектов наполнения.
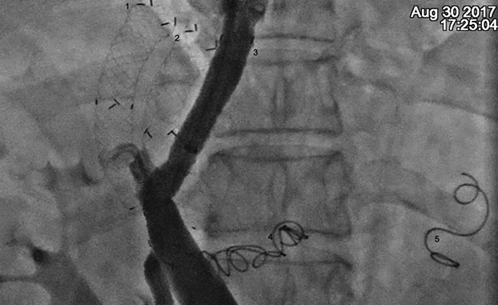
Рис.5. Прямая портография (контроль), цифрами обозначены:
1.Тромбированныйстент, установленный 04.2016 г.; 2. Тромбированный стент, установленный 12.2016 г.; 3. Стент, установленный при оперативном вмешательстве 30.08.2017 г.; 4. Спираль Gianturco, установленная в левую желудочную вену (04.2016 г.);
5. Спираль Gianturco, установленная в заднюю желудочную вену 30.08.2017 г.
С целью выявления коагулопатии, не регистрируемой рутинными методиками исследования системы гемостаза, выполнен анализ тромбодинамики. Проведенное исследование позволило установить наличие агрегационных нарушений форменных элементов крови (тромбоцитов) на фоне общей гипокоагуляции. У пациентки выявлена выраженная спонтанная агрегация тромбоцитов на основании оптической плотности суспензии тромбоцитов. Совместно со специалистами-гемостазиологами, основываясь на результатах агрегатограммы, назначена комплексная терапия антикоагулянтами и дезагрегантами, дозировка которых индивидуально оттитрована исследованием тромбодинамики. Больная осмотрена в декабре 2017 г. – шунт функционирует, что свидетельствует о важности периоперационных мероприятий и необходимости их постоянного моделирования.
Заключение
Данный клинический случай демонстрирует современные миниинвазивные хирургические возможности осуществления эффективной портальной декомпрессии у пациентов с выраженной хронической печеночной недостаточностью и возможность продления жизни пациентам, находящимся в листе ожидания трансплантации печени. Необходимым является не только проведение оперативного вмешательства, но и динамический контроль функции портосистемного шунта и системы гемостаза в послеоперационном периоде. Применением современных диагностических методик является более информативным по сравнению с рутинными.



