Несмотря на существенные успехи в исследовании стрессовых реакций организма, специфика протекания стресс-реакции, обусловленной воздействием эндогенных факторов, изучена недостаточно. Среди таких факторов важное место в клинической практике занимают состояния, сопровождающиеся гипоксией головного мозга [1; 7]. Очевидно, что индивидуальные особенности организма, такие как генотип, соматотип, тип высшей нервной деятельности и уровень стрессоустойчивости, являются факторами, которые необходимо учитывать и при развитии невропатологии и её осложнений, и при проведении лечебно-восстановительных мероприятий [6]. Система крови, являясь одной из ключевых гомеостатических систем организма, играет важную роль в формировании адекватных компенсаторно-приспособительных реакций организма при экстремальных воздействиях [11; 12]. Вместе с тем до настоящего времени остается во многом не изученным влияние энцефалопатии на формирование реакций системы крови при окислительной недостаточности разного происхождения и степени тяжести, хотя считается доказанным важное значение нарушения деятельности ЦНС в развитии постишемической патологии других органов и систем.
Цель исследования
Изучить особенности адаптационно-восстановительных реакций крови при моделировании острой тотальной гипоксии головного мозга у крыс в зависимости от уровня их стрессоустойчивости.
Материалы и методы исследования
Эксперимент проводился на 90 крысах обоего пола (47 самцов и 43 самки), массой 180-200 граммов, линии Wistar, возрастом 3-4 месяца, содержавшихся в группах по 5 особей в стандартных условиях вивария. Опыты проводили в весенние месяцы: март - апрель. Эксперимент выполнен в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986 г. и подтвержденной в Страсбурге 15.06.2006 г.), а также в соответствии с требованиями приказов № 1179 МЗ СССР от 11.10.1983 г., № 267 МЗ РФ от 19.06.2003 г.
В качестве модели острой тотальной гипоксии мозга в работе использована двухсторонняя перевязка обеих общих сонных артерий [10]. Операция проводилась под кратковременным внутрибрюшинным наркозом золетилом из расчета 20-40 мг/кг массы подопытного животного, который вводили за 40 минут до начала моделирования. Перед моделированием нарушения мозгового кровообращения оценивали ориентировочно-исследовательское поведение животных с помощью теста «открытое поле»: рассчитывали интегральный индекс активности (ИА) [5] по формуле ИА= ГА/ЛП+ЛПц, где ГА - горизонтальная активность, ЛП - латентный период первого перемещения и ЛПц - латентный период выхода в центр поля. На основе показателей поведения в «открытом поле» крысы были разделены на активных и пассивных в зависимости от индивидуальных значений ИА. Активные животные прогностически более устойчивы к действию стрессорных нагрузок, пассивные обладают низкой резистентностью функций организма к стрессорным нагрузкам. Животных выводили из эксперимента на 1, 6, 8, 14, 21, 28 и 35-е сутки после операции, 19 интактных животных составили группу контроля. Мазки крови фиксировались и окрашивались азур-2-эозином по Романовскому. В мазках крови подсчитывалось процентное содержание разных форм лейкоцитов. Для оценки реактивности организма нами рассчитывался индекс напряженности адаптации по Л.Х. Гаркави [2], индекс иммунореактивности по Д.О. Иванову [4], а также ядерный индекс сдвига. Статистическая обработка проводилась с помощью пакета программ Statistic for Windows 6.0. Для оценки достоверности различий между группами использован t-критерий Стьюдента (р<0,05).
Результаты исследования и их обсуждение
При проведении исследования клеточных показателей «белой крови» было выявлено достоверно более высокое содержание палочко- и сегментоядерных нейтрофилов в крови у контрольных крыс с низким уровнем стрессоустойчивости (НУС) по сравнению с животными, обладающими высоким уровнем стрессоустойчивости (ВУС), примерно в 1,5 раза (p<0,02) (рис. 1).
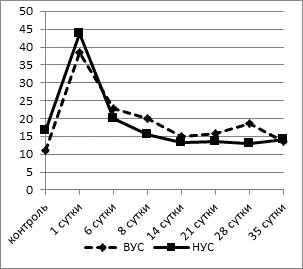
Рис. 1. Динамика процентного содержания сегментоядерных нейтрофилов в крови
у крыс с разной стрессоустойчивостью. (ВУС - высокий уровень стрессоустойчивости,
НУС - низкий уровень стрессоустойчивости)
На 1-е сутки после операции наблюдался значительный рост доли нейтрофилов в крови как у животных с ВУС - на 250% (p<0,001), так и у группы животных с НУС - на 175% (p<0,002). Нейтрофильный лейкоцитоз возникает в результате выброса неспособных к делению гранулоцитов из различных депо, главным образом из костного мозга. Эта «срочная помощь» увеличивает защитные свойства крови. К 6-му дню после операции отмечалось резкое снижение количества нейтрофилов в крови. В дальнейшем (8-21-е сутки эксперимента) содержание нейтрофилов в обеих группах продолжало снижаться, при этом у крыс с НУС процент палочко- и сегментоядерных нейтрофилов приближался к контрольным значениям, в то время как у группы животных с ВУС доля нейтрофилов оставалась достоверно выше (в 2 раза, p<0,02), чем в контрольной группе, до 28-го дня эксперимента. К окончанию наблюдения (35-е сутки после моделирования гипоксии мозга) содержание сегментоядерных нейтрофилов в исследуемых группах крыс было в пределах исходных значений, однако доля палочкоядерных нейтрофилов у животных с НУС достигала значений достоверно ниже контрольных (1,8±0,12% при 3,63±0,21% в контроле, p<0,05). Ядерный индекс сдвига (ЯИС) имел обратную тенденцию - на 1-6-е сутки эксперимента он снижался в обеих группах примерно в 1,5 раза (p<0,05). В группе животных с ВУС к 14-му дню он достигал контрольных значений и до конца срока эксперимента оставался в пределах нормы. У крыс с НУС ЯИС начиная с 6-х суток повышался, достигая максимальных значений к 21-му дню эксперимента (0,32±0,03 при 0,22±0,02 в контроле, p<0,05), а в более поздние сроки (28-35-е сутки) резко снижался и к 35-му дню был в 2 раза ниже - 0,11±0,02, чем в контроле (p<0,02).
Достоверных отличий в содержании эозинофилов у контрольных животных обнаружено не было (рис. 2а).
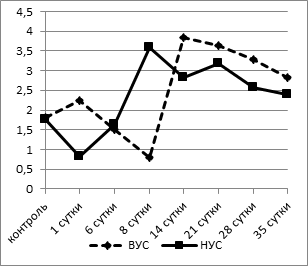 а
а
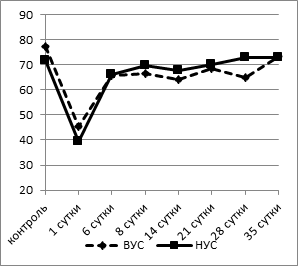 б
б
Рис. 2. Динамика процентного содержания эозинофилов (а) и лимфоцитов (б) в крови у крыс с разной стрессоустойчивостью
У крыс с НУС в 1-е сутки после операции отмечалось снижение содержания эозинофилов с 1,75±0,18% до 0,83±0,12% (p<0,005). У животных с ВУС снижение содержания эозинофилов в крови наблюдалось позже - на 8-е сутки эксперимента (0,80±0,09% при 1,82±0,11% в контроле, p<0,05). Уменьшение числа эозинофилов обусловлено тем, что они уходят из крови в соединительную ткань, где принимают активное участие в осуществлении функции макрофагов. Затем этот показатель резко повышался, достигая максимальных значений к 8-му дню наблюдения у группы НУС животных (3,60±0,16%, p<0,05), а у крыс с ВУС их концентрация к 14-му дню превышала исходные значения более чем в 2 раза - 3,83±0,15% (p<0,05). Начиная с 21-х суток в обеих группах количество эозинофилов не отличалось от контрольных значений.
Динамика содержания лимфоцитов в крови после двусторонней перевязки обеих сонных артерий была противоположна изменениям концентрации сегментоядерных нейтрофилов: контрольные значения у животных с ВУС были значительно выше (76,45±1,43%), чем у крыс с НУС (71,63±1,45%; p<0,05) (рис. 2б). Уже через сутки после операции доля лимфоцитов в крови существенно снижалась: у животных с ВУС на 41% (p<0,002), у крыс с НУС - на 45% (p<0,001). Лимфопения может быть обусловлена распадом или миграцией лимфоидных клеток. К 6-м суткам эксперимента отмечалось повышение количества лимфоцитов в крови в обеих исследуемых группах. При этом у НУС крыс процент лимфоцитов приближался к контрольным значениям, в то время как у ВУС животных доля нейтрофилов до 28-го дня после моделирования гипоксии мозга оставалась достоверно ниже (на 14%, p<0,05), чем в контрольной группе, и только к окончанию наблюдения (35-е сутки) содержание лимфоцитов возвращалось к исходным значениям.
Достоверных отличий процентного содержания моноцитов в крови у крыс с разной стрессоустойчивостью в контрольных группах обнаружено не было (7,73±0,25% - у ВУС крысы, 6,13±0,18% - у НУС, p>0,05). Существенных изменений этого показателя в первую неделю после операции не выявлено. На 14-е сутки эксперимента доля моноцитов в крови значительно повышалась: до 13,67±0,44% у ВУС животных, до 12,17±0,35% - у НУС, что значительно превышает показатели в контроле (p<0,02). В дальнейшем (21-35-е сутки) концентрация моноцитов у всех животных была в пределах нормы.
Известно, что лейкоцитарная формула является интегральным показателем баланса всех гомеостатических систем организма. Причиной лейкоцитарных перестроек часто является общая мобилизация защитных механизмов организма, поэтому она с успехом используется для оценки неспецифической реакции адаптации [9]. Адаптационный показатель мы определяли методом, разработанным Л.Х. Гаркави с соавт. (1990), путем расчета индекса напряженности адаптации (ИНА), отражающего отношение числа лимфоцитов к числу сегментоядерных нейтрофилов в лейкоцитарной формуле [2]. Для оценки изменений использовали диапазоны нормы адаптационного показателя, определенные для основных видов лабораторных животных [8]. Согласно этим исследованиям, критическое предстрессовое значение показателя адаптации (ИНА) для белых крыс равно 1,6. При анализе динамики ИНА выявлено, что исходные значения его у животных с активным типом поведения были значительно выше таковых у пассивных крыс (7,64±0,21 при 4,61±0,14, p<0,002) (рис. 3а).
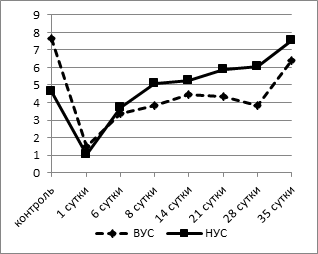 а
а
 б
б
Рис. 3. Динамика индекса напряженности адаптации (а) и индекса иммунореактивности (б) у крыс с разной стрессоустойчивостью
Через 1 сутки после операции отмечалось напряжение механизмов, формирующих адаптационный ответ. Это проявилось значительным (в среднем на 80% от контрольных значений) снижением индекса по Гаркави в обеих группах (1,48±0,28 - у животных с ВУС, 1,02±0,21 - у НУС крыс, p<0,001), что свидетельствовало о развитии стресс-реакции. Далее ИНА повышался, при этом у крыс с НУС уже к 6 суткам после операции он достигал исходных значений, а начиная с 14 суток ИНА достоверно повышался, достигая к 35 суткам 7,52±0,19, что превышает показатель контрольной группы на 65% (p<0,05). У животных с ВУС этот показатель имел сходную динамику, однако восстановление было более длительным и наступало лишь к концу наблюдения (35-е сутки). Следовательно, развитие реакций адаптации в обеих группах идет по единым принципам с наиболее выраженными изменениями в лейкоцитарной формуле в период срочной адаптации у животных с исходно низким уровнем стрессоустойчивости. При включении механизмов долгосрочной адаптации происходит «нормализация» показателей лейкоцитарной формулы у животных с ВУС, при этом животные с НУС переходят на качественно новый функциональный уровень, что отражается более высокими по сравнению с исходными значениями ИНА, начиная с 14 суток после операции. Сопоставление результатов анализа данных индекса по Л.Х. Гаркави позволяет сделать вывод: в первые несколько суток после моделирования острой тотальной гипоксии головного мозга разворачиваются основные реакции повреждения и защиты, причем наиболее нестабильное состояние приходится на первые сутки после операции. Последующие изменения лейкоцитарной формулы свидетельствуют как об уменьшении со временем степени «стрессогенного» воздействия гипоксии головного мозга, так и об адаптации организма к данному состоянию.
Кроме того, нами определялся индекс иммунореактивности (ИИР), предложенный Д.О. Ивановым с соавторами (2002) [4], который показывает отношение относительного содержания лимфоцитов и эозинофилов в крови к числу моноцитов, что отражает баланс лимфокинов и монокинов. Этот индекс может быть использован для контроля за состоянием иммунной системы в условиях острой гипоксии мозга. Мы не обнаружили достоверных различий исходных значений этого индекса в группах крыс с разной стрессоустойчивостью (рис. 3б). В раннем периоде после воздействия (1 сутки) отмечалось падение ИИР, более выраженное в группе НУС крыс (с 13,23±1,13 до 5,16±1,03 - у НУС крыс, с 12,44±1,29 до 6,58±1,23 у ВУС животных, p<0,002). Падение ИИР связанно со снижением относительного содержания лимфоцитов, которое у животных с НУС сочеталось с дефицитом эозинофилов. Это свидетельствует о недостатке блокаторов воспаления, следовательно, дезинтоксикационного компонента в спектре медиаторов, и означает неблагоприятную динамику иммунных реакций, в отличие от ВУС крыс. На 6-е сутки у животных с ВУС и на 8-е сутки у НУС крыс этот показатель приближается к контрольным значениям, однако на 14-й день эксперимента происходит вторичное падение ИИР в обеих группах. Это связано с достоверным ростом числа моноцитов в крови и позволяет предположить рост монокиновых эффектов, способствующих в том числе ангиогенезу и пролиферации фибробластов и эндотелия (HB-EGF, TGF-а и HGF) [3].
Заключение
Таким образом, в первые сутки возникает начальная фаза (мобилизации), которая характеризуется возникновением преходящего нейтрофильного лейкоцитоза, эозинопении и временной лимфопении, снижением индекса напряженности адаптации и индекса иммунореактивности. Вторая фаза (резистентности), наступающая в более поздние сроки (через 6 суток) в виде активации иммунных механизмов, является специализированной реакцией, создающей повышенную резистентность к гипоксии, и реализуется с участием гормонов. В целом нужно отметить, что у низкоустойчивых к стрессу животных иммунный ответ на гипоксию мозга был более выраженный по сравнению с животными, высокоустойчивыми к стрессу.



