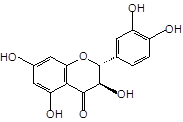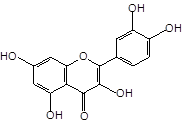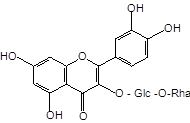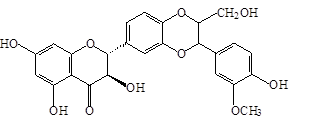В медицинской практике широко применяются лекарственные препараты на основе лекарственного растительного сырья (ЛРС), содержащего флавоноиды, которые обусловливают широкий спектр биологической активности [3]. Особый интерес представляют антиоксидантные свойства флавоноидов, среди которых дигидрокверцетин (таксифолин), являющийся компонентом древесины лиственницы сибирской (Larix sibirica L.), используется в качестве лекарственной субстанции для производства препарата «Диквертин», а также целого ряда биологически активных добавок [3].
Близкими по строению к дигидрокверцетину (1) является кверцетин (2) и его 3-О-рутинозид (рутин) (3), широко встречающиеся в лекарственных растениях. Кроме того, дигидрокверцетин (1) является фрагментом в молекуле силибина (4) и других флаволигнанов плодов расторопши пятнистой [Silybum marianum (L.) Gaertn.], служащих ценным источником гепатопротекторных лекарственных средств (силибинин, легалон, силимар, карсил и др.) [3]. Данное обстоятельство делает актуальным сравнительное изучение близких по строению флавоноидов, а также лекарственных препаратов на их основе.
Цель настоящих исследований - сравнительное исследование антиоксидантной активности некоторых флавоноидов и лекарственных препаратов на основе плодов расторопши пятнистой.
Материал и методы исследования
Исследования антиоксидантной активности флавоноидов и лекарственных препаратов на основе плодов расторопши пятнистой (силимар, карсил) проведены на модели токсического гепатита, вызванного интоксикацией четыреххлористым углеродом в ткани печени крыс [5]. При этом было применено многократное введение четыреххлористого углерода крысам в дозе 2,0 г/кг веса животного. 50%-ный масляный раствор четыреххлористого углерода вводился крысам внутримышечно ежедневно в течение шести дней.
Исследование осуществляли на белых половозрелых лабораторных крысах обоего пола массой тела 200-260 граммов. Крысы находились на обычном рационе вивария и были вовлечены в эксперимент одновременно, что исключает влияние внешних температурных, климатических и иных факторов на разницу активности ферментов у опытных и контрольных групп животных. Во время эксперимента доступ крыс к воде и корму был свободным.
Флавоноиды и фитопрепараты вводились опытным крысам внутрижелудочно через зонд ежедневно в течение 6 дней параллельно с введением четыреххлористого углерода: силимар и карсил вводились в дозе 50 мг/кг массы тела, а индивидуальные вещества – дигидрокверцетин (1), кверцетин (2), рутин (3) и силибин (4) (рис. 1) в дозе 25 мг/кг.
Контрольной группе крыс 50%-ный масляный раствор четыреххлористого углерода вводился ежедневно в течение 6 дней. Была задействована интактная группа крыс, а также группа крыс, получавшая наряду с четыреххлористым углеродом 40%-ный спирт в дозе 0,2 мл/кг, в 10 раз разбавленный водой. На седьмой день крыс забивали, у них удаляли печень. Крысы забивались в соответствии с этическими нормами под эфирным наркозом методом декапитации. Печень крыс была значительно увеличена в объеме и макроскопически изменена, ткань печени на разрезе приобретала серый оттенок. После извлечения печень промывалась физиологическим раствором и сразу замораживалась в сосуде с твердой углекислотой («сухим льдом») при температуре -70 … -80 °С. Затем из ткани печени готовился гомогенат для проведения анализа на содержание малонового диальдегида (МДА), а также определения активности супероксиддисмутазы (СОД), глутатионпероксидазы (ГП) и каталазы. Гомогенат готовился механическим измельчением ткани печени массой 1 грамм с 5 мл фосфатного буфера (рН 7,4) со скоростью 5000 об/мин в сосуде с двойными стенками, постоянно охлаждаемом проточной водой.
Все данные активности ферментов и уровня перекисного окисления липидов (ПОЛ) рассчитывались на содержание белка. Определение белка в печеночной ткани производилось микробиуретовым методом [7]. Определение конечного продукта перекисного окисления липидов осуществляли на основе принципа [6], в соответствии с которым при высокой температуре в кислой среде МДА реагирует с тиобарбитуровой кислотой, образуя окрашенный триметиновый комплекс с максимумом поглощения при длине волны 532 нм. Определение активности каталазы основано на способности перекиси водорода образовывать с солями молибдена стойкий окрашенный комплекс [2]. В гомогенате печени определяли также активность супероксиддисмутазы (СОД) - фермента, инактивирующего супероксидные радикалы и уменьшающего интенсивность перекисного окисления липидов. Супероксиддисмутаза относится к числу ферментов, входящих в состав антиоксидантной защитной системы организма. Активность СОД определяли по методу, описанному в литературе [1]. Определение активности глутатионпероксидазы осуществляли в соответствии с известной методикой [4].
Дигидрокверцетин (1), рутин (3) и силибин (4) выделены в индивидуальном виде с использованием колоночной хроматографии (силикагель L 40/100) соответственно из древесины лиственницы сибирской, травы гречихи посевной и плодов расторопши пятнистой. Кверцетин (2) получен в ходе кислотного гидролиза рутина (3) с последующей перекристаллизацией из водного спирта. Химическое строение выделенных веществ устанавливали с использованием УФ-, ЯМР-спектроскопии, а также сравнением физико-химических констант и хроматографической подвижности (ТСХ-анализ) с достоверно известными образцами веществ.
Кроме того, для доказательства химического строения флавоноидов использованы современные методы исследования: УФ-, ЯМР-спектроскопия, масс-спектрометрия.
|
|
|
|
Дигидрокверцетин (1) |
Кверцетин (2) |
|
|
|
|
Рутин (3) |
Силибин (4) |
Результаты исследования и их обсуждение
В результате исследований было установлено, что при интоксикации четыреххлористым углеродом в дозе 2,0 г/кг в печени повышается интенсивность перекисного окисления липидов, что проявляется в увеличении содержания малонового диальдегида в гомогенате (табл. 1). Из таблицы 1 видно, что при интоксикации четыреххлористым углеродом в дозе 2,0 г/кг при параллельном введении спирта в дозе 0,2 мл/кг в печени повышается интенсивность перекисного окисления липидов и снижается противоперекисная защита, понижается активность супероксиддисмутазы, каталазы и глутатионпероксидазы. Показано, что спирт не влияет в значительной мере на токсическое действие четыреххлористого углерода, так как не нормализует перекисное окисление липидов печени крыс и активность ферментов супероксиддисмутазы, каталазы и глутатионпероксидазы гепатоцитов (табл. 1-4). Поэтому применение его в качестве растворителя не изменяет картину антиоксидантного, гепатопротекторного действия фитопрепаратов.
Определено, что влияние на уровень МДА, как конечного продукта ПОЛ, среди индивидуальных веществ в наибольшей мере оказывает дигидрокверцетин (снижается на 34,5% по сравнению с контрольной группой). Далее антиоксидантная активность уменьшается в ряду: силибин, рутин, кверцетин. Исследованные фитопрепараты по способности тормозить ПОЛ уступают индивидуальным флавоноидам, причем их активность сопоставима (табл. 1).
Установлено, что активность СОД увеличивается в наибольшей степени под влиянием кверцетина (увеличение на 70,3%). Далее антиоксидантная активность уменьшается в ряду: дигидрокверцетин, силибин, рутин. Интересно отметить, что способность активности СОД, выявленная для карсила и силимара, сопоставима с таковой силибина – индивидуального флаволигнана расторопши пятнистой (табл. 2).
Изучено, что активность каталазы возрастает в наибольшей мере под влиянием кверцетина (увеличивается на 26,3%) (табл. 3). Далее активность уменьшается в ряду: силибин, рутин, дигидрокверцетин (табл. 3). Что касается препаратов (карсил и силимар), то их активность сопоставима с таковой индивидуальных веществ (табл. 3).
Определено, что активность ГП возрастает в наибольшей мере под влиянием кверцетина (возрастает на 35,3%); далее активность уменьшается в ряду: дигидрокверцетин, силибин, рутин (табл. 4). При этом важно подчеркнуть, что активность исследованных фитопрепаратов сопоставима с таковой по способности силибина – индивидуального флаволигнана расторопши пятнистой (табл. 4).
Таблица 1
Влияние фитопрепаратов на уровень малонового диальдегида
|
Фитопрепараты |
Малоновый диальдегид, нмоль/мг белка печени (опыт) |
Малоновый диальдегид, нмоль/мг белка печени (контроль) |
Степень уменьшения уровня МДА, % |
|
Интактные (в сравнении с ССl4) |
13,33 ± 3,73 р<0,01 |
26,29 ± 3,09 |
|
|
Интактные (в сравнении с ССl4+спирт) |
15,37 ± 2,85 р<0,01 |
28,06 ± 4,44 |
|
|
ССl4 + карсил |
22,25 ± 2,39 р<0,01 |
26,29 ± 3,09 |
15,7 |
|
ССl4 + силимар |
22,10 ± 3,52 р<0,05 |
26,75 ± 4,02 |
17,4 |
|
ССl4 + дигидрокверцетин |
17,21 ± 2,20 р<0,01 |
26,29 ± 3,09 |
34,5 |
|
ССl4 + кверцетин |
21,21 ± 2,12 р<0,01 |
28,02 ± 3,50 |
24,3 |
|
ССl4 + силибин |
20,93 ± 3,74 р<0,01 |
28,02 ± 3,50 |
25,5 |
|
ССl4 + рутин |
21,07 ± 1,48 р<0,01 |
28,02 ± 3,50 |
24,8 |
Таблица 2
Влияние фитопрепаратов на активность супероксиддисмутазы
|
Фитопрепараты |
Супероксиддисмутаза, АЕД/мг белка печени (опыт) |
Супероксиддисмутаза, АЕД/мг белка печени (контроль) |
Степень повышения активности фермента, % |
|
Интактные (в сравнении с ССl4) |
1,20 ± 0,45 р<0,05 |
0,72 ± 0,31 |
|
|
Интактные (в сравнении с ССl4+спирт) |
1,90 ± 0,18 р<0,05 |
1,47 ± 0,46 |
|
|
ССl4 + карсил |
1,02 ± 0,34 р<0,01 |
0,72 ± 0,31 |
41,7 |
|
ССl4 + силимар |
1,69 ± 0,29 р<0,05 |
1,24 ± 0,31 |
36,2 |
|
ССl4 + дигидрокверцетин |
1,07 ± 0,29 р>0,05 |
0,72 ± 0,31 |
48,6 |
|
ССl4 + кверцетин |
2,18 ± 0,33 р<0,01 |
1,28 ± 0,55 |
70,3 |
|
ССl4 + силибин |
1,89 ± 0,45 р<0,05 |
1,28 ± 0,55 |
47,7 |
|
ССl4 + рутин |
1,47 ± 0,11 р>0,05 |
1,28 ± 0,55 |
30,5 |
Таблица 3
Влияние фитопрепаратов на активность каталазы
|
Фитопрепараты |
Каталаза, нМоль/с Н2О2/мг белка печени (опыт) |
Каталаза, нМоль/с Н2О2/мг белка печени (контроль) |
Степень повышения активности фермента, % |
|
Интактные (в сравнении с ССl4) |
0,0737 ± 0,0101 р<0,05 |
0,0566 ± 0,0135 |
|
|
Интактные (в сравнении с ССl4+спирт) |
0,1070 ± 0,0226 р<0,05 |
0,0858± 0,0101 |
|
|
ССl4 + карсил |
0,0670 ± 0,0219 р>0,05 |
0,0566 ± 0,0135 |
18,4 |
|
ССl4 + силимар |
0,1009± 0,0269 р>0,05 |
0,0839 ± 0,0125 |
20,1 |
|
ССl4 + дигидрокверцетин |
0,0663 ± 0,0079 р>0,05 |
0,0566 ± 0,0135 |
17,7 |
|
ССl4 + кверцетин |
0,1060 ± 0,0218 р<0,05 |
0,0839 ± 0,0125 |
26,3 |
|
ССl4 + силибин |
0,1050 ± 0,0256 р>0,05 |
0,0839 ± 0,0125 |
25,1 |
|
ССl4 + рутин |
0,1045 ± 0,0198 р<0,05 |
0,0839 ± 0,0125 |
24,6 |
Таблица 4
Влияние фитопрепаратов на активность глутатионпероксидазы
|
Фитопрепараты |
Глутатионпероксидаза, мкМоль/мин/мг белка печени (опыт) |
Глутатионпероксидаза, мкМоль/мин/мг белка печени (контроль) |
Степень повышения активности фермента, % |
|
Интактные (в сравнении с ССl4) |
1,87 ± 0,66 р<0,05 |
1,12 ± 0,25 |
|
|
Интактные (в сравнении с ССl4+спирт) |
1,98 ± 0,30 р<0,05 |
1,55 ± 0,31 |
|
|
ССl4 + карсил |
1,41 ± 0,49 р>0,05 |
1,12 ± 0,25 |
25,9 |
|
ССl4 + силимар |
1,17 ± 0,33 р>0,05 |
0,96 ± 0,34 |
21,9 |
|
ССl4 + дигидрокверцетин |
1,45 ± 0,45 р>0,05 |
1,12 ± 0,25 |
29,5 |
|
ССl4 + кверцетин |
2,03 ± 0,22 р<0,01 |
1,50 ± 0,33 |
35,3 |
|
ССl4 + силибин |
1,93 ± 0,22 р<0,05 |
1,50 ± 0,33 |
28,7 |
|
ССl4 + рутин |
1,70 ± 0,27 р>0,05 |
1,50 ± 0,33 |
13,3 |
Таким образом, исследованные флавоноиды и фитопрепараты на основе флавоноидов обладают выраженным влиянием на ферментативные и неферментативные звенья антиоксидантной защиты при токсическом поражении печени и могут использоваться в патогенетической терапии патологических состояний, связанных с нарушением эндогенной антиоксидантной защиты. Примечательно, что силибин (флаволигнан плодов расторопши пятнистой) и лекарственные препараты (силимар, карсил) на основе сырья данного растения обладают сопоставимой антиоксидантной активностью на всех моделях.
Выводы
Определено, что флавоноиды (дигидрокверцетин, кверцетин, силибин, рутин) и фитопрепараты на основе флавоноидов (силимар, карсил) характеризуются комплексным действием на неферментативные и ферментативные звенья антиоксидантной защиты и могут быть рекомендованы для назначений при различных сдвигах в системе «прооксидант – антиоксидант» при поражениях печени токсической природы. Принимая во внимание то обстоятельство, что антиоксидантная активность зависит от химического строения исследованных флавоноидов, представляется актуальным создание комбинированных гепатопротекторных лекарственных средств, в которых могут реализовываться различные механизмы действия.