Узкобороздочные лиганды (УБЛ) представляют собой довольно большой класс агентов различной химической природы, для которых общим свойством является способность формировать комплексы с ДНК по малой бороздке за счет водородных связей и Ван-дер-Ваальсовых взаимодействий без образования ковалентной связи [6; 9; 10]. В результате выявления их способности флуоресцировать после образования комплекса с ДНК и РНК эти соединения получили широкое распространение в молекулярной клинической диагностике, экспериментальной онкологии, молекулярно-биологических и цитогенетических исследованиях в качестве реагента для визуализации нуклеиновых кислот [4; 12]. Ряд соединений этой группы используется в медицинской практике в качестве антипаразитарных и антисептических средств [7; 11]. Применительно к онкологической практике изучение УБЛ представляет как теоретический, так и практический интерес в связи с широким спектром их биологического действия, имеющего как про-, так и антиканцерогенную направленность [2; 8]. Эти соединения обладают широким спектром индивидуальной активности, по-разному влияя на функционирование ферментов метаболизма ДНК. Ранее нами было показано, что узкобороздочные лиганды (УБЛ) способны ингибировать активацию поли-(АФД)-рибозы полимеразы I [5]. Мы также продемонстрировали, что УБЛ специфически действуют на ДНК-зависимую активацию PARP1, разобщая связь фермента с ДНК-активатором по конкурентному механизму. Эти исследования свидетельствовали о необходимости дальнейшего исследования возможности использования УБЛ в качестве ингибиторов PARP1.
Цель исследования – проведение сравнительного анализа влияния ряда УБЛ по их способности ингибировать активацию PARP1 в модельной системе in vitro. Соответственно, конкретными задачами исследования явилась оптимизация реконструированной in vitro системы поли-(АДФ)-рибозилирования с использованием гантелеобразных дуплексов ДНК [1] различной структуры, замкнутых и имеющих одноцепочечные разрывы; выявление наиболее активных ингибиторов активации фермента PARP1 и определения для них концентрации полумаксимального ингибирования; оценка влияния введения в гантелеобразный дуплекс ДНК АТ-богатой восьмизвенной последовательности при ее различной локализации относительно одноцепочечного разрыва.
Материалы и методы. Для проведения реакции поли(АДФ)рибозилирования реакционную смесь, содержащую белок PARP1 (R&D Systems, Inc., США), PARP 1 buffer (R&D Systems, Inc., США), субстрат фермента – никотинамидадениндинуклеотид (NAD) (Sigma-Aldrich, США) и ДНК-активатор инкубировали при 37 ºС в течение 1 часа. При оптимизации реакции поли(АДФ)рибозилирования в качестве ДНК-активатора использовали 44-звенный олигонуклеотида Bb (harpin formed by 44 bases, with the break), содержащий две взаимно комплементарных области, которые способны образовывать двухцепочечную молекулу ДНК, содержащую 18 пар оснований (рис. 1).
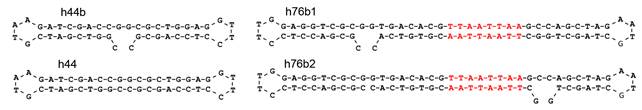
Рис. 1. Гантелеобразные дуплексы ДНК, использованные в качестве активатора PARP1
Конструкции такого дизайна уже применялись ранее при изучении особенностей связывания PARP1 c ДНК [3]. Для обеспечения максимального сходства предложенной модели с реальными интермедиатами, встречающимися при репарации повреждений ДНК, последовательность олигонуклеотида, используемого для формирования гантелеобразного дуплекса, содержала на 5'-конце фосфатную группу. Для получения замкнутого гантелеобразного дуплекса ДНК проводили лигирование концов олигонуклеотида с использованием лигазы фага T4 (Thermo Fisher Scientific, США). Эксперименты по изучению влияния присутствия в ДНК-активаторе АТ-богатого участка, который был расположен на различном расстоянии от точки разрыва в гантелеобразном дуплексе.
При изучении влияния УБЛ на активацию PARP1 в реакционную смесь добавляли соединения в концентрации от 0, 64 до 64 мкМ. Реакцию останавливали добавлением 3-кратного буфера Loading Buffer (62.5 mM Tris-HCl, pH 6,8, 2.5%-ный ДСН, 0.002%-ный бромфеноловый синий, 0.7135 M (5%) β-меркаптоэтанол, 10%-ный глицерин в конечной концентрации) и инкубацией при 90 ºС в течение 10 минут. Далее проводили гель-электрофорез продукта (реакции поли-АДФ-рибозы) по Лэммли в 10%-ном ДСН-ПААГ с 4%-ным концентрирующим слоем. Количество поли-АДФ-рибозы определяли методом вестерн-блоттинга.
Для иммуноблоттинга использовали антитела к поли-АДФ-рибозе (Anti-poly(ADP-ribose)antibody, Tulip Biolabs, США). Перенос проводили с использованием камеры Mini-Protein (Biocad) при напряжении 2 В/см в течении 3-4 часов в буфере Tris-Glycine без додецилсульфата натрия. Гибридизацию с первичными антителами осуществляли в буфере TBST (10 mM Tris-HCl, pH 7,5, 150 mM NaCl, 0,001% Tween 20) с добавлением 5-7% БСА, в соотношении 1:1000 при 4 °С в течение 2-3 часов. После инкубации мембрану промывали буфером TBST (4 раза по 10 минут). Далее проводили гибридизацию со вторичными антителами (Anti-mouse, Abcam, США) в течение 1 часа, затем промывали буфером TBST (4 раза по 10 минут). Мембрану проявляли, используя набор реактивов Amersham (GE Healthcare). Визуализацию осуществляли при помощи прибора ImageQuant LAS 4000. Статистическая значимость полученных различий была проанализирована при помощи t-критерия Стьюдента.
Результаты и их обсуждение
Оптимизацию реакции поли(АДФ)-рибозилирования проводили с использованием 44-звенного олигонуклеотида h44b (рис. 1). При определении оптимальной концентрации дуплекса h44b, необходимой для активации ферментативной функции PARP1, было установлено, что для запуска реакции необходимо не менее 0,64 нМ ДНК (рис. 1А). При концентрации активатора h44b, составляющей 11,7 нМ, прямо пропорциональное увеличение количества продукта реакции от количества добавленного в реакционную смесь PARP1 наблюдалось в диапазоне 1,2*10-4 до 0,3 е.а. фермента на пробу. При этом активность PARP1, добавленного в пробу в количестве меньшем 1,2*10?4 е.а., не выявлялась (рис. 1Б). Таким образом, в качестве оптимальных условий для проведения реакции поли(АДФ)-рибозилирования были выбраны: концентрация гантелеобразного дуплекса ДНК h44b – 11,7 нМ, а концентрация PARP1 – 0,1 ед. активности фермента на пробу.
На следующем этапе мы провели сравнительный анализ зависимости количества образующейся поли-(АДФ)-рибозы от наличия одноцепочечного разрыва в гантелеобразном дуплексе ДНК путем сравнения активирующей способности h44b и h44, в котором одноцепочечный разрыв был устранен путем лигирования концов олигонуклеотида (рис. 2В).
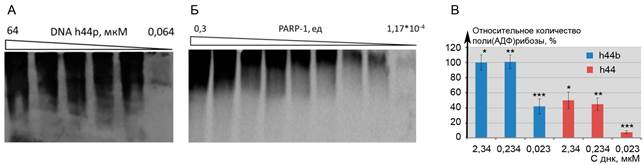
Рис. 2. Оптимизация условий проведения реакции поли (АДФ)-рибозилирования в системе in vitro
А - Влияние концентрации h44b на количество поли-АДФ-рибозы. Б - Зависимость количества поли-АДФ-рибозы от количества PARP1 (е.а.) в реакционной смеси. В - Влияние одноцепочечного разрыва на эффективность активации PARP1. Значения нормированы на количество поли-АДФ-рибозы при использовании в качестве активатора h44b в концентрации 2,34 мкМ (*, **, *** - различия статистически значимы по t-критерию Стьюдента, p < 0,05)
Было показано, что при эквимолярных концентрациях ДНК-активатора с разрывом и без него реакция поли-АДФ-рибозилирования идет значительно (более чем вдвое) активнее при наличии разрыва в гантелеобразном дуплексе (рис. 2В).
Основной задачей представленного исследования являлось проведение сравнительного анализа влияния различных узкобороздочных лигандов на активацию белка PARP1. Определение влияния УБЛ на относительное количество образованной поли-АДФ-рибозы осуществляли при использовании в качестве активатора h44b в концентрации 11,7 нМ и добавлении в реакционную смесь 0,1 е.а. PARP1. В работе были исследованы ингибирующие эффекты описанных в литературе [5] классических УБЛ: DAPI, Diminazene, Hoechst 33258, Netropsin, Pentamidine. В качестве положительного контроля эффективного ингибирования реакции поли-АДФ-рибозилирования использовался 4ANI. По нашим данным, наибольшей ингибирующей способностью обладают DAPI и Diminazene. Промежуточное влияние оказывает Hoechst 33258. Для Netropsin показана слабая ингибирующая способность в сравнении с DAPI и Diminazene (рис. 3А).
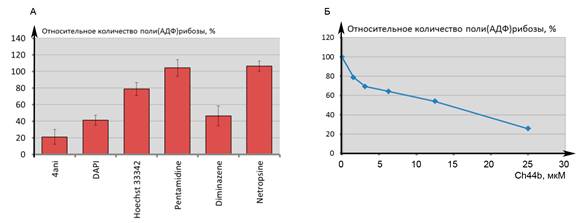
Рис. 3. Влияние УБЛ на эффективность реакции поли-АДФ-рибозилирования при активации белка PARP1 ДНК-дуплексом h44b
А - Относительное количество поли-АДФ-рибозы в присутствии различных УБЛ. Значения нормированы на количество поли-АДФ-рибозы в отсутствии УБЛ. Б - Зависимость относительного количества поли-АДФ-рибозы от концентрации Hoechst 33342
Для дальнейшего определения концентрации полумаксимального ингибирования IC50 была получена дозовая зависимость образующейся pADPr от концентрации УБЛ (рис. 3Б). Концентрация полумаксимального ингибирования ферментной реакции для DAPI составила 62,5 нМ. При данной концентрации на 1 молекулу УБЛ приходится 3,4 пары оснований, что соответствует 5,3 молекулы DAPI на молекулу h44b.
Из результатов аналогичного эксперимента с Diminazene было установлено, что IC50 для этого соединения составляет 0,132 мкМ, что соответствует 11,3 молекулы Diminazene на 1 молекулу h44b. Наконец, результаты эксперимента с Hoechst показывают, что IC50 для данного соединения составляет 13,3 мкМ, что на 2 порядка выше при сравнении с Diminazene. Из этих УБЛ, влияющих на активацию PARP1, в настоящее время в медицинской практике в качестве лекарственного антипаразитарного препарата используется Diminazene. В соответствии с возможностью его более быстрого внедрения в медицинскую практику, в дальнейших исследованиях особенностей влияния УБЛ на реакцию поли-АДФ-рибозилирования был использован именно этот лекарственный препарат.
Задачей следующего раздела работы был анализ влияния на ингибирующий эффект Diminazene последовательности нуклеотидов в гантелеобразном дуплексе ДНК, а именно присутствие АТ-богатого участка (рис. 1). Для этого эксперимента использовались: гантелеобразные структуры ДНК h44b, h76b1 и h76b2. Два последних дуплекса содержали АТ-богатые регионы, находящиеся на разном удалении от места разрыва. Сначала был проведен анализ влияния на активацию белка PARP1 локализации разрыва в гантелеообразном дуплексе относительно АТ-богатого участка. Было показано, что активация ферментативной реакции дуплексом h76b2 происходит менее интенсивно в сравнении дуплексом h76b1 (рис. 4А).
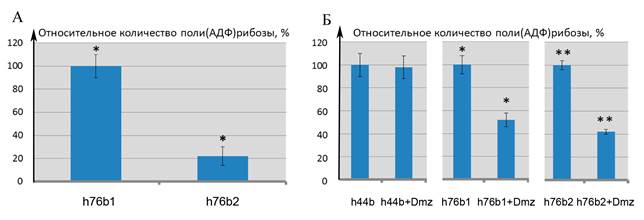
Рис. 4. Влияние АТ-богатого участка и его локализации на особенности реакции поли-АДФ-рибозилирования и ее ингибирования Diminazene
А – Относительные количества поли(АДФ)рибозы при использовании в качестве активаторов h76b1 и h76b2. Значения нормированы по h76b1. Б – Влияние диминазена на относительные количества поли(АДФ)рибозы при использовании в качестве активаторов h44b, h76b1 и h76b2 (*, ** - значения относительной интенсивности полос статистически значимо отличны от соответствующих контролей)
При фиксированной концентрации ДНК (0,1 мкМ) и отсутствии ингибитора мы получили различные количества pADPr, что указывает на различную аффинность PARP1 к данным олигонуклеотидам. В структуре обоих дуплексов h76b1 и h76b2 последовательность TCGATC находятся на различных расстояниях от разрыва цепи ДНК. Ранее было показано, что PARP1 обладает высокой аффинностью к разрыву ДНК, но также способен связываться с АТ-богатыми последовательностями. В дуплексе h60b1 последовательность AATT и разрыв цепи удалены друг от друга на расстояние более 7 оснований, необходимых для посадки PARP1, что позволяет двум молекулам PARP1 связаться с ДНК. В гантелеобразном дуплексе h76b2 наблюдается обратная ситуация – последовательность AATT и одноцепочечный разрыв расположены всего в двух парах оснований друг от друга, вследствие чего активация двух молекул PARP1 становится невозможной. Это приводит к меньшему уровню активации фермента в случае активации дуплексом h76b2 в сравнении с дуплексом h76b1.
При исследовании влияния Diminazene на активацию реакции поли(АДФ)-рибозилирования при введении АТ-богатого региона в последовательности гантелеобразного ДНК-дуплекса было показано, что при эквимолярных концентрациях ингибитора и активатора ингибирующая способность Diminazene значительно возрастает при наличии AT-богатой последовательности в ДНК-активаторе. Это согласуется с данными наших экспериментов по изучению сиквенс-специфичности УБЛ и данными литературы о том, что Diminazene связывается с АТТ-богатой последовательностью.
Заключение
Полученные результаты о влиянии одноцепочечного разрыва в дуплексе ДНК на активность фермента согласуются с данными о том, что наличие одноцепочечного разрыва сильно увеличивает аффинность фермента к биополимеру. Среди изученных УБЛ высокой эффективностью ингибирования активации PARP1 обладают DAPI, Diminazene и Hoechst. Наибольший интерес среди этих соединений представляет Diminazene, который уже используется в медицине в качестве антипаразитарного препарата. Его ингибирующий эффект на активацию PARP1 повышается при наличии в последовательности ДНК-активатора АТ-богатых областей.
Таким образом, результаты экспериментов подтвердили влияние положения AT-богатого региона относительно одноцепочечного разрыва на ингибирование активности PARP1 Diminazene. Полученные данные свидетельствуют о целесообразности проведения доклинических испытаний по использованию Diminazene в комбинированной химиотерапии опухолей.
Работа выполнена при частичной поддержке гранта РФФИ №15-04-09216А.



