Изучение процесса клеточного и гуморального иммунитета позволило выявить и охарактеризовать значительное количество цитокинов, которые оказались неотъемлемыми модуляторами иммунного ответа [1]. Эндогенные цитокины, представляя собой пептидные или гликопептидные молекулы с различной структурой и функцией, в большинстве своем продуцируются клетками иммунной системы для осуществления бесконтактной координации межклеточных взаимодействий. Они осуществляют взаимосвязь между специфическим иммунитетом и неспецифическими защитными реакциями организма, а также координируют работу иммунной, нервной, эндокринной, кроветворной и других систем.
Интерлейкин-1β (IL-1β), являющийся провоспалительным цитокином, способен стимулировать функции не только многих типов лейкоцитов, но и оказывать влияние на разнообразные клетки другого происхождения [1]. Об этом свидетельствуют результаты исследований, в которых отмечено гипотензивное действие IL-1β и его модулирующий эффект на дыхательную систему [8]. Помимо указанного, IL-1β вызывает подъем температуры тела и воздействует на функции фибробластов и эндотелиальных клеток [1]. Кроме этого, он ускоряет рост кровеносных сосудов в случае их повреждения.
Интерлейкин-2 (IL-2) является плейотропным цитокином, относящимся к группе цитокинов-гемопоэтинов, имеет основное значение как ростовой фактор, оказывает влияние на механизмы врождённого иммунитета и на адаптивный антиген-зависимый иммунный ответ, реализующийся через Т- и В-лимфоциты [3]. В то же время IL-2 усиливает проницаемость гематоэнцефалического барьера и влияет на структурную целостность эндотелия мозговых сосудов, участвует в процессах ангиогенеза, а также активирует парасимпатический отдел вегетативной нервной системы [4,6]. Он также способен изменять продукцию фосфоинозитола и активировать MAP-киназу.
Цитокиновые препараты находят все более широкое применение в современной врачебной практике. Беталейкин, созданный на основе рекомбинантного IL-1β человека методами генной инженерии, представляет собой аналог человеческого белка IL-1β. Терапевтические применения IL-1 следующие: его часто используют как адъювант при вакцинации, в качестве ранозаживляющего вещества, стимулятора гемопоэза и продукции антител. Ронколейкин является полным структурным и функциональным аналогом эндогенного IL-2 человека. Для применения в клинике его выделяют из клеток рекомбинантного штамма дрожжей Saccharomyces cerevisiae. Применяется в медицинской практике как компонент противоопухолевой терапии.
Основными источниками IL-1β в организме являются макрофаги, моноциты и эндотелиоциты, а также и Т- и В-лимфоциты, а IL-2 секретируется в основном T(CD4+)-хелперами, т.е. оба цитокина образуются клетками, представленными в значительном количестве в лимфатических сосудах и узлах. Данных о влиянии интерлейкинов на транспортную функцию лимфатических сосудов и узлов мало [5], а они необходимы, поскольку оба препарата являются фармакопейными, входят в группу «Иммуномодуляторы» и достаточно широко применяются в медицинской практике. В связи с этим целью нашей работы было изучение эффектов IL-1β и IL-2 на сократительную деятельность гладких мышц капсулы брыжеечных лимфатических узлов и раскрытие механизмов их действия на гладкомышечные клетки.
Материалы и методы исследования
Брыжеечные лимфатические узлы забирали через 15 минут после забоя здоровых бычков черно-пестрой породы в возрасте 18–20 месяцев и в охлажденном до +4 оС физиологическом солевом растворе доставляли в лабораторию. Из лимфатических узлов вырезали полоски капсулы (32 полоски из 17 узлов от 10 животных) размером 15х2х0,2 мм в направлении от ворот узла к приносящим лимфатическим сосудам. Эксперименты проводили при непрерывном протоке в рабочей камере физиологического солевого раствора следующего состава (в мМ): NaCl – 120,4; KCl – 5,9; CaCl2 – 2,5; MgCl2 – 1,2; NaH2PO4 – 1,2; NaHCO3 – 15,5; глюкоза – 11,5. Раствор с целью оксигенации и поддержания стабильного рН (7,35–7,40) сатурировали газовой смесью, состоящей из 95 % О2 и 5 % СО2. Температуру раствора поддерживали на уровне +37±0,2оС с помощью термостата ВТ-5-1 (Termex). Исходное натяжение полосок капсулы лимфатических узлов соответствовало трансмуральному давлению 5 см водн. ст. Регистрацию сокращений препаратов осуществляли с помощью тензодатчика FORT-10 (WPI), работающего в изометрическом режиме. Тестовые вещества применяли через 30–40 минут после размещения препарата в камере с физиологическим раствором и задания исходного натяжения. Запись данных, поступающих на компьютер через аналого-цифровой преобразователь (MD-155, Pavlov Institute of Physiology RAS), проводили непрерывно на протяжении всего эксперимента.
Растворы, содержащие IL-1β (беталейкин, НИИОЧБП, Санкт-Петербург, РФ) и IL-2 (ронколейкин, ООО «НПК «БИОТЕХ» Санкт-Петербург, РФ) в концентрации – от 2пг/мл до 200 пг/мл готовили непосредственно перед экспериментами путем растворения необходимого количества указанных веществ в физиологическом растворе. Анакинра (Kineret) производства Swedish Orphan Biovitrum применяли в концентрации 1 мг/мл в качестве антагониста рецепторов интерлейкина-1β. L-NAME (Nω-nitro-L-arginine methyl ester, 1,0×10-4 М/л) применяли в качестве ингибитора эндотелиальной синтазы NO. LY-294002, 1×10-5 М/л, применяли в качестве ингибитора фосфатидилинозитол-3-киназы, индометацин (ингибитор циклоксигеназы) растворяли в ДМСО (диметилсульфоксид) в концентрации 10-2 М/л и перед воздействием разбавляли физиологическим раствором до концентрации 1,0×10-5 М/л. Последние три вещества были произведены Sigma Aldrich.
Статистическую обработку полученных результатов проводили с помощью программы StatSoft STATISTICA 6.1.478. Полученные данные соответствовали условиям нормального распределения и представлены в виде средних значений с их стандартным отклонением (M±SE). Для установления достоверности различий использовали критерий t-Стьюдента. Различия считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
Спонтанная фазная сократительная активность регистрировалась в 28 полосках капсулы лимфатических узлов. После установления стабильных параметров (тонус, амплитуда и частота фазных сокращений) в камеру вводили физиологический раствор с IL-1β или IL-2 и на протяжении 30 минут регистрировали сократительную деятельность препаратов. Интерлейкины в концентрациях ниже 2 пг/мл не оказывали статистически значимых эффектов, а в концентрациях выше 200 пг/мл приводили к подавлению фазной сократительной активности полосок. Как правило, эффект IL-1β и IL-2 начинал проявляться на 4–5 минутах действия. Полностью действие интерлейкинов проявлялось к 10–12 минутам, поэтому в дальнейшем для анализа использовали параметры сокращений, зарегистрированные до воздействия и в интервале 15–20 минуты действия интерлейкинов. Достаточно быстрое проявление эффекта интерлейкинов на узлы позволяет сделать заключение о том, что их действие реализуется через рецепторы на мембране гладкомышечных и эндотелиальных клеток лимфатических узлов.
На рис. 1 представлены усредненные данные, полученные при исследовании эффектов интерлейкинов на полоски капсулы лимфатических узлов. IL-1β приводил к снижению всех показателей сократительной деятельности полосок капсулы лимфатических узлов. При увеличении концентрации IL-1β ингибиторный эффект на гладкомышечные клетки возрастал. IL-2 также оказывал тормозное влияние на миоциты капсулы лимфатических узлов, однако его ингибиторный эффект был менее выраженным. Наименьшее влияние IL-2 оказывал на уровень тонического напряжения ГМК.
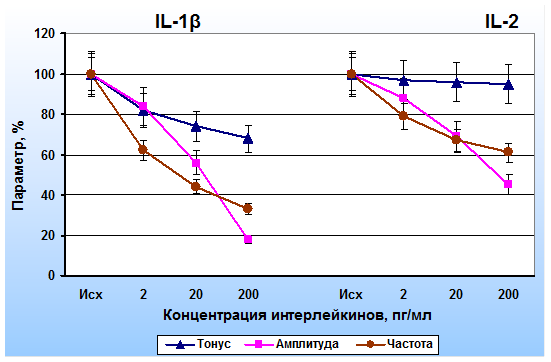
Рис. 1. Эффекты иетерлейкина-1β (IL-1β) и интерлейкина-2 (IL-2) на параметры сократительной активности капсулы лимфатических узлов. По оси абсцисс – концентрации IL-1β и IL-2, по оси ординат – тонус, амплитуда и частота фазных сокращений (в % от исходных)
Реакции деэндотелизированных полосок капсулы лимфатических узлов на интерлейкины сильно отличались от таковых по сравнению с интактными. IL-1β в концентрации 200 пг/мл незначительно снижал тонус ГМК, а также частоту и амплитуду фазных сокращений (на 9,2±1,64 %, 7,4±1,58 %, 11,5±2,47 % соответственно). Применение IL-1β в низких концентрациях сопровождалось статистически недостоверными изменениями параметров сократительной активности ГМК. Действие IL-2 на деэндотелизированные полоски капсулы лимфатических узлов сопровождалось выраженным повышением тонуса ГМК (рис. 3).
Ранее нами было показано, что реакции лимфатических узлов и сосудов на различные эндогенные вещества и фармакологические препараты в существенной степени модулируются эндотелиальными клетками посредством активации продукции ими NO или простациклина [5,2]. Поскольку реакции деэндотелизированных полосок капсулы лимфатических узлов на интерлейкины значительно отличались от реакций препаратов с интактным слоем эндотелиоцитов, представляло определенный интерес исследовать механизмы действия интерлейкинов на лимфатические узлы.
Деэндотелизированные капсулы лимфатических узлов практически не реагировали на введение в раствор IL-1β. Лишь максимальные концентрации IL-1β приводили к незначительному снижению тонуса гладкомышечных клеток. Эти данные позволили нам предположить, что ингибиторный эффект IL-1β в лимфатических узлах реализуется посредством активации продукции эндотелиоцитами вазодилататоров. Тормозный эффект IL-1β на интактные препараты предотвращался при предварительном добавлении в физиологический раствор антагониста рецепторов интерлейкина-1β – анакинры. Предварительная блокада эндотелиальной синтазы NO L-NAME приводила к существенному снижению тормозного эффекта IL-1β. Ингибирование синтеза простациклина индометацином сопровождалась незначительными изменениями реакций ГМК капсулы лимфатических узлов на IL-1β. с Результаты этой серии экспериментов представлены на рис. 2.
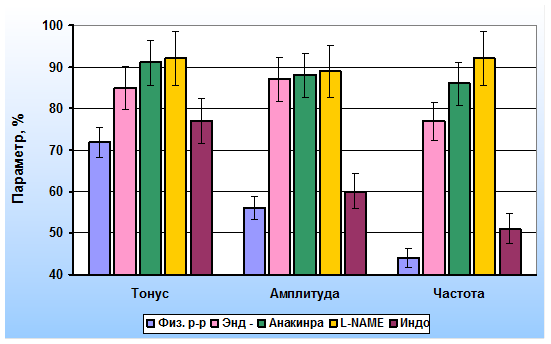
Рис. 2. Эффекты иетерлейкина-1β (20 пг/мл) на параметры сократительной активности капсулы лимфатических узлов: Физ. р-р – в физиологическом растворе, Энд (-) – деэндотелизированные полоски, Анакинра – на фоне действия антагониста рецепторов IL-1β, L-NAME – на фоне действия ингибитора синтазы NO, Индо – на фоне действия индометацина (в % от исходных)
Полученные данные дали нам основание сделать заключение о механизме ингибиторного эффекта IL-1β на сократительную активность ГМК лимфатических узлов. IL-1β связывается преимущественно с рецепторами на мембране эндотелиальных клеток синусов лимфатических узлов. Комплекс IL-1β-рецептор стимулирует в эндотелиоцитах конститутивную синтазу NO. Увеличение продукции NO сопровождается снижением всех параметров сократительной активности ГМК капсулы лимфатических сосудов. Роль простаноидов в развитии ингибиторного эффекта IL-1β значительно меньше. На мембране гладкомышечных клеток капсулы лимфатических узлов мало рецепторов к IL-1β, и они не играют значимой роли в реакции лимфатических узлов на IL-1β.
IL-2 при действии на деэндотелизированные капсулы лимфатических узлов приводил к выраженному повышению тонуса препаратов, амплитуда фазных сокращений при этом практически не изменялись, а частота – несколько возрастала. Известно, что IL-2 активирует в клетках, как минимум, три внутриклеточные сигнальных пути, в т.ч. стимулирует фосфоинозитидный механизм [7]. С целью оценки возможной роли этого сигнального пути в повышении тонуса гладкомышечных клеток мы провели опыты с его блокированием LY-294002. На фоне блокады фосфоинозитид-3-киназы IL-2 приводил к достоверному снижению тонуса, а также амплитуды и частоты фазных сокращений ГМК интактных капсул лимфатических узлов и практически не оказывал влияния на амплитуду и частоту фазных сокращений ГМК деэндотелизированных капсул. На фоне блокады эндотелиальной синтазы NO L-NAME IL-2 вызывал меньшее повышение тонического напряжения интактных препаратов по сравнению с деэндотелизированными, в то же время изменения амплитуды и частоты фазных сокращений практически не отличались от соответствующих изменений в деэндотелизированных препаратах. Применение ингибитора циклоксигеназы – индометацина не приводило к достоверным изменениям параметров сократительной активности ГМК интактных капсул лимфатических узлов. Результаты исследования механизма действия IL-2 на капсулу лимфатических узлов представлены на рис. 3.
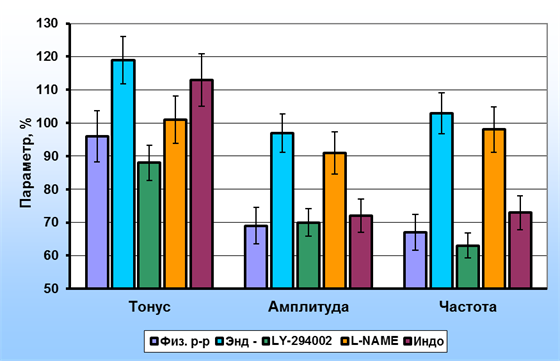
Рис. 3. Эффекты иетерлейкина-2 (20 пг/мл) на параметры сократительной активности капсулы лимфатических узлов: Физ. р-р – в физиологическом растворе, Энд (-) – деэндотелизированные полоски, LY-294002 – на фоне действия ингибитора фосфатидилинозитол-3-киназы, L-NAME – на фоне действия ингибитора синтазы NO,
Индо – на фоне действия индометацина (в % от исходных)
Таким образом, мы приходим к заключению, что механизмы, посредством которых IL-1β м IL-2 оказывают влияние на транспортную функцию лимфатических узлов, существенно отличаются. Полученные данные позволяют сделать заключение о том, что эффекты обоих интерлейкинов запускаются через мембранные рецепторы. Эффект IL-1β является эндотелий-зависимым. После связывания IL-1β с рецептором в эндотелиальных клетках увеличивается продукция NO. Действие NO на ГМК лимфатических узлов приводит к снижению амплитуды и частоты фазных сокращений на фоне выраженного снижения тонуса. Механизмы действия IL-2 на лимфатические узлы являются более сложными. Экспериментальные данные позволяют сделать вывод о том, что рецепторы к IL-2 имеются как на эндотелиоцитах, так и на ГМК. Комплекс IL-2-рецептор на ГМК запускает в них фосфоинозитидный механизм, что приводит к повышению тонуса миоцитов. В то же время комплекс IL-2-рецептор на эндотелиоцитах стимулирует продукцию NO, который способствует снижению тонуса и уменьшению амплитуды и частоты спонтанных фазных сокращений. В итоге при действии IL-2 амплитуда и частота фазных сокращений лимфатических узлов снижаются при практически неизменном уровне тонуса.



