Проблема лечения больных острым холецистопанкреатитом до сих пор остается одной из нерешенных в абдоминальной хирургии, что объясняется сохраняющейся высокой летальностью, особенно при сочетанном тяжелом панкреонекрозе [2, 9, 10]. Основной причиной летальности является прогрессирование эндогенной интоксикации и развитие в дальнейшем полиорганной недостаточности [4, 5, 8].
В последние годы многочисленными исследованиями показана роль процессов перекисного окисления липидов, как одного из основных звеньев патогенеза большинства воспалительных заболеваний, в том числе и хирургической патологии [3, 6]. Интенсификация процессов липопереокисления сопровождается мембранодеструктивными явлениями и при прогрессировании воспаления в брюшной полости приводит к прогрессированию эндогенной интоксикации [3, 7].
Следовательно, одно из основных мест в лечении острого холецистопанкреатита должны занимать способы коррекции свободно-радикальных процессов, а ведущим механизмом защиты должна быть стабилизация клеточных мембран. Поэтому для управления патобиохимическими процессами оправданы попытки применения эфферентных методов гемокоррекции, в частности ультрафиолетовое облучение аутокрови [1].
Цель работы. Выявить характер некоторых метаболических реакций организма в раннем послеоперационном периоде у больных острым холецистопанкреатитом под влиянием фотомодифицированной крови.
Материалы и методы исследования
Работа основывается на материалах клинико-лабораторных исследований больных острым холецистопанкреатитом. Первую группу (n=22) составили пациенты возрастом от 36 до 73 лет (55,1±6,6), из них мужчин было 5 (22,7 %), женщин – 17 (77,3 %). Вторая группа (n=20) включала пациентов возрастом от 31 до 75 лет (56,9±7,1), из них мужчин было 4 (20,0 %), женщин – 16 (80,0 %). Третью группу (n=20) составили пациенты возрастом от 32 до 77 лет (50,3±5,3), из них мужчин было 4 (20,0 %), женщин – 16 (80,0 %). Четвертая группа (n=18) включала пациентов возрастом от 29 до 78 лет (52,2±6,3), из них мужчин было 3 (16,7 %), женщин – 15 (83,3 %).
Рандомизированный подбор больных в группы осуществлялся по возрасту, полу, характеру повреждений, общепринятым лабораторным показателям.
В первых двух группах хирургическое вмешательство по поводу деструктивного холецистита выполнялось традиционным лапаротомным оперативным доступом, в двух последних – эндовидеоскопически.
Обследование больных всех групп проводилось при поступлении и в динамике послеоперационного периода (1, 2, 4, 6-е сутки после операции). Научные разработки проводились при информированном согласии больного в соответствии с международными нравственными требованиями ВОЗ (правила GCP – Good Clinical Practice) предъявляемыми к медицинским исследованиям с участием человека (Женева, 1993). Для получения данных, которые приняты за физиологическую норму, произведены соответствующие исследования у 12 здоровых добровольцев обоего пола.
Во второй и четвертой группах больным наряду с традиционной терапией проводили сеансы ультрафиолетового облучения аутокрови (АУФОК-терапии). С этой целью использован аппарат МД-73М "Изольда". Эксфузию крови осуществляли из подкожных вен в объеме 2 мл/кг. Кровь стабилизировали раствором глюгицира в соотношении 1:4. Облучение производили ртутно-кварцевой лампой ДРБ-8 с преимущественно коротковолновым (254 нм) ультрафиолетовым излучением. Мощность излучения 38-40 Вт/м2. Объем капиллярной кюветы равнялся 2,7 мл, скорость экстракорпорального движения крови была 18 – 22 мл/мин. Экспозиционная доза составляла 600-700 Дж/м2, которая в настоящее время считается наиболее оптимальной [1]. Сеансы АУФОК-терапии проводили через день.
Периоперационную терапию, как и рекомендуют большинство специалистов, начинали сразу же при поступлении пациента в стационар и установлении предварительного диагноза.
Больным выполняли общеклинические, биохимические исследования (общий анализ крови и мочи, содержание билирубина, общего белка, сахара, мочевины, креатинина, активность трансаминаз в крови др.) и специальные исследования: определяли уровень молекулярных продуктов перекисного окисления липидов (диеновые, триеновые конъюгаты, малоновый диальдегид), антиоксидантный ферментный потенциал, состав липидов плазмы крови и эритроцитов, уровень токсических продуктов.
Липиды из плазмы крови экстрагировали хлороформметаноловой смесью (Хиггинс Дж. А., 1990). Липиды фракционировали методом тонкослойной хроматографии (Хиггинс Дж. А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware).
Показатели интенсивности перекисного окисления липидов: диеновые и триеновые конъюгаты определяли спектрофотометрическим методом при длине волны 232–233 нм (Ганстон Ф.Д., 1986); уровень малонового диальдегида – спектрофотометрическим методом в реакции с тиобарбитуровой кислотой (Sigma). Активность фосфолипазы А2 (ФЛ А2) исследовали в среде, содержащей 10 ммоль трис-HCL-буфер (рH 8,0), 150 ммоль тритон Х-100, 10 ммоль CaCl2 и 1,2 ммоль субстрата, в качестве которого использовали фосфатидилхолины яичного желтка (Трофимов В.А., 1999).
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием критерия t Стьюдента и χ2, корреляционная зависимость – с помощью критерия r.
Результаты исследования и их обсуждение
Применение АУФОК-терапии, вне зависимости от группы больных острым холецистопанкреатитом, приводило к уменьшению воспалительного процесса в брюшной полости. Об этом, в частности, свидетельствовало уменьшение продукции экссудата, выделяемого из брюшной полости, которое по сравнению с группой больных, получающих в послеоперационном периоде традиционную терапию, было меньше на всех этапах наблюдения. Отметим и сравнительно меньшую и непродолжительную температурную реакцию при применении сеансов фотомодифицированной терапии.
Пребывание больных основной группы в стационаре составило 14,3±0,7 койко-дня, что по сравнению с данными больных группы сравнения было меньше на 11,3 % (p<0,05).
Безусловно, одним из важнейших положительных эффектов квантовой терапии явилось существенное уменьшение выраженности эндогенной интоксикации у больных острым холецистопанкреатитом. Следует отметить, что указанное положительное действие определялось вне зависимости от объема операций. Выявлено и то, что заметное уменьшение синдрома эндогенной интоксикации на фоне АУФОК-терапии регистрировалась через 2 суток после операции.
Уменьшение воспалительных явлений в брюшной полости и снижение эндотоксикоза сопровождалось восстановлением липидного метаболизма в плазме крови и эритроцитах.
Подробно представим изменения липидного обмена у больных острым холецистопанкреатитом первых двух групп.
Сравнивая обе клинические группы, нами было обнаружено, что на всех этапах послеоперационного наблюдения в основной (второй) группе содержание диеновых коньюгатов было ниже, чем в группе сравнения (первой). Так, после первого сеанса АУФОК-терапии концентрация диеновых коньюгатов была ниже данных группы сравнения на 9,7 % (p<0,05), через 2 суток – на 15,3 % (p<0,05), через 4 суток – на 21,2 % (p<0,05), через 6 суток – на 23,3 % (p<0,05) (рис. 1).
Содержание триеновых коньюгатов в крови больных, получающих сеансы АУФОК-терапии, было достоверно ниже данных группы сравнения на всех этапах наблюдения. При этом разрыв между сравниваемыми показателями постепенно увеличивался. Через сутки после начала комплексного лечения концентрация триеновых коньюгатов была ниже данных первой группы на 11,3 % (p<0,05), через 2 суток – ниже на 13,8 % (p<0,05), через 4 суток – на 21,4 % (p<0,05), через 6 суток – на 24,2 % (p<0,05).
Сравнение полученных значений уровня малонового диальдегида показало, что в группе больных, комплексная терапия которых включала сеансы АУФОК-терапии, данный показатель был достоверно ниже результатов группы сравнения. Так, на первые сутки после начала комплексного лечения концентрация малонового диальдегида была ниже значений группы сравнения на 7,8 %, на 2 сутки – ниже на 14,7 % (p<0,05), на 4 сутки – на 18,8 % (p<0,05), на 6 сутки – ниже на 21,2 % (p<0,05).
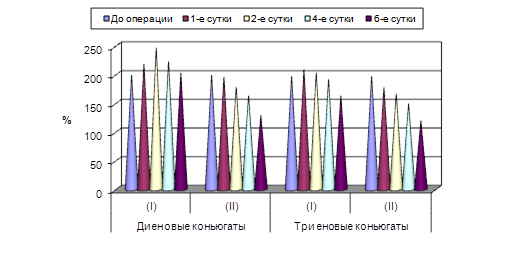
Рис. 1. Содержание диеновых и триеновых коньюгатов в плазме крови больных острым холецистопанкреатитом на фоне применения сеансов АУФОК-терапии (норма принята за 100 %)
На фоне применения сеансов АУФОК-терапии в плазме крови значительно снижалась фосфолипазная активность. Через сутки после операции в группе сравнения активность фосфолипазы А2 была ниже, чем в первой группе на 12,9 % (p<0,05), через 2 суток – на 16,3 % (p<0,05), через 4 суток – на 23,2 % (p<0,05), через 6 суток – на 33,8 % (p<0,05).
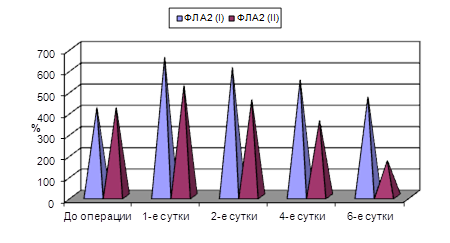
Рис. 2. Активность фосфолипазы А2 в плазме крови больных холецистопанкреатитом на фоне применения сеансов АУФОК-терапии (норма принята за 100 %)
Уменьшение интенсивности перекисного окисления липидов и фосфолипазной активности в плазме крови приводило к существенной модификации липидного обмена. Сравнивая обе клинические группы, нами было обнаружено, что на всех этапах послеоперационного наблюдения в основной группе содержание суммарных фосфолипидов было выше, чем в группе сравнения. Так, через 2 суток после операции удельный вес суммарных фосфолипидов был выше данных группы сравнения на 8,0 % (p<0,05), через 4 суток – на 13,1 % (p<0,05), через 6 суток – на 12,4 % (p<0,05).
Отметим, что содержание холестерола и его эфиров, а также глицеролов в плазме крови больных, получающих сеансы АУФОК-терапии, было сопоставимо с данными группы сравнения на всех этапах наблюдения.
Сравнивая результаты обеих клинических групп, нами было обнаружено, что на всех этапах послеоперационного наблюдения в основной группе содержание свободных жирных кислот было ниже, чем в группе сравнения. Так, через 2 суток удельный вес свободных жирных кислот был ниже данных группы сравнения на 13,1 % (p<0,05), через 4 суток – на 17,7 % (p<0,05), через 6 суток – на 15,3 % (p<0,05).
Во многом аналогичная динамика отмечена и по отношению лизоформ фосфолипидов. Так, через 2 сутки после АУФОК-терапии удельный вес лизофосфолипидов был ниже данных группы сравнения на 7,4 %, через 4 суток – на 14,8 % (p<0,05), через 6 суток – на 25,5 % (p<0,05).
Удельный вес фосфатидилхолина через 2 суток после операции на фоне фотомодифицированной терапии был выше данных группы сравнения на 8,2 % (p<0,05), через 4 суток – на 10,3 % (p<0,05), через 6 суток – на 12,2 % (p<0,05).
Содержание фосфатидилсерина, сфингомиелина, фосфатидилинозита и фосфатидилэтаноламина в плазме крови больных, получающих сеансы АУФОК-терапии, во многом было сопоставимо данным группы сравнения на всех этапах наблюдения.
Таким образом, применение АУФОК-терапии в раннем послеоперационном периоде у больных острым холецистопанкреатитом позволило уменьшить выраженность изменений в спектральном составе липидов за счет уменьшения интенсивности свободно-радикальных процессов переокисления и активности фосфолипазы А2 в плазме крови. Использование фотомодифицированной аутокрови позволило нормализовать возникающие при остром воспалении патологические сдвиги в обмене липидов в более ранние сроки, чем в группе сравнения и тем самым способствовать быстрейшему восстановлению гомеостаза, в частности уменьшению явлений эндогенной интоксикации. Подчеркнем, что детоксикационный эффект аутофотогемокоррекции коррелировал с ее способностью корригировать липидный метаболизм в крови (r=0,73–0,92).
Отметим, что при использовании ультрафиолетового облучения аутокрови в группах больных острым холецистопанкреатитом, которым применено лапароскопическое удаление желчного пузыря, также отмечены положительные клинико-лабораторные эффекты терапии.
Выводы
1. Включение АУФОК-терапии в комплексное лечение больных острым холецистопанкреатитом приводит к положительной клинико-лабораторной динамике: отмечается заметное уменьшение температурной реакции, осложнений со стороны послеоперационной раны, сокращение пребывания больных в стационаре.
2. На фоне использования гемофототерапии уменьшается выраженность синдрома эндогенной интоксикации, происходит восстановление липидного метаболизма плазмы крови и эритроцитов, что сопровождается снижением интенсивности процессов перекисного окисления липидов плазмы крови и эритроцитов и активности фосфолипазы А2.
3. Эффективность терапии фотомодифицированной аутокровью больных острым холецистопанкреатитом отмечается вне зависимости от оперативного доступа при холецистэктомии.
Рецензенты:
Смолькина А.В., д.м.н., профессор кафедры госпитальной хирургии медицинского факультета им. Т.З. Биктимирова ФГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск;
Рубцов О.Ю., д.м.н., профессор кафедры факультетской хирургии ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», г. Саранск.



