Сосудистые поражения мозга в экономически развитых странах в последние десятилетия выдвинулись в число ведущих причин смертности населения, составляя в её структуре около 14%. Мозговой инсульт определяет более 30% всех случаев смерти от сердечно-сосудистых заболеваний.
Факторами, способствующими развитию сосудистых заболеваний сердца и мозга, являются условия современной жизни, прежде всего экологическое неблагополучие, урбанизация и автоматизация, нервное перенапряжение в трудовых процессах, недостаточная двигательная активность, особенности современного питания, повышение потребления алкоголя [1].
Для лечения заболеваний, связанных с нарушением мозгового кровообращения, широко применяются ноотропные лекарственные средства.
Ноотропы - это вещества, оказывающие специфическое влияние на высшие интегративные функции мозга, улучшающие память, облегчающие процесс обучения, стимулирующие интеллектуальную деятельность, повышающие устойчивость мозга к повреждающим факторам, улучшающие кортикально-субкортикальные связи. Ноотропные препараты способны улучшать когнитивные (познавательные) функции как у здоровых людей, так и, в особенности, нарушенные при различных заболеваниях [1,2].
С целью расширения ассортимента ноотропных лекарственных средств была разработана оптимальная технология суппозиториев на гидрофильной основе, содержащих два ноотропных препарата - циннаризин и фенотропил. Циннаризин (транс-1-циннамил-4-дифенилметилпиперазин) избирательно влияет на мозговое, периферическое и коронарное кровообращение [2]. Фенотропил (N-карбамоил-метил-4-фенил-2-пирролидон) – ноотропный препарат нового поколения, отличающийся широким спектром действия и высокой активностью. Известно, что фенотропил может усиливать действие препаратов, стимулирующих ЦНС, антидепрессантов и ноотропных препаратов [3, 4].
Целью данного исследования явилась разработка методик анализа суппозиториев, содержащих циннаризин и фенотропил.
Материалы и методы
Материалом для исследования служили субстанции, соответствующие требованиям НД: фенотропил (ФСП 42-0348-4414-03) и циннаризин (НД 42-11672-06).
Для разработки методикb анализа и ее валидационной оценки были изготовлены суппозитории с циннаризином и фенотропилом состава:
Циннаризина 0,05
Фенотропила 0,05
Основы (ПЭО) необходимое количество для получения суппозиториев массой 2,0 г.
Полученные суппозитории имели торпедообразную форму белого цвета со слегка кремоватым оттенком. Масса одного суппозитория находилась в пределах 2,0±0,01 г.
Для качественного и количественного анализа циннаризина и фенотропила в суппозиториях использовали метод ВЭЖХ.
Исследование проводили с использованием жидкостного хроматографа «Стайер» фирмы Аквилон (Россия – США - Чехия), снабженного колонкой Luna С-18 4,6×150 мм (Phenomenex, США), с содержанием углерода 16%.
В результате предварительных исследований было установлено, что оптимальным является градиентный режим элюирования. В качестве подвижной фазы использовали ацетонитрил и раствор муравьиной кислоты 2%. Содержание ацетонитрила первые три минуты составляло 30%, а с третьей до пятнадцатой минуты его концентрация возрастала до 100%, при расходе подвижной фазы 1 мл/мин. Объём пробы - 20 мкл. Детектирование проводили при длине волны 254 нм.
Для приготовления испытуемого раствора один суппозиторий помещали в термостойкую колбу с обратным холодильником, добавляли 100 мл спирта этилового 96% и нагревали на кипящей водяной бане до его полного растворения. Полученное извлечение охлаждали, фильтровали, переносили в мерную колбу вместимостью 200 мл, доводили спиртом этиловым 96% до метки и перемешивали. Полученный раствор перед вводом в хроматограф центрифугировали при 7000 мин-1 в течение 5 мин.
Раствор СО готовили по методике: около 0,05 г (точные навески) фенотропила и циннаризина помещали в мерную колбу вместимостью 200 мл, растворяли в 100 мл спирта этилового 96% и доводили до метки тем же растворителем.
Результаты и их обсуждение
Полученные хроматограммы раствора сравнения и испытуемого раствора представлены на рисунках 1 и 2.
Идентификацию проводили, сравнивая времена удерживания пиков на хроматограммах испытуемого раствора и раствора сравнения. Исходя из предложенных хроматограмм, следует, что время удерживания циннаризина и фенотропила в исследуемом растворе совпадает со временем удерживания этих веществ при анализе раствора стандартных образцов. Кроме того, методом добавок было установлено, что площади пиков увеличиваются пропорционально количеству добавленных стандартов, а асимметричность и эффективность остается на прежнем уровне, что свидетельствует о способности методики специфично определить циннаризин и фенотропил в суппозиториях.
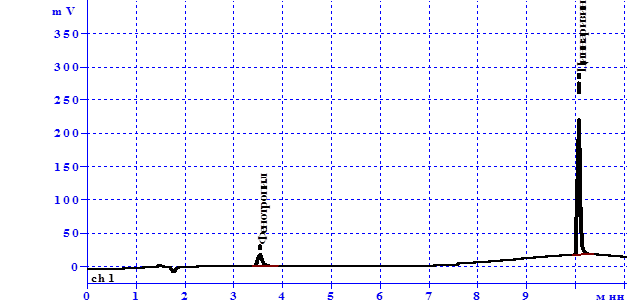
Рис. 1. Хроматограмма раствора СО, содержащего циннаризин и фенотропил
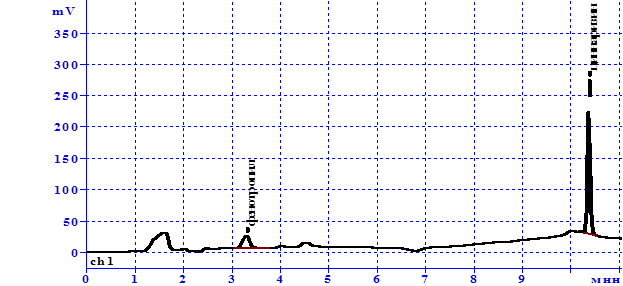
Рис.2. Хроматограмма испытуемого раствора из суппозиториев
с циннаризином и фенотропилом
Предложенная методика количественного определения циннаризина и фенотропила в суппозиториях была подвергнута валидационной оценке по критериям прецизионность (воспроизводимость), линейность и правильность [5].
Изучение зависимости между площадями пиков анализируемого раствора и содержанием в нем фенотропила и циннаризина показало, что она имела линейный характер при содержании фенотропила в интервале от 0,1 до 0,5 мг/мл, а циннаризина – от 0,05 до 0,4мг/мл. Линейная зависимость выражается уравнениями: y=870,8x–8,3 (для фенотропила) и y=10854,7x–201,3 (для циннаризина), коэффициенты корреляции при этом составляли 0,999 и 0,998 соответственно.
Для установления прецизионности методики проводили 6 параллельных определений циннаризина и фенотропила. Определялась величина стандартного отклонения (SD) и относительного стандартного отклонения (RSD). Полученные результаты представлены в таблице 1.
Таблица 1
Результаты испытания прецизионности методики определения фенотропила и циннаризина в суппозиториях
|
Найдено фенотропила, г/суппозиторий |
Метрологические характеристики
|
Найдено циннаризина, г/суппозиторий |
Метрологические характеристики
|
|
0,0500 |
SD = 0,000286 RSD = 0,57% |
0,0489 |
SD = 0,000490 RSD = 0,99% |
|
0,0498 |
0,0498 |
||
|
0,0496 |
0,0500 |
||
|
0,0501 |
0,0492 |
||
|
0,0499 |
0,0495 |
||
|
0,0494 |
0,0488 |
Для обоих веществ значение RSD составляет менее 1%, что свидетельствует о низком значении случайной погрешности.
Правильность разработанной методики определяли на модельной смеси циннаризина и фенотропила. Содержание активных веществ определяли предложенным методом ВЭЖХ. С этой целью был построен трехуровневый эксперимент по 3 опыта на каждом уровне. Для оценки полученных результатов наиболее простым и наглядным критерием служит открываемость (R). Полученные данные представлены в таблицах 2 и 3.
Таблица 2
Результаты установления правильности методики количественного определения фенотропила
|
Уровень |
Взято |
Найдено фенотропила, г |
R, % |
|
|
Навеска суппозитория, г |
Расчетное содержание фенотропила, г |
|||
|
1 |
1,53 |
0,0383 |
0,0378 |
98,69 |
|
1 |
1,56 |
0,0390 |
0,0391 |
100,26 |
|
1 |
1,51 |
0,0378 |
0,0380 |
100,53 |
|
2 |
2,03 |
0,0508 |
0,0507 |
99,80 |
|
2 |
2,02 |
0,0505 |
0,0509 |
100,79 |
|
2 |
2,05 |
0,0513 |
0,0511 |
99,61 |
|
3 |
2,58 |
0,.645 |
0,0651 |
100,93 |
|
3 |
2,52 |
0,0630 |
0,0633 |
100,48 |
|
3 |
2,55 |
0,0638 |
0,0633 |
99,22 |
|
|
|
|
|
|
Таблица 3
Результаты установления правильности методики количественного определения циннаризина
|
Уровень |
Взято |
Найдено циннаризина, г |
R, % |
|
|
Навеска суппозитория, г |
Расчетное содержание циннаризина, г |
|||
|
1 |
1,53 |
0,0383 |
0,0382 |
99,74 |
|
1 |
1,56 |
0,0390 |
0,0391 |
100,26 |
|
1 |
1,51 |
0,0378 |
0,0377 |
99,74 |
|
2 |
2,03 |
0,0508 |
0,0506 |
99,61 |
|
2 |
2,02 |
0,0505 |
0,0506 |
100,20 |
|
2 |
2,05 |
0,0513 |
0,0514 |
100,19 |
|
3 |
2,58 |
0,.645 |
0,.647 |
100,31 |
|
3 |
2,52 |
0,0630 |
0,0635 |
100,79 |
|
3 |
2,55 |
0,0638 |
0,0635 |
99,53 |
|
|
|
|
|
|
Согласно данным таблиц 3 и 4 величина средней открываемости (![]() ) для обоих веществ находится в пределах 99–101%, что свидетельствует об отсутствии влияния систематической погрешности на результаты эксперимента.
) для обоих веществ находится в пределах 99–101%, что свидетельствует об отсутствии влияния систематической погрешности на результаты эксперимента.
Выводы:
1. Разработана методика ВЭЖХ определения фенотропила и циннаризина в суппозиториях.
2. Проведена валидационная оценка предложенной методики по критериям: линейность, правильность, прецизионность.
3. Результаты валидационной оценки методики количественного определения циннаризина и фенотропила в суппозиториях показали, что этот метод позволяет достоверно определять данные вещества при их совместном присутствии.
Резензенты:
Компанцев Д.В., д.фарм.н., профессор кафедры технологии лекарств Пятигорского медико-фармацевтического института, филиала ГБОУ ВПО ВолгГМУ, г.Пятигорск;
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии Пятигорского медико-фармацевтического института, филиала ГБОУ ВПО ВолгГМУ, г. Пятигорск.



