Алициклические амины широко используются в синтезе разнообразных функционализированных производных фосфорорганических, аминоциклокарбоновой кислот [3–8]. Производные циклогексиламина представляют интерес как перспективные нейротропные соединения [4], противовоспалительные средства [5].
Ранее в работе [7] сообщалось о синтезе фосфорсодержащих производных (I) в условиях реакции Тодда – Атертона. Интерес к 1-этинил-1-аминоциклогексану (I) обусловлен, прежде всего, наличием в его молекуле нескольких реакционных центров (аминогруппы, кратная связь) и уникальными синтетическими возможностями синтеза новых соединений с широким спектром биологической активности.
Цель исследования. Целью настоящей работы является разработка высокоэффективного метода синтеза потенциально биологически активных функционально-замещенных ацетилен-, азот- и фосфорсодержащих аминов алициклического ряда. Постановка данного исследования была продиктована возросшим интересом к методам синтеза ацетиленовых аминов с непредельными связями, с карбонильным фрагментом, что значительно расширяет исследовательские работы по получению их модифицированных производных, обладающих биологической активностью [1, 2, 9].
Материалы и методы исследования.
Для получения N-замещенных производных 1-этинил-1-амино-циклогексана (I) использована реакция алкилирования его α-бромацетофеноном (II) и бромистым пропаргилом (III), взятых в стехиометрическом соотношении 1:1:
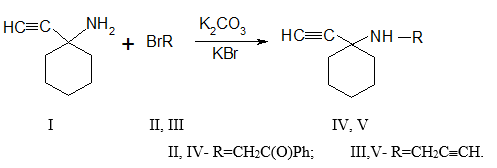
N-Алкилирование (I) проходит в среде ацетона при комнатной температуре в присутствии прокаленного K2CO3, в качестве акцептора HBr, оброзующегося в ходе реакции. Для завершения реакции смесь нагревали при температуре 45–50°С в течение 4 ч. при энергичном перемешивании. Ход реакции контролировали с помощью тонкослойной хроматографии на оксиде алюминия II степени активности (элюент- бензол:ацетон - 10:1). Выход (IV, V) составил 84,0 %. Строение и состав (II) исследовали методами элементного анализа, ИК, ЯМР1Н- спектроскопии.
Cоединения (IV, V) представляют собой белые кристаллические вещества, имеющие четкую температуру плавления, хорошо растворяющиеся в различных органических растворителях.
В ИК спектре (IV) идентифицируются полосы поглощения валентных колебаний –С≡С– (2110 см-1), ≡СН- (3244 см-1), NH- (3310 см-1) связей. Также отчетливо проявляются валентные колебания ароматического кольца (С=С) в области 1595, 1581 см-1. Введение фенацильного фрагмента подтверждается в ИК спектре наличием валентных колебаний C=O (1690 см-1) группы, а в спектре ПМР (IV) идентифицируются протоны фенацильного заместителя. Метиленовым протонам фенацильного фрагмента соответствует синглет в области 5,3 м.д. Ароматические протоны заместителя отмечены в интервале 7,05–7,5 м.д. Протоны циклогексанового кольца наблюдаются в области 1,4–1,9 м.д. Сигнал при 2,8–3,0 м.д. отнесен к вторичной аминогруппе (NH), ацетиленовый протон прописывается в области 2, 25 м.д. (1Н,с.).
В спектре ИК 1-этинил-1-аминопропинилциклогексана (V) весьма отчетливо проявляются полосы поглощения этинильной и пропинильной связи, которые наблюдаются в области 2008 и 2117 см-1. Следует отметить также, что для соединения (V) также наблюдаются полосы поглощения концевых ацетиленовых водородов этинильной группы при 3234 см-1 и пропинильной группы в области 3279 см-1. Полоса поглощения при 3442 см-1 соответствует валентным колебаниям N-H связи.
Синтез монопропаргилзамещенного ацетиленового амина (V) подтвержден данными спектра ПМР, в котором в области 8,02 м.д. идентифицируется протон вторичной аминогруппы (NН, 1Н, с.). Концевые ацетиленовые протоны пропаргильного фрагмента (НС≡С-СН2) и этинильной группы (НС≡С-) проявляются в области 1,72–1,9 м.д. в виде сложного мультиплета. Метиленовые протоны пропаргильного фрагмента (≡С-СН2) наблюдаются при 3,89 м.д. (2Н, м.). В спектре отмечены протоны циклогексанового кольца в области 1,39-1,77 м.д.
1-Этинил-1-аминофенацилциклогексан (IV) является удобным объектом для изучения нуклеофильного присоединения диалкилфосфитов (VI, VII) к карбонильной группе. Показана возможность синтеза на основе 1-этинил-1-аминофенацилциклогексана гидроксифосфонатов (VIII, IX).
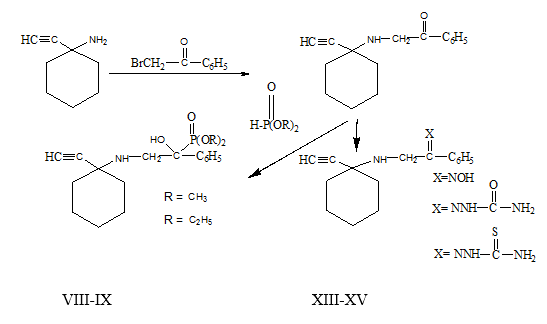
Отмечено, что амин (IV) легко вступает в реакцию фосфонилирования диалкилфосфитами (VI, VII) в диоксане в присутствии алкоголятов натрия. a-Оксифосфонаты циклогексанового ряда (VIII, IX) получены с 78-83 %-ным выходом и охарактеризованы на основе данных элементного анализа и ИК, ЯМР1Н и 31Р спектров.
В ИК спектрах соединений (VIII, IX) присутствуют следующие характеристические полосы поглощения (ν, см-1): 1210, 1225 (P=O); 1060, 1040 см- (Р-О-С); 2113±2 (СºС); 3247-3240 (ºСН); 3440 и 3420 (ОН). Введение в фенацильный фрагмент фосфорильной группы подтверждается отсутствием в области 1690 см-1 полосе поглощения, соответствующие C=O группе.
ЯМР1Н спектры (VIII, IX) подтверждает синтез α-оксифосфонатов и данные ИК спектров. Протон гидроксила проявляется в области 3.88-4.03 м.д., (ОН, с). Протоны метоксигруппы у атома фосфора (VIII) проявляются в виде синглета при 3,98 м.д. (ОМе). У этоксильной группы (IX) протоны проявляются в виде квартета при 4,18 м.д. (СН2) и 1,20 м.д. (Ме,т). В интервале 5,36-5,59 м.д. отмечен мультиплетный сигнал протонов ароматического ядра (С6Н5).
N-нуклеофилы, содержащие в качестве реакционного центра атом азота, такие как гидроксиламин и производные гидразина, являются типичными реагентами на карбонильную группу и их часто используют для идентификации альдегидов и кетонов. Азотсодержащие производные карбонильных соединений представляют самостоятельный практический интерес в качестве биологически активных веществ [5,6,8].
Исследованы реакции взаимодействия (IV) с гидроксиламином (X), семикарбазидом (XI), тиосемикарбазидом (XII), которые подтвердили большую реакционную способность карбонильной группы фенацильного заместителя. Состав и строение оксима (XIII), семикарбазида (XIV) и тиосемикарбазида (XV) подтверждено данными элементного анализа и ИК спектрами. В ИК спектре соединений (XIII-XV) присутствуют следующие характеристические полосы поглощения (ν, см-1): 2223,2112 (С≡С), 3236, 3249 (≡СН), 3273, 3310 (NН). Валентные колебания гидроксильной группы оксима (XVII) прописываются в области 3400 см-1. Группировке (-NH-C=S) тиосемикарбазона (XIV) соответствует полоса поглощения при 1447 см-1, а валентные колебания -C=S-группы идентифицируются в области 1161 см-1. Карбонильной группе семикарбазона (XV) соответствует полоса в области 1676 см-1 (NH-C=O).
Реакционоспособность амина (V), имеющий вторичную аминогруппу, подтверждена синтезом его N-ацилированных (XVI-XVIII) и N-фосфорилированных (XX-XXII) производных.
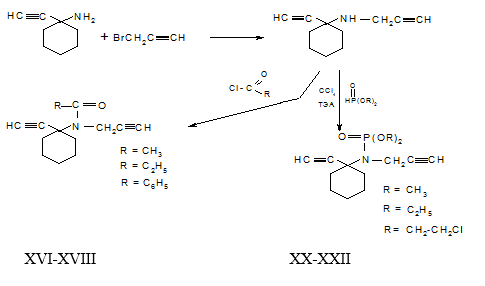
N-ацилирование (V) проводили в избытке смеси соответствующих хлорангидридов и ангидридов карбоновых кислот в присутствии ацетата натрия и при нагревании реакционной смеси в течение 5-6 ч. В результате с выходами 63,6-73,1 % были выделены и охарактеризованы продукты реакции (XVI-XVIII).
В спектрах ацилированных производных (XVI-XVIII) полосы валентных колебаний карбонильной группы сложноэфирного фрагмента наблюдается в области 1662-1786 см-1.
Успех N-фосфорилирования малоосновных аминов находится в прямой зависимости от основности использованного третичного амина. Чем более основен амин, тем больше скорость реакции. При фосфорилировании труднодоступных или слабоосновных аминов для связывания хлористого водорода вместо второго моля амина применяют более активные третичные амины. Реакцию фосфорилирования в условиях реакции Тодда - Аттертона (V) проводили в избытке ССl4 при эквимолярном соотношении реагентов, в качестве акцептора НСl использовали триэтиламин. Во всех случаях взаимодействие протекает гладко при комнатной температуре. В результате были выделены и охарактеризованы соответствующие N-диалкоксифосфорилпроизводные (XX-XXII). Состав и строение соединений (XX-XXII) подтверждены данными элементного анализа и спектрами ИК.
В спектрах (XX-XXII) отсутствует полоса поглощения вторичной аминогруппы (N-H) в интервале 3442 см-1, что свидетельствует о положительном ходе реакции алкилирования монопропаргилпроизводного (V). Полосы валентных колебаний (≡СН) идентифицируются в области 3295-3217 см-1 и при 2107 - 2298 см-1 имеется малоинтенсивная полоса (-С≡С-)-связи, проявляются также валентные колебания в области 1212, 1209, 1196 см-1 характерные для Р=О группы, в интервале 1035-1053 см-1 наблюдаются интенсивные дублетные полосы поглощения сложноэфирного фрагмента (-Р-О-С).
Результаты исследования и их обсуждение
ИК-спектры записаны на спектрометре «IR Prestige-21» фирмы Shimadzu (Япония) в таблетках KBr. Спектры ЯМР 1Н и 13С сняты на спектрометре MSL-400 «Bruker», корпорации «Thermo Electron Corporation» (США) c рабочей частотой 400 МГц для протонов и 100 МГц для 13С, при комнатной температуре, внутренний стандарт ТМС, ЯМР31Р -85 % Н3РО4. Температура плавления определена на приборе «Boetius». Контроль за ходом реакции осуществляли методом ТСХ на пластинках c окисью алюминия в различных системах растворителей, проявитель - йод.
Температуры плавления и кипения везде приводятся относительно атмосферного давления г. Алматы (685-690 мм рт. ст.).
N-1-[Этинилциклогекс-1-ил-)фенациламин (IV). К смеси 5,0 г 1-этинил-1-аминоциклогексан (I) и 5,5 г прокаленного поташа в четырехгорловом реакторе, снабженного термометром, мешалкой при комнатной температуре медленно прикапывали 7,4 г бромфенацила (II), растворенного в 25 мл ацетона. После окончания добавления бромфенацила, реакционную смесь перемешивали при температуре 56-60○C в течение 5 ч. Выпавший осадок отделили, фильтрат упарили и фракционировали под вакуумом. Остаток перекристаллизовали из гексана. Выход продукта (IV) 84 % (5,23г), т. плав. 78 ºC (Не), Rf 0,73.
Найдено, %: С 79,4; Н 7,9; N 5,7. C16H19NO. Вычислено, %: С 79.6; Н 7,9; N 5,8.
N-1-[Этинилциклогекс-1-ил-)проп-1'ил-амин (V). К смеси 5,0 г 1-этинил-1-аминоциклогексан (I) и 5,5 г прокаленного поташа в четырехгорловом реакторе, снабженного термометром, мешалкой при комнатной температуре медленно прикапывали 8,0 г бромистого пропаргила (III). После окончания добавления бромистого пропаргила, реакционную смесь перемешивали при температуре 56-60○C в течение 5 ч. Выпавший осадок отделили, фильтрат упарили и фракционировали под вакуумом. Остаток перекристаллизовали из гексана. Выход продукта (V) 84 % (4.41 г), т. плав. 96ºC (Не). Найдено, %: С 81,90; Н 9,32; N 8,60. C11H15N. Вычислено, %: С 81,94; Н 9,38; N 8,69.
N-[(2'-О,О-диметокси)фенэтиламинофосфон-2'-ол]-1-этинилциклогекс-1-ил (VIII). В четырехгорлую колбу, снабженную мешалкой, обратным холодильником, капельной воронкой добавили 1,0 г 1-этинил-1-аминофенацилциклогексан (V) в диоксане, 0,57 г диметилфосфита (VI) растворенного в 10 мл диоксане и 0,17 г метилата натрий и реакционную смесь перемешивали 4 часов при температуре 50-60ºC. Осадок отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана и выделили целевой продукт (VIII) с выходом 78% (0,6 г), т. плав. 136 ºC, Rf 0.67. Найдено, %: С 61,45; Н 7,4; N 3,9; Р 8,7. C18H26NO4P. Вычислено, %: С 61,5; Н 7,4; N 3,9; Р 8,7. Спектр ЯМР 31Р, δр,м.д.: 25,1.
N-[2'-(О,О-диэтокси) фенэтиламино фосфон- 2'-ол]- 1-этинилциклогекс-1-ил (IX). Получен аналогично (VIII), фосфорилирующий реагент-диэтилфосфит (IX). Выход 83 %, т. плав. 130 ºC, Rf 0,69. Найдено, %: С 61,45; Н 7,4; N 3,9; Р 8,7. C20H30NO4P. Вычислено, %: С 61,5; Н 7,4; N 3,9; Р 8,7. Спектр ЯМР 31Р, δр, м.д.: 26,9.
Оксим 1-этинил-1-аминофенацилциклогексана (XIII). К раствору 0,5 г cоединения (IV) в диоксане добавляли 0,15 г гидроксиламина солянокислого (Х) и 0,17 г ацетата натрия и реакционную смесь перемешивали 4 часов при температуре 50-60 ºC. Осадок отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана и выделили (XIII) с выходом 71 % (0,36 г), т. плав. 118 ºC (Не), Rf0,87. Найдено. %: С 74,6; Н 7,8; N 10,9. C16H20N2O. Вычислено, %: С 74,9; Н 7,82; N 10,89.
Семикарбазон 1-этинил-N[2'-фенэтиламино]циклогексана (XIV). К раствору 0,5г 1-этинил-1-аминофенацилциклогексан (IV) в диоксане добавляли 0,23г семикарбазида (XI) и 0,17 г ацетата натрия и реакционную смесь перемешивали 4 часа при температуре 50-60ºC. Осадок отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана и выделили (XIV) с выходом 63,5 % (0,39г), т. плав. 123ºC, Rf 0,65. Найдено, %: С 68,2; Н 7,4; N 18,7. С17H22N4O. Вычислено, %: С 68,4; Н 7,3; N 18,7.
Тиосемикарбазон 1-этинил-N-[2'-фенэтиламино]циклогексана (XV). К раствору 0,5 г 1-этинил-1-аминофенацилциклогексан (IV) в диоксане добавляли 0,23 г тиосемикарбазид и 0,17 г ацетата натрия и реакционную смесь перемешивали 4 часов при температуре 50-60 ºC. Осадок отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана и выделили целевой продукт (XV) с выходом 60,2% (0,39г), т. плав. 127 ºC, Rf 0,80. Найдено, %: С 65,1; Н 7,0; N 17,7; S 10,2. C17H22N4S. Вычислено, %: С 64,9; Н 7,0; N 17,8; S 10,1. Спектр ЯМР 31Р, δр, м.д.: 26,9.
Общая методика синтеза N-ацилированных производных (XVI-XVIII). К раствору 0,25 г 1-этинил-1-аминоэтоксопропинилциклогексан (V) в 15 мл бензола и 0,3 молях соответствующего ангидрида. Смесь нагревали при температуре 50-60°С в течение 4 ч. Ход реакции контролировали методом ТСХ на окиси алюминия в системе различных растворителей. Реакционную смесь обработали 10 % К2СО3 раствором, органический слой отделяли, промывали водой до нейтральной реакции и сушили над СаСl2. Затем СаСl2 отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана.
1-Этинил-1-аминометоксипропинилциклогексан (ХVI). Выход 70,9 %, т.плав 135 ºC, Rf 0,7. Найдено, %: С 76,81; Н 8,43; N 6,89. C13H17NO. Вычислено, %: С 76,78; Н 8,39; N 6,85.
1-Этинил-1-аминоэтоксопропинилциклогексан (ХVII). Аналогично получен. Выход 63,6%, т. плав. 140-143ºC, Rf 0,67. Найдено, %: С 76,31; Н 8,77; N 6,40. C14H19NO. Вычислено, % : С 76,38; Н 8,81; N 6,45.
1-Этинил-1-аминобензоксопропинилциклогексан (ХVIII). К смеси 0,25 г 1-этинил-1-аминопропинилциклогексан (V) в 15 мл бензола добавлили 0,18 мл хлористого бензоила и 0,13 мл ТЭА Смесь кипятили при 50-60ºC в течении 2 ч. Осадок гидрохлорида ТЭА отфильтровали, фильрат отогнали, остаток перекристаллизовали их гексана. Выход (ХХI) 73,1%, т.плав.110-112 ºC, Rf 0,69. Найдено, %: С 81,47; Н 7,22; N 5,28. C18H19NO. Вычислено, %: С 81,4; Н 7,1; N 5,24.
1-Этинил-1-аминоалкоксифосфорилпропинилциклогексанов(ХХ-ХXII). К раствору 0,25 г 1-этинил-1-аминоэтоксопропинилциклогексан (V) в 5 мл тетрахлорметана и 10 мл диоксана прикапывали 0,14 мл соответствующего фосфита (VI, VII‚ XXII) и 0,15 мл ТЭА. Смесь нагревали при температуре 50-60°С в течение 4 ч. Ход реакции контролировали методом ТСХ на окиси алюминия в системе различных растворителей. Осадок отфильтровали, растворитель отогнали. Остаток перекристаллизовали из гексана.
О,О-диметокси[N-(проп-1'-ил-) 1-Этинил циклогекс-1-ил]-амидофосфонат (ХХ). Выход 60,9%, т.плав.147 ºC, Rf 0,72. Найдено, %: С 57,96; Н 7,49; N 5,20; Р 11,5. C12H20NO3P. Вычислено, %: С 57,98; Н 7,45; N 5,17, Р11,4. Спектр ЯМР 31Р, δр, м.д.: 6,4.
О,О-диэтокси[1-Этинил-N(пропиниламидо)циклогексил]фосфонат (ХХI). Выход 54,9%, маслообразное соединение, Rf 0,7. Найдено, %: С 60,2,96; Н 8,11; N 4,69, Р10,40. C15H24NO3P. Вычислено, %: С 57,98; Н 7,45; N 4,71, Р10,42. Спектр ЯМР 31Р, δр, м.д.: 6,5.
О,О-ди-(β-хлорэтокси)[1-Этинил-N(пропиниламидо)циклогексил]фосфонат (ХХII). Выход 64,0%, маслообразное соединение, Rf 0,5. Найдено, %: С 49,15; Н 6,02; N 3,82, Р8,46. C15H22NO3PСI2. Вычислено, %: С 49,19; Н 6,06; N 3,79, Р 8,42. Спектр ЯМР 31Р, δр, м.д.: 6,9.
Выводы. Таким образом, проведенные химические трансформации молекулы (I) подтвердили большую реакционную способность ацетиленового амина при алкилировании бромистым фенацилом и бромистым пропаргилом.
Обобщая экспериментальные данные по химическим модификациям на основе 1-этинил-1-аминоциклогексана, можно предполагать, что новые функционализированные азот- и фосфорсодержащие производные ацетиленового амина представляют большой практический интерес в качестве биологически активных соединений, часть из которых проходит биологические испытания.
Рецензенты:
Бутин Б.М., д.х.н., профессор, советник ректора Республиканского государственного предприятия на праве хозяйственного ведения «Казахский государственный женский педагогический университет» Министерства образования и науки Республики Казахстан, г. Алматы;
Менлигазиев Е.Ж., д.х.н., профессор кафедры химии Республиканского государственного предприятия на праве хозяйственного ведения «Казахский государственный женский педагогический университет» Министерства образования и науки Республики Казахстан, г. Алматы.



