В настоящее время в России, как и во всем мире, провозглашена стратегическая линия на создание наноиндустрии, т.е. промышленного использования нанотехнологий. Для осуществления этой цели необходимы как наличие специалистов по наноматериалам и нанотехнологиям, так и сами наноматериалы и нанотехнологии отечественной разработки. Если углеродные нанотрубки, фуллерены, некоторые виды нанопорошков уже находятся на стадии коммерческих продуктов, то получение неорганических нанотрубок с заданными параметрами является актуальной задачей.
Цель проведенной работы – изучение процесса синтеза нанотрубок диоксида титана из кристаллического нанопорошка анатаза и исследование полученных структур.
Материалы и методы исследования
К основным методам синтеза неорганических нанотрубок относятся химический и темплатный методы. В работах, посвященных такой разновидности химического метода как гидротермальный метод [3, 6], показано, что гидротермальная обработка нанокристаллического TiO2, предварительно синтезированного из аморфного геля TiO2⋅nH2O, в концентрированном растворе NaOH приводит к образованию нанотрубок на основе TiO2. Синтез осуществляется при длительном контакте в тефлоновых реакторах при температурах 110–150 °С. Считается, что столь жесткие условия необходимы для интенсификации процесса растворения порошка диоксида титана в концентрированном растворе щелочи.
В настоящей работе интерес представляли скорее промежуточные стадии процесса. Нанопорошок диоксида титана для синтеза нанотрубок получали из водно-этанольного раствора хлорида титана (III) обратным осаждением аммиаком. Для поддержания постоянного значения рН использовали аммиачно-ацетатный буферный раствор. Осаждение проводили медленным добавлением водно-этанольного раствора хлорида титана (III) к рассчитанному количеству аммиачно-ацетатного буферного раствора [1]. Прокаливали полученный аморфный осадок при 500 оС. По данным спектроскопии комбинационного рассеяния света (КР-спектроскопии) порошок представлял собой хорошо окристаллизованный анатаз.
Для получения нанотрубок порошок диоксида титана обрабатывали 8 М раствором NaOH в течение двух недель при температуре 40 оС. После фильтрации осадок делили на две части: одну часть промывали дистиллированной водой до pH=8, а другую – 0,1 М раствором соляной кислоты до pH = 3, а потом дистиллированной водой до pH = 5 [6].
Изучение спектров комбинационного рассеяния света (КР-спектров) полученных осадков проводили на многофункциональном спектрометре комбинационного рассеяния света «SENTERRA» (Bruker) при длине волны излучающего лазера 532 нм. СЭМ-изображение осадков получали на сканирующем электронном микроскопе ULTRA 55 (Carl Zeiss, Германия). Исследование элементного состава поверхности также проводили на ULTRA 55 (Carl Zeiss, Германия) с применением энергодисперсионного анализа.
Результаты исследования и их обсуждение
На рис. 1 представлены фрагменты КР-спектров полученных осадков. Оба спектра не отличаются от КР-спектра исходного порошка, представляющего собой хорошо окристаллизованный анатаз [1]. В результате обработки спектров выделены слабые по сравнению с пиками анатаза пики при 799, 907 и 1710 см-1 (рис. 2). Они присутствуют на обоих спектрах.
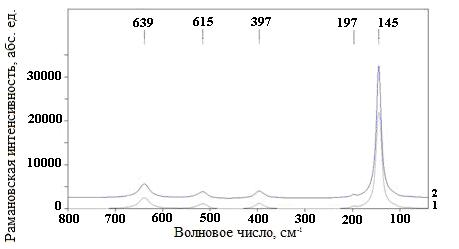
Рис.1. КР-спектры осадков после промывки: 1 - образец, промытый соляной кислотой
и дистиллированной водой, 2 – образец, промытый только дистиллированной водой.
В литературе не найдены данные по пикам, соответствующим нанотрубкам оксида титана. Хорошо известны только спектры углеродных нанотрубок (УНТ) [8]. Поскольку углерод и титан имеют различные атомные массы, то и пики, характерные для колебаний C-C и Ti-Ti должны быть расположены в разных местах спектра. Проведенные расчеты показали, что полученные пики (рис.2) могут быть отнесены к пикам нанотрубок диоксида титана.
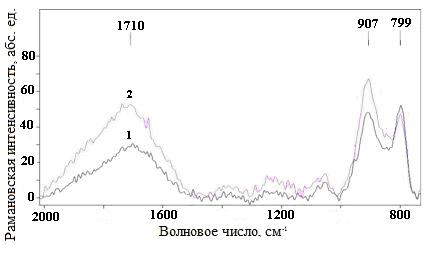
Рис. 2. Фрагменты КР-спектров: 1 - образец, промытый соляной кислотой и дистиллированной водой, 2 – образец, промытый только дистиллированной водой.
Визуализация полученных тубулярных объектов осуществлена с помощью сканирующего электронного микроскопа при увеличениях 20000-60000. На СЭМ-изображениях отчетливо выделяются агломераты частиц диоксида титана. Нанотрубки фиксируются как «мостики», связывающие отдельные частицы (рис. 3).

Рис. 3. СЭМ-изображение полученного порошка. Увеличение 20000 и 40000.
Поскольку условия синтеза были очень мягкими, то и выход нанотрубок невелик, что объясняет вид КР-спектров. Содержание оставшегося анатаза в порошке по данным СЭМ, действительно, существенно выше, чем нанотрубок.
Считается [5, 6], что модель образования нанотрубок TiO2 можно представить по такой схеме: кристалл диоксида титана, реагируя с раствором щелочи NaOH, образует двумерную структуру, которая изгибается, чтобы соединить ненасыщенные связи краевых атомов, а при дальнейшем закручивании получается одномерная структура, представляющая собой нанотрубку. Однако, на рис. 3 и 4 отчетливо видно, что нанотрубки растут от поверхности частиц, больше напоминая крону дерева. При этом «мелкие» «ветви» сливаются в более крупные объекты диаметром 60-80 нм. По-видимому, образование нанотрубок можно скорее представить как возникновение спиралевидных структур на растворяющемся кристалле, рост которых происходит из пересыщенного раствора за счет растворения более мелких кристаллов. Размеры нанотрубок в начале их роста соответствуют диаметру использованных в эксперименте наночастиц [1], составлявшему по данным сканирующей электронной микроскопии 30-45 нм, а по данным измерений методом тепловой десорбции азота 20-22 нм. Диаметр нанотрубок после объединения нескольких первичных объектов, по-видимому, не является величиной аддитивной, зависящей только от количества и диаметра суммируемых объектов, а определяется какими-то структурными параметрами.
Энергодисперсионный анализ элементного состава поверхности показал, что, несмотря на тщательное промывание осадков (на СЭМ-изображениях приведен образец после промывания раствором соляной кислоты и водой), полностью удалить натрий не удалось (см. таблицу 1).

Рис. 4. СЭМ изображение нанотрубок TiO2. Увеличение 60000.
Содержание натрия на поверхности составляет до 1,2 % (масс.). Корректно определить элементный состав только нанотрубок использованным методом невозможно из-за малой величины объектов. Примерное соотношение элементов на поверхности после учета атомной массы также приведено в таблице.
Состав поверхности полученного осадка
|
Спектр |
Содержание элемента, масс. % |
Соотношение элементов |
||
|
O |
Na |
Ti |
||
|
1 2 3 4 5 6 7 |
58,84 48,53 52,99 19,77 49,89 28,43 9,85 |
0,71 1,07 1,20 - 1,07 0,77 - |
40,45 50,39 45,80 80,23 48,95 70,80 90,15 |
Na0,04TiO10 Na0,05TiO3 Na0,05TiO4 TiO0,7 Na0,05TiO3 Na0,02TiO TiO0,3 |
Обращает на себя внимание присутствие незначительных количеств натрия практически во всех спектрах, а также низкое содержание кислорода в некоторых спектрах (спектры 4, 6, 7). Учитывая роль натрия в образовании цеолитов [2, 4], можно предположить, что именно ионы натрия являются и в данном случае на первых этапах образования нанотрубок организующим началом, которое приводит к формированию замкнутых структур по типу супрамолекулярных соединений «хозяин-гость» [7].
Выводы
Синтез нанотрубок диоксида титана из кристаллического нанопорошка анатаза происходит уже при температуре 40 оС и атмосферном давлении.
По данным сканирующей электронной микроскопии установлено, что формирование нанотрубок в этих условиях происходит не при сворачивании частично растворенных кристаллитов, а за счет «достраивания» кристаллитов в определенном направлении из пересыщенного раствора. При этом нанотрубки способны при контакте друг с другом в дальнейшем развиваться как единый объект, диаметр которого не является величиной аддитивной.
Вне зависимости от условий промывания порошков после обработки на их поверхности отмечено незначительное содержание натрия и существенное обеднение некоторых участков поверхности кислородом.
На КР-спектрах отмечено значительное содержание анатаза в осадках и малоинтенсивные пики, которые могут быть интерпретированы как пики нанотрубок диоксида титана.
Рецензенты:
Олонцев В.Ф., д.т.н., профессор, с.н.с. Научного центра порошкового материаловедения ФГБОУ ВПО «Пермский национальный исследовательский политехнический университет», г. Пермь.
Пойлов В.З., д.т.н., профессор, зав.кафедрой «Химические технологии» ФГБОУ ВПО «Пермский национальный исследовательский политехнический университет», г. Пермь.



