В настоящее время значительное развитие получили исследования биологических эффектов воды с пониженным содержанием дейтерия («лёгкая вода») [2,7]. Изучение возможных механизмов влияния изотопного состава воды на работу биологических систем показало их сложность и разнообразие. Высказаны предположения о воздействии дейтерия на системы водородных связей, обеспечивающие структуру и функции макромолекул. Так, по мнению авторов [3], при инкубации клеток в воде с измененным относительно первоначального соотношением D/H, изменяется не только соотношение дейтериевой и протиевой воды внутри биологической системы как растворителя, но также осуществляется изотопный обмен в гидроксильных, сульфгидрильных, карбоксильных и аминогруппах молекул всех органических соединений.
Накопление мутаций, которое увеличивает генетический груз, создает угрозу генетической безопасности населения [5]. Современная медицина позволяет «откорректировать» фенотипические проявления многих наследственных патологий, создать адаптивную среду для генотипов, которые в более жестких условиях были бы элиминированы естественным отбором, и тем самым повышает их приспособленность и способствует передаче генов наследственных заболеваний следующим поколениям. Дети с врожденными пороками развития (ВПР) не только выживают, но и в будущем имеют равные с другими лицами шансы вступить в брак и иметь потомков, которым они передадут свои гены, что может привести к постепенному накоплению в популяции мутаций, обусловливающих развитие данных ВПР. Расщелины губы и неба являются результатом нарушения нормального эмбрионального процесса развития плода. Помимо мониторинга, лечения и реабилитации детей с данными ВПР челюстно-лицевой области (ЧЛО) всегда параллельно шла профилактика появления этой патологии [4].
В мире активно ведутся работы по поиску генетических маркеров и факторов образа жизни, вызывающих ВПР ЧЛО. В результате этих исследований были выявлены несколько областей генома, где расположены гены, участвующие в формировании врожденных пороков развития челюстно-лицевой области (1q32, 2p13, 3q27-28, 9q21, 12p11, 14q21-24 и 16q24). В ряде случаев установлены непосредственно и те гены, дефекты в которых обусловливают развитие ВПР ЧЛО. Это, например, гены IFR6 (1q32) и FOXE1 (9q21) [11].
Многочисленные данные по изучению функционального статуса системы лимфоцитов, основной в клеточном отношении клеточной популяции периферической крови, оснащенной мощными микробицидными и цитотоксическими механизмами, является основанием для изучения роли данных клеток в патогенезе различных патологий, сопряженных с цитолитическим процессом. Лимфоциты являются источником активных форм кислорода, осуществляют первую линию защиты, и от их хемотаксической, фагоцитарной и метаболической активности во многом зависит состояние иммунной системы и организма в целом.
Изучение структуры иммунных органов (тимуса и селезенки) показало, что механизмы адаптивного эффекта воды со сниженным содержанием дейтерия обусловлены повышением общей резистентности организма экспериментальных животных [9]. «Легкая вода» оказывает стимулирующее действие на живые системы, существенно повышает их активность, жизнестойкость к различным негативным факторам, репродуктивную деятельность, улучшает и ускоряет обмен веществ [9]. Указанные свойства воды с пониженным содержанием дейтерия и ее успешное использование в качестве вещества, влияющего на скорость протекания химических реакций, сольватации и подвижности ионов, позволяют предположить ее благоприятное действие на клеточные структуры иммунокомпетентных клеток для предотвращения их неконтролируемого массового апоптоза.
В этой связи целью настоящей работы было исследование влияния воды с пониженным содержанием дейтерия на функциональные свойства клеток иммунной системы человека – лимфоцитов, полученных из крови больных с ВПР ЧЛО, имеющих мутации SNP двух генов FOXE1 и MHFTR.
Материал и методы исследования
Сведения о детях с врожденными пороками развития челюстно-лицевой области (ВПО ЧЛО) получены из диспансерной компьютерной базы данных, созданной на кафедре детской стоматологии, ортодонтии и челюстно-лицевой хирургии Кубанского государственного медицинского университета.
Из собранных образцов крови у детей с ВПР ЧЛО (n = 15), верифицированных в соответствии с МКБ-10 (коды Q35-Q37), а также у детей контрольной группы (n = 12) с помощью наборов реактивов фирмы «Изоген» (Москва) выделены ДНК.
Выделение чистой взвеси лимфоцитов из донорской крови проводилось в двойном градиенте плотности фиколла-урографина (плотность 1,077 г/мл) [8]. Лимфоциты троекратно отмывались и инкубировались в физиологическом растворе, приготовленном на воде с пониженным содержанием дейтерия (40 ± 2 ppm) при комнатной температуре в течение 1 – 24 часов. После этого клетки лизировались 4,5 М раствором мочевины в течение 10 мин при комнатной температуре. Лизаты клеток в экспериментальных образцах подвергались щелочной обработке в течение 30 мин при 0 0С, а затем подвергали интенсивному встряхиванию на Вортексе в течение 15 сек. Контрольные образцы щелочной обработке не подвергались и использовались для определения фоновой флюоресценции. После этого во все образцы добавлялся раствор бромистого этидия. После щелочной обработки лизатов и добавления бромистого этидия измерялась интенсивность флюоресценции полученных образцов на флюоресцентном спектрофотометре Hitachi при λпогл 610 ± 5 нм.
Количество однонитевых разрывов ДНК оценивалось по отношению величин флюоресценции контрольных и экспериментальных образцов. Результаты представлялись в виде процентного соотношения количества щелочнолабильных сайтов ДНК, содержащих однонитевые разрывы к общему количеству ДНК.
В ряде экспериментов использовался рекомбинантный человеческий фактор некроза hTNFα, при этом в среде создавалась концентрация hTNFα равная 10 нг/мл. Воду с пониженным содержанием дейтерия производили на ранее разработанной установке ЛВ-1. Определение концентрации дейтерия в полученной воде были проведены на импульсном ЯМР спектрометре JEOL JNM-ECA 400MHz.
Лабораторное диагностическое обследование выполнено в соответствии с обязательным соблюдением этических норм, изложенных в Хельсинкской декларации 1975 г. с дополнениями 1983 года. Полученные данные анализировали в пакете статистического анализа Statistica 6.0. Сравнение групп по количественным признакам проводили с использованием двухвыборочного t-критерия Стьюдента. Корреляционную зависимость и силу связи устанавливали, используя корреляционный анализ по Спирману. Различия считали статистически значимыми при р < 0,05 [1].
Результаты и обсуждение
На первом этапе у детей с ВПР ЧЛО и в контрольной группе проведена проверка на достоверность различий между классами генотипов, не содержащими «плохих» аллелей, против классов генотипов, содержащих хотя бы один «плохой» аллель: С/С против С/Т + Т/Т по SNP C677T и АА против А/С + С/С по SNP A1298С. Данная проверка показала отсутствие достоверных различий по первому SNP (χ2 = 0,2877; d, f = 1; Р ≥ 0,05) и достоверные различия по второму SNP (χ2 = 4,7120; d, f = 1; Р ≤ 0,05).
Среди установленных генов многие являются факторами транскрипции, а выявленные маркеры приводят к снижению экспрессии генов, нарушению структуры сайтов для прикрепления факторов транскрипции или к нарушению функционирования гена. Нами определены SNP двух генов FOXE1 и MHFTR, кодирующих фермент метилентетрагидрофолатредуктазу, который участвует в фолатном обмене.
Для изучения влияния воды с пониженным содержанием дейтерия на жизнеспособность иммунокомпетентных клеток in vitro лимфоциты, изолированные из крови здоровых доноров и больных с ВПР ЧЛО, инкубировались в физрастворах, приготовленных на воде с природным содержанием дейтерия (содержание D 150 ±2 ppm) и на воде с измененным изотопным составом (содержание D 40 ppm). После лизирования клеток и соответствующей обработки растворов получены спектры флюоресценции, приведенные на рис.1.
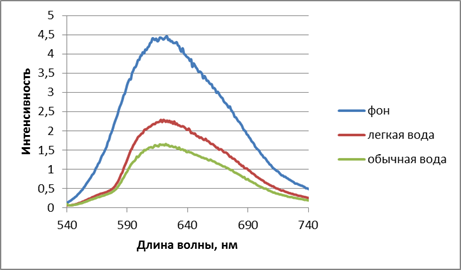
Рис. 1. Интенсивность флюоресценции раствора бромистого этидия с лизатами лимфоцитов крови больных с ВПР ЧЛО. Инкубирование в физрастворах, приготовленных на обычной дистиллированной воде (содержание D 150 ppm) и воде с измененным изотопным составом (содержание D 40 ppm). Время инкубирования 16 час, t = 24 0С.
Обнаружено, что инкубация лимфоцитов в физрастворе, приготовленном на воде с содержанием дейтерия 40 ppm за 16 часов уменьшает количество однонитевых разрывов ДНК по сравнению с контролем с 59–62 % до 36–40 %. Увеличение времени инкубирования до 24 час существенно не влияло на полученные значения. При аналогичной обработке лимфоцитов, полученных из крови здоровых доноров, количество однонитевых разрывов ДНК было существенно меньше, мало зависело от среды инкубирования и составляло 2,5 ± 0,2 % (рис. 2). Это свидетельствует, о том, что ДНК лимфоцитов здоровых доноров менее подвержены повреждениям по сравнению с ДНК лимфоцитов больных с ВПР ЧЛО, в которых наблюдаются мутации SNP двух генов FOXE1 и MHFTR.
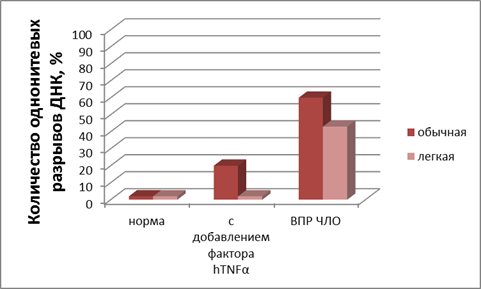
Рис. 2. Влияние воды с измененным изотопным составом на количество однонитевых разрывов лимфоцитов в норме, с добавлением в инкубационную среду 10 нг/мл hTNFα и у больных ВПР ЧЛО. Инкубирование в физрастворах, приготовленных на обычной дистиллированной воде (содержание D 150 ppm) и воде с измененным изотопным составом (содержание D 40 ppm). Время инкубирования 16 час, t = 24 0С
При использовании обычной воды действие фактора некроза hTNFα приводит к прогрессивному накоплению однонитевых разрывов ДНК в клетках. Уже через 3 часа инкубации количество однонитевых разрывов ДНК в лимфоцитах здоровых доноров составляло 21,3 ± 3,1 % (рис.2), а больных с ВПР ЧЛО – 70,3 ± 5,2 %.
Таким образом, в ходе выполнения исследования было показано, что вода с пониженным содержанием дейтерия является либо ингибитором апоптоза иммунокомпетентных клеток, либо активирует их ДНК-репарирующие системы.
Для выяснения данного предположения были проведены эксперименты с использованием рекомбинантного человеческого фактора некроза опухолей hTNFα. Как известно, hTNFα является провоспалительным цитокином, который инициирует апоптоз как в лимфоцитах, так и в нейтрофилах [6]. В экспериментах в среде создавалась концентрация hTNFα, равная 10 нг/мл, которая гарантированно инициирует апоптоз лимфоцитов. Клетки, выделенные из крови здоровых доноров, инкубировались в физрастворе, приготовленном на воде с содержанием дейтерия 40 ppm в присутствии hTNFα и без него при комнатной температуре. Для контроля лимфоциты инкубировались в физрастворе, приготовленном на обычной дистиллированной воде, также в присутствии и в отсутствии hTNFα. По истечении времени инкубации проводили измерения количества однонитевых разрывов ДНК.
При использовании воды с содержанием дейтерия 40 ppm количество однонитевых разрывов в лимфоцитах достигало максимума через 2 часа инкубации, а затем резко снижалось. Такое поведение клеток в воде с пониженным содержанием дейтерия, возможно, связано с тем, что наряду с возникновением однонитевых разрывов в клетках активируются системы ее репарации, ликвидирующие эти разрывы. Появлению однонитевых разрывов ДНК предшествует ее фрагментация, которая наблюдается при вхождении клеток в стадию апоптоза. Вода с пониженным содержанием дейтерия, по-видимому, делает обратимым этот процесс.
Процессы повреждения/репарации ДНК клетки контролируются киназами, которые активируются в ответ на обрыв вилки репликации, неполную репликацию ДНК и на различные типы повреждений ДНК. Это инициирует сигнальные каскады в контрольных точках клеточного цикла [10].
Одно- и двунитевые разрывы ДНК являются частыми событиями в эукариотических клетках: либо при физиологических условиях в лимфоцитах, либо при патологических процессах, при окислительном стрессе, ионизирующем излучении, нарушении функционирования ферментов клеточного ядра. Однонитевые разрывы репарируются по негомологичным концам ДНК (система NHEJ) на всех этапах клеточного цикла, представляющий основной механизм репарации в G1 или гомологичных рекомбинациях (HR) в S или G2 фазах клеточного цикла . NHEJ включает в себя связывание гетеродимерного Ku -белка с одноцепочечными концами ДНК, присоединение к ДНК-зависимой протеинкиназе каталитической субъединицы (DNAPKcs ) и активации киназы ДНК-PНK [10].
Совокупность катаболических и анаболических реакций иммунокомпетентных клеток опосредуется узким местом – системой накопления и преобразования энергии. Дыхательная цепь, имеющаяся и у лимфоцитов, среди прочего, обеспечивает создание трансмембранного градиента протонов, необходимого для деятельности АТФ-синтетаз и других ключевых ферментов энергетического цикла. Кроме того, сам трансмембранный градиент является способом кратковременного накопления и/или сохранения энергии, необходимой для жизнедеятельности клетки [10].
Заключение
Адаптация клеток к пониженным концентрациям дейтерия в среде может способствовать увеличению функциональной активности систем клетки, связанных со значительными траффиками ионов водорода и последующей активацией системы ДНК-репарации, связанной с большими затратами энергии. Среда с пониженным содержанием дейтерия создает более благоприятные условия функционирования клеток иммунной системы, о чем свидетельствует большая сохранность лимфоцитов при инкубации в подобной среде. Проведенные исследования подтверждают тот факт, что вода с пониженным содержанием дейтерия активирует репаративные системы клеток, тем самым предотвращая их апоптоз. Это открывает перспективы для использования такой воды при различных видах ВПР с целью предотвращения неконтролируемой массовой гибели иммунокомпетентных клеток.
Рецензенты:
Быков И.М., д.м.н., профессор, ГБОУ ВПО Кубанский государственный медицинский университет, заведующий кафедрой фундаментальной и клинической биохимии Кубанского государственного медицинского университета, г. Краснодар;
Колесникова Н.В., д.м.н., профессор, ГБОУ ВПО Кубанский государственный медицинский университет, заведующая ЦНИЛ, г. Краснодар.



