Введение
Большинство процессов, протекающих в природе, в живых организмах, в химической технологии происходят в водных растворах. Кроме того, данные по растворимости служат одним из основных параметров, которые лежат в основе построения теоретических представлений о растворах. Термодинамические же данные о химических равновесиях и их компонентах зависят от природы растворяемых веществ. Важность изучения физико-химических свойств ферроцена и его кислородсодержащих производных, включая политермы растворимости, определяется широким применением данных соединений в различных областях человеческой деятельности. В ряде наших работ [1; 3-5] была изучена политермическая растворимость ферроцена и ряда его кислородсодержащих производных (гидроксо-, ацетил-, ацетилацетонато-) в воде и в смешанных водно-органических растворителях. В литературе же отсутствуют прецизионные данные по растворимости карбоксильных производных ферроценового ряда в зависимости как от температуры, так и природы растворителя. Поэтому целью настоящего исследования являлось: установление закономерностей в растворимости кислородсодержащих производных ферроцена в воде, оценка характера изменения с термодинамических позиций.
Экспериментальная часть
Ферроценилуксусная (ФУК) и ферроценилдиуксусная (ФДУК) кислоты были получены и очищены по известным методикам [2]. Водные растворы ФУК и ФДУК готовили на бидистиллированной воде. Для определения растворимости использовали метод изотермического насыщения растворов [7]. Изотермические условия при насыщении растворов задавались режимом работы шейкера, совмещенного с термостатом и водяной баней, и контролировалось с помощью ртутного термометра (± 0.2 оС). Истинное равновесие процесса растворения устанавливалось в течение нескольких часов (до 5-6 часов). Подход к равновесию осуществляли как со стороны низких температур, так и со стороны более высоких температур, при этом получали сходящиеся в пределах ошибок определения результаты. Каждый опыт проводили как минимум в трех параллелях.
Растворимость ФУК и ФДУК в воде определяли спектрофотометрическим методом. Все измерения оптической плотности растворов были проведены на спектрофотометре СФ-26 с толщиной светопоглощающего слоя 1 см. Калибровку, пробоотбор, приготовление фотометрируемых растворов и измерения осуществляли при тщательном контроле воспроизводимости. Определение концентрации растворов осуществляли по методике, описанной в работе [6].
Обсуждение результатов
Температуры плавления кислот (ФУК – 158-160 оС, ФДУК – 167-171 оС) соответствуют литературным данным [2]. Для дополнительной идентификации были сняты электронные спектры поглощения (рис. 1). При длинах волн в видимой области спектра, соответствующих максимуму поглощения для ФУК – 500 нм, а для ФДУК – 455 нм, были построены калибровочные графики для определения растворимости.
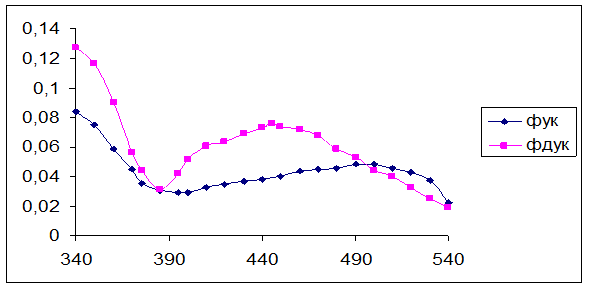
Рисунок 1. Электронные спектры поглощения ФУК и ФДУК.
Следует отметить, что растворы обеих кислот обладают светочувствительностью, поэтому колбы, в которых определяли растворимость, предохраняли от действия света. В связи с высокой степенью светочувствительности ФДУК при температурах выше 45 °С растворимость данного соединения была определена только до этой температуры. Опытные данные по растворимости приведены в табл. 1.
Таблица 1
Экспериментальные данные по растворимости ФУК и ФДУК в воде при различных температурах
|
Температура, оС |
Растворимость (-lg S) |
|
|
ФУК (±0,02) |
ФДУК (±0,01) |
|
|
25 |
3,77 |
4,24 |
|
30 |
3,68 |
4,15 |
|
35 |
3,53 |
4,02 |
|
40 |
3,44 |
3,88 |
|
45 |
3,27 |
3,73 |
|
50 |
3,21 |
- |
Растворимость ФУК при всех исследованных температурах выше, чем растворимость ФДУК, что можно связать с увеличением размеров растворяемых молекул. В соответствии с теорией масштабной частицы (SPT) чем больше размер растворяемой молекулы, тем больших энергетических затрат потребуется на процесс перевода данного вещества из кристаллической фазы в раствор [8]. Растворимость ФУК при всех изученных температурах в воде немного больше, а ФДУК незначительно меньше по сравнению с ферроценом [4; 5].
При всех температурах растворимость ФУК больше, чем ФДУК. С увеличением температуры растворимость обеих кислот увеличивается, что свидетельствует об эндотермичности процессов их растворения.
Для определения изменения энтальпии при растворении использовали уравнение изобары Вант-Гоффа:
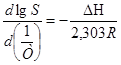 .
.
Графические зависимости логарифма растворимости (S – растворимость, моль/л) от 1/T являются линейными. По тангенсу угла наклона этих линейных зависимостей определены значения изменения величины энтальпии процесса растворения (ΔН). Далее по обычным термодинамическим соотношениям находили величину изменения значения стандартной свободной энергии Гиббса процесса растворения:
![]() Gо = - RT ln Sо
Gо = - RT ln Sо
и затем изменение значения стандартной энтропии:
ToΔSо = ΔH - ΔGo .
Результаты расчета термодинамических функций процесса растворения ФУК и ФДУК в воде приведены в табл. 2. Небольшое увеличение растворимости ФУК и незначительное понижение растворимости ФДУК по сравнению с ферроценом обусловлено противоборством энтальпийного и энтропийного факторов данного процесса. Для оценки «энергетических затрат» в балансе действия этих двух факторов только на введенный(е) заместитель(и) в ферроценовое кольцо определены как разности между кислотой и ферроценом и представлены в табл. 2. Следует отметить факт почти полной компенсации этих двух факторов. Однако их баланс таков, что за счет некоторого превышения следа энтропийной составляющей для ФУК приводит к незначительному повышению растворимости, а для ФДУК превышение энтальпийной – к уменьшению растворимости в воде по сравнению с ферроценом. Один заместитель в ферроценовом кольце дает больший энергетический эффект в стабилизацию равновесия процесса «кристалл – раствор», введение же второго заместителя смещает данное равновесие в сторону кристаллической фазы и растворимость ФДУК в воде при одной и той же температуре меньше, чем ФУК.
Таблица 2
|
Термодинамическая характеристика |
Ферроцен |
ФУК |
ФДУК |
|
ΔGo |
23,6±0,4 |
21,5±0,3 |
24,2±0,2 |
|
ΔH |
24,8±0,3 |
71,0±0,2 |
69,5±0,4 |
|
TΔSo |
1,2±0,7 |
49,5±0,5 |
45,3±0,6 |
|
Δ(ΔGo) |
|
-2,1 |
0,6 |
|
Δ(ΔH) |
|
46,2 |
44,7 |
|
Δ(TΔSo) |
|
48,3 |
44,1 |
Термодинамические характеристики (кДж/моль) процессов растворения ферроцена и его кислот в воде
Рецензенты:
Жереб В.П., д.х.н., профессор кафедры управления качеством и сертификации Сибирского государственного аэрокосмического университета им. М.Ф. Решетнева, г. Красноярск.
Ступко Т.В., д.т.н., профессор, заведующая кафедрой химии Красноярского государственного аграрного университета, г. Красноярск.



