Введение
В XXI веке проблемы здорового питания приобрели высокую актуальность в связи с установлением определенных корреляций между особенностями диеты и возникновением различных видов патологии у потребителей, включая целый ряд возраст-зависимых заболеваний (к которым, например, относят многие болезни сердечно-сосудистой и нервной систем) [3; 9]. Прямым следствием этого стали активные разработки так называемых функциональных продуктов питания, в частности функциональных мясных продуктов (ФМП), способных, по мнению разработчиков, оказывать значимые оздоровительные эффекты и снижать риск возникновения многих тяжелых заболеваний [3; 4]. По существующим представлениям особые биологические свойства ФМП обеспечиваются различными функциональными ингредиентами (ФИ), которые специально включают в состав продуктов. К ФИ относят витамины, полиненасыщенные жирные кислоты, а также белковые препараты (животного и растительного происхождения) и другие соединения [4; 8]. При этом в исследованиях белков разного происхождения, которые рассматривались как потенциальные ФИ, отдельными авторами были успешно применены протеомные технологии [7; 8]. Более того, протеомные технологии оказались весьма эффективными для выявления в мясных продуктах термоустойчивых и видоспецифичных белков, способных стать соответствующими биомаркерами [6]. В нашей предыдущей работе также с помощью протеомных технологий в образцах свиного сырья и в специально изготовленных ФМП удалось определить несколько тканеспецифичных белков, которые могут быть использованы как потенциальные биомаркеры при анализе мясной продукции [1].
Цель исследования заключалась в проведении сравнительного протеомного изучения белков в образцах мясного сырья (говядине и свинине), а также в мясных продуктах - двух известных видах вареных колбас («Докторская» и «Любительская») и двух отечественных ФМП. При этом выполнялся поиск видо- и тканеспецифичных мышечных белков, а также определение белков немышечного происхождения (потенциальных ФИ). Полученные результаты предназначались для расширения отечественной базы данных «Протеомика мышечных органов» [5].
Материал и методы исследования
В работе исследовали следующие препараты говядины и свинины: образцы скелетных мышц, взятые вскоре (2-3 ч) после забоя животных (М-1) или прошедшие 96 часов автолиза (М-2); образцы сердечной мышцы, взятые вскоре (2-3 ч) после забоя животных (С-1) или прошедшие 96 часов автолиза (С-2); образцы аорты, прошедшие 96 часов автолиза (Ар-2). Автолиз изучавшихся образцов проходил в течение 4 суток. Параллельно анализировали образцы вареных колбас «Докторская» и «Любительская», а также двух отечественных функциональных мясных продуктов (ОФМП), произведенных из мясного сырья. Оба вида ОФМП (ОФМП-1 и ОФМП-2) изготавливались в форме паштетов по рецептуре, описанной ранее [1]. Все перечисленные биоматериалы были получены (и/или произведены) в ГНУ «Всероссийский научно-исследовательский институт мясной промышленности им. В.М. Горбатова».
В качестве основных протеомных технологий применяли различные модификации двумерного электрофореза по О`Фарреллу с изоэлектрофокусированием в амфолиновом (IEF-PAGE) или иммобилиновом (IPG-PAGE) градиентах pH, как описано ранее [1; 2]. Детекция белков на гелевых пластинах проводилась окрашиванием Кумасси R-250 и азотнокислым серебром. Цифровые изображения двумерных электрофореграмм получали сканированием (сканер Epson Perfection 2450 Photo) и редактировали в графическом редакторе из пакетов программ ImageMaster 2D Platinum версия 7 (GE Healthcare, Швейцария).
Идентификацию белковых фракций на ДЭ осуществляли после трипсинолиза методами MALDI-TOF MS и MS/MS масс-спектрометрии на MALDI-времяпролетном масс-спектрометре Ultraflex (Bruker, Германия) с УФ-лазером (336 нм) в режиме положительных ионов в диапазоне масс 500-8000 Да с калибровкой их по известным пикам аутолиза трипсина [1; 2]. Анализ полученных масс-спектров триптических пептидов выполняли с помощью программы Mascot (Matrix Science, США), осуществляя поиск по базам данных Национального центра биотехнологической информации США (NCBI), базе данных UniProt и другим общедоступным биоинформационным интернет-ресурсам. О результатах идентификации судили по традиционным критериям: показателю соответствия (score), количеству совпавших пептидов (№ matched peptides) и покрытию ими полной аминокислотной последовательности идентифицируемого белка (coverage). Кроме того, учитывалось сходство экспериментально полученных значений Mm и pI у идентифицируемого белка с соответствующими расчетными значениями [1; 2].
Результаты исследования и их обсуждение
Фракционирование двумя модификациями двумерного электрофореза с изоэлектрофокусированием в амфолиновом (IEF-PAGE) или иммобилиновом (IPG-PAGE) градиентах pH белковых экстрактов из образцов мясного сырья и мясных продуктов обеспечило получение во многом сходных протеомных профилей, которые состояли из нескольких десятков (до сотни) белковых фракций, окрашиваемых Кумасси R-250. Выявляемые фракции характеризовались значениями молекулярных масс (Мм) от 220 кДа до 10 кДа и располагались в широком диапазоне изоэлектрических точек (pI).
На рис. 1, в качестве примера, представлена типичная двумерная электрофореграмма белков из образца М-1 коров, на которой показана 51 белковая фракция, идентифицированная масс-спектрометрическими методами. Результаты идентификации фракций, принадлежащих некоторым тканеспецифичным мышечным белкам, приведены в таблице 1.
Сходство протеомных профилей всех изучавшихся биоматериалов в значительной степени определяло присутствие ряда основных саркомерных белков, зоны расположения которых выделены на рис. 1 пунктирными прямоугольниками.

Рис. 1. Двумерная электрофореграмма белков скелетной мышцы коров (Bos Taurus). Окраска Кумасси R250. Стрелками показаны белки, идентифицированные масс-спектрометрическими методами. Пунктирными прямоугольниками выделены зоны расположения ряда основных саркомерных белков: А/Д актин – десмин; ТПМ – тропомиозины; ТнТ – изоформы тропонина Т; МЛЦ – миозиновые легкие цепи.
В целом на двумерных электрофореграммах всех изучавшихся образцов было идентифицировано более 200 белков (из них 108 у образцов М-1 свиней), и соответствующие материалы вошли в отечественную базу данных «Протеомика мышечных органов» (БД ПМО) [5], доступную пользователям сети Интернет по адресу: http://mp.inbi.ras.ru.
Таблица 1. Результаты масс-спектрометрической идентификации некоторых фракций, принадлежащих тканеспецифичным мышечным белкам Bos Taurus.
|
Номер на рис. 1 |
Наименование белка, (символ гена), обозначение в БД «ПМО» |
Номера в Protein NCBI и/или UniProt |
Score / № match peptides / coverage* |
Mm/pI |
|
|
эксп.** |
расчет.*** |
||||
|
9 |
Тропонин Т скелетно-мышечный, быстрый тип, вариант fTnT3/17(Tnnt3) fTnT3/17 |
21039002 / Q8MKI3 |
175 / 16 / 41 |
31,0/8,80 |
30,7/8,70 |
|
21 |
Тропомиозин альфа 1 (TPM1) TPM1 |
61888866 / Q5KR49 |
611 / 43 / 84 |
32,6/4,69 |
32,7/4,69 |
|
22 |
Миозиновая легкая цепь 1/3, скелетно-мышечная изоформа, (MYL1) MYL1 |
118601750 / A0JNJ5 |
173 / 17 / 70 |
21,5/5,10 |
20,9/4,96 |
|
30 |
Десмин (DES) DES |
126158909 / O62654 |
372 / 34 / 67 |
53,0/5,25 |
53,5/5,21 |
* Расшифровка использованных критериев идентификации дана выше в разделе «Материал и методы исследования.
** эксп. – экспериментально определенные значения Mm (в кДа) и pI по электрофоретическим характеристикам соответствующих фракций, как описано ранее [2].
*** расчет. - значения Mm (в кДа) и pI соответствующих белков, рассчитанные по их данным об их аминокислотных последовательностях с помощью программы Expasy Compute pI/Mw tool (http://web.expasy.org/compute_pi/).
При сравнительном протеомном анализе образцов вареных колбас было установлено, что в обоих коммерческих продуктах присутствуют мышечные белки коров и свиней, а также отдельные белки немышечного происхождения. Некоторые белковые фракции удавалось идентифицировать как видоспецифичные белки коров, а другие - как белки свиней. Так, на рис. 2 показаны синими стрелками две электрофоретические изоформы (№ 4 и 7) быстрого скелетномышечного тропонина I Bos taurus, а красными – два специфичных для мышц фермента Sus scrofa (№ 8 - фосфоглицератмутаза 2 и № 9 – карбоангидраза 3). При этом фракция № 14 (обозначенная фиолетовой стрелкой) оказалась белком коровьего молока – одной из изоформ казеина. Кроме того, в образцах колбасы «Любительская» были обнаружены и идентифицированы отдельные белки сои. Надо отметить, что некоторые авторы рассматривают соевые белки как перспективные ФИ для изготовления ФМП [3].

Рис. 2. Фрагмент двумерной электрофореграммы белков колбасы «Докторская», на котором показаны идентифицированные белки коровы (синие стрелки), белки свиньи (красные стрелки) и белок коровьего молока (фиолетовая стрелка). Остальные пояснения в тексте.
Сравнение протеомных профилей свежеполученных образцов мышечных тканей и образцов, прошедших четырехдневный автолиз, а также ОФМП, показало, что отдельные белки в них подвергаются специфической и неспецифической протеолитической деградации. Первый вид деградации проявлялся появлением дополнительных фракций, представлявших собой определенные укороченные формы известного белка (рис. 3).
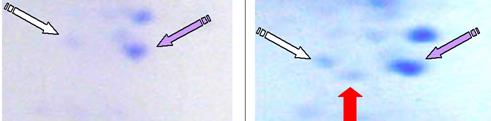
Рис. 3. Фрагменты двумерных электрофореграмм белков образцов С1 и С2. Лиловые стрелки показывают фракции, идентифицированные как полноразмерный aВ-кристаллин, белые стрелки – неидентифицированный реперный белок. Красной стрелкой обозначена дополнительная фракция, появляющаяся через 96 ч автолиза и идентифицированная как фрагмент aВ-кристаллина.
Признаком второго вида деградации становилось изменение формы (уменьшение размеров, размытость и образование вертикальных треков), а также иногда исчезновение некоторых мажорных мышечных белков (рис. 4).
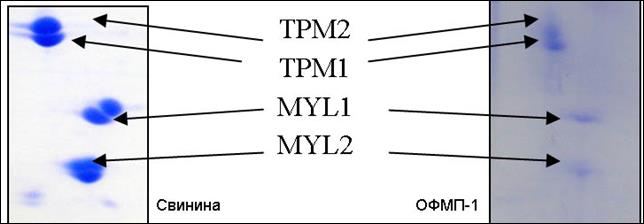
Рис. 4. Фрагменты двумерных электрофореграмм белков образца свинины (сырьё) и образца ОФМП-1, на которых располагаются фракции тропомиозинов (TPM1 и TPM2), а также миозиновых легких цепей (MYL1 и MYL2).
Эти данные в целом свидетельствуют о том, что протеомные технологии представляют собой набор удобных инструментов, позволяющих характеризовать особенности белкового состава (протеомных профилей) различных образцов мясного сырья и мясных продуктов, включая определение в них различных белковых биомаркеров.
Заключение
Проведенный протеомный анализ белков в образцах мясного сырья (говядины и свинины), а также в двух видах вареных колбас и двух ОФМП позволил отметить определенное сходство протеомных профилей исследованных биоматериалов, которое обусловлено присутствием в них ряда саркомерных тканеспецифичных белков (тропонинов, мышечных изоформ миозиновых легких цепей, a-тропомиозина, десмина). В образцах мясных продуктов выявлены некоторые видоспецифичные мышечные белки, а также отдельные белки немышечного происхождения, которые могут рассматриваться как функциональные ингредиенты. В целом в ходе проведенных исследований методами масс-спектрометрии идентифицировано более 200 белковых фракций, из которых 51 в образцах говядины и 108 в образцах свинины. Полученные результаты использованы при построении новой версии (2013 г.) отечественной базы данных «Протеомика мышечных органов» (http://mp.inbi.ras.ru). Таким образом, эта база данных становится биоинформационным ресурсом, пригодным для обеспечения разработок протеомных методов контроля качества мясной продукции.
Работа выполнялась в соответствии с заданиями Государственного контракта № 14.512.11.0038 по теме: «Разработка комплекса биотехнологических методов контроля качества пищевых продуктов, в том числе включающих использование протеомных технологий с апробацией их на вновь созданных функциональных мясных продуктах».
Рецензенты:
Чернов Н.Н., д.б.н., профессор, заведующий кафедрой биохимии РУДН, Российский университет Дружбы народов, г. Москва.
Савицкий А.П., д.х.н., профессор, заместитель директора по научной работе, ФГБУН «Институт биохимии им. А.Н. Баха РАН», г. Москва.



