Ревматоидный артрит (РА) представляет собой аутоиммунное заболевание, основным проявлением которого является хронический синовит и деструкция хрящевой и костной ткани[1].
Ревматоидный артрит характеризуется поражением не только опорно-двигательного аппарата, но и внутренних органов в связи с гиперпродукцией провоспалительных интерлейкинов, потенцирующих системную воспалительную реакцию.
Одним из частых проявлений заболевания является тромбоцитоз[2].
Активированные тромбоциты под действием фосфатидилсерина высвобождают большое количество микровезикул, обладающих прокоагулянтной активностью[3]. Хемокины тромбоцитов в полости сустава индуцируют неоангиогенез и формирование паннуса, а их взаимодействие с лейкоцитами приводит к деструкции хрящевой ткани. Противовоспалительная терапия способна снизить число активированных тромбоцитов[4].
Гиперсекреция провоспалительных цитокинов, таких как интерлейкин-1, -6, -8, фактор некроза опухоли альфа, факторов роста и антител провоцирует активное созревание тромбоцитов в костном мозге[5].
Общеизвестно, что тромбоцитоз при РА ассоциирован с повышением лабораторных острофазовых маркеров воспаления: уровней СОЭ, СРБ, синтезом ревматоидного фактора, лейкоцитозом и др.[4].
О роли тромбоцитоза в оценке активности ревматоидного артрита свидетельствуют и зарубежные авторы. Так, в исследовании Khaled S.A.A., Nasr Eldin E. и др. была предложена новая шкала оценки активности ревматоидного артрита на основании определения среднего объема тромбоцитов и ширины распределения тромбоцитов, а также уровней СОЭ и СРБ[6].
Ревматоидный фактор и антитела к циклическому цитруллинированному пептиду могут атаковать в качестве органа-мишени костный мозг, таким образом аутоиммунные механизмы могут провоцировать развитие первичного миелофиброза. Нередки случаи развития миелопролиферативного заболевания у пациента с ревматологической патологией, так же как и возможно развитие последней при первичном миелопролиферативном процессе. К хроническим негативным по филадельфийской хромосоме миелопролиферативным заболеваниям относятся: первичный миелофиброз, истинная полицетемия (ИП) и эссенциальная тромбоцитемия (ЭТ)[7]. В здоровом организме гемопоэтические факторы роста, воздействуя на рецепторы клеток-предшественниц, активируют тирозинкиназы. При миелопролиферативных заболеваниях мутация тирозинкиназ приводит к нарушению механизма физиологического контроля кроветворения и, как следствие, к пролиферации и выживанию клеток-предшественниц[8].
В патогенезе ревматоидного артрита и миелопролиферативных заболеваний наблюдаются схожие механизмы на уровне передачи сигнала между белками клеточных рецепторов, JAK-киназами и активаторами белков транскрипции STAT. Данный путь участвует в инициации и подавлении воспаления. В развитии ревматоидного артрита главенствующую роль играет физиологическая активация пути JAK/STAT посредством воздействия провоспалительных цитокинов на рецепторы иммунных клеток[9]. Помимо ревматоидного артрита, полиморфизм JAK2 и STAT3 ассоциирован с возникновением воспалительных заболеваний кишечника, псориаза, анкилозирующего спондилита и болезни Бехчета. Патологическая активация передачи сигналов JAK/STAT является особенностью миелопролиферативных заболеваний. Воздействие лигандов, в частности интерлейкинов, интерферонов или эритропоэтинов, на рецепторы клеток-предшественниц приводит к фосфорилированию JAK-киназ, последующему фосфорилированию тирозина и связыванию белков семейства STAT. Активированные STAT, образуя димеры, перемещаются к ядру и вызывают транскрипцию генов, что способствует пролиферации и дифференцировке клеток-предшественниц[10]. Киназа JAK-3 экспрессируется в основном гемопоэтическими клетками, определяя их развитие, в то время как киназы JAK-1, JAK-2 и TYK-2 экспрессируются всеми клетками организма. Одной из причин иммунодефицитов является мутация JAK3 и TYK2.
Чрезмерное фосфорилирование STAT5 и STAT3 приводит к истинной полицитемии; повышенное фосфорилирование STAT3, но пониженное STAT5 отмечается при эссенциальной тромбоцитемии, а пониженное фосфорилирование как STAT5, так и STAT3 характеризует миелофиброз. Гиперактивация пути JAK-STAT вызывает значительные биологические изменения в мегакариоцитах и тромбоцитах, которые могут способствовать повышенному риску тромбообразования.
В 2005 г. была обнаружена точечная соматическая мутация экзона 14 гена киназы JAK-2 (мутация JAK2V617F), что послужило прорывом в первичной и дифференциальной диагностике миелопролиферативных заболеваний. Данная мутация отмечалась в гемопоэтических клетках-предшественниках, что влекло за собой бесконтрольное расширение миелоидных линий. Было установлено, что более чем в 90% случаев мутация гена JAK-2 в 14-м экзоне V617F и в небольшом проценте случаев мутация в 12-м экзоне наблюдалась у пациентов с истинной полицитемией. Аналогическая мутация гена JAK-2 V617F была обнаружена при эссенциальной тромбоцитемии и первичном миелофиброзе – у 55% и 45-68% пациентов соответственно. Стоит отметить, что для данных заболеваний мутация в 12-м экзоне гена JAK-2 не характерна[8].
Эссенциальная тромбоцитемия – наиболее редкая из группы миелопролиферативных заболеваний аномалия системы кроветворения. Точных данных о распространенности этой нозологии на территории Российской Федерации нет, в то время как зарубежные реестры приводят приблизительные цифры заболеваемости: 1,5-2,53 на 100000 населения[11].
Представляем клинический случай, являющийся редким примером ассоциации ревматоидного артрита и эссенциальной тромбоцитемии.
Цель исследования: демонстрация клинического случая эссенциальной тромбоцитемии под маской перманентного тромбоцитоза у пациента с ревматоидным артритом.
Материалы и методы исследования
Пациентка И., 46 лет, находится под наблюдением врача ревматолога с 2020 г. Манифестация заболевания с артрита правого коленного сустава, пястно-фаланговых и проксимальных межфаланговых суставов кистей. Обследована: АЦЦП 2620AU/ml (реф. значения – менее 12), ревматоидный фактор (РФ) не обнаружен. Выставлен диагноз «Серонегативный ревматоидный артрит (РФ-, АЦЦП+), умеренная активность, DAS28 5,2, развернутая стадия, неэрозивный (рентгенологическая стадия 1) ФК 2», установленный согласно критериям ACR/EULAR 2010г. Инициирована терапия метотрексатом 15мг в неделю. На фоне проводимой терапии достигнута низкая активность заболевания, в связи с чем выполнена эскалация дозы метотрексата до 20мг в неделю. С декабря 2022г. ввиду выраженной диспепсии произведено переключение на лефлунамид 20мг в сутки, на фоне приема которого пациентка отмечала частые ОРВИ. За весь период терапии базисными противовоспалительными препаратами (БПВП) выраженного суставного синдрома не наблюдалось, однако потребность в частом приеме нестероидных противовоспалительных препаратов (НПВС) сохранялась и наблюдалась отрицательная рентгенологическая динамика (появление эрозий в области головок 4-х, 5-х пястных костей), несмотря на отсутствие повышения острофазовых маркеров воспаления.
Таким образом, был выставлен окончательный диагноз: «Серонегативный ревматоидный артрит, РФ-, АЦЦП+, развернутая стадия, активность умеренная, DAS28 4,1, эрозивный (рентгенологическая стадия 2) ФК 2 ВАШ 4».
Под наблюдением врача-гематолога пациентка находится с 2017г., когда впервые стал регистрироваться умеренный тромбоцитоз (тромбоциты до 490 тыс./мкл). С 2020г. тромбоцитоз до 600-887 тыс./мкл, мутация гена JAK2V617f не обнаружена. Тромбоцитоз, расцененный как проявление ревматоидного артрита, сохранялся, несмотря на постоянный прием БПВП. В октябре 2022г. произведен повторный генетический анализ: мутация гена JAK-2 V617F 1,1-2,1%.
Общий анализ крови от ноября 2022г.: гемоглобин 132 г/л, эритроциты 4.2 млн, тромбоциты 773 тыс./мкл, лейкоциты 7,0 тыс./мкл, нейтрофилы 59%, лимфоциты 33%, моноциты 7%. Ультразвуковое исследование селезенки от 01.06.2022г.: 89х40 мм. Консультирована гематологом в ФГБУ «НМИЦ гематологии» Минздрава России от декабря 2022г., произведена трепанобиопсия.
Гистологическое исследование трепанобиоптата от 12.12.2023г.: трепанобиоптат с признаками неравномерной резорбции. В многочисленных широких костномозговых полостях определяется неравномерно расположенный костный мозг: участки пониженной клеточности сменяются участками повышенной клеточности. Гранулоцитарный росток расширен и представлен клеточными элементами на всех этапах дифференцировки с преобладанием зрелых форм, в умеренном количестве присутствуют эозинофильные формы. Эритроидный росток в достаточном количестве, эритрокариоциты нормобластического типа. Отмечается пролиферация элементов мегакариоцитарного ростка. Мегакариоциты располагаются преимущественно разрозненно в виде единичных рыхлых кластеров до 4-6 клеток, межтрабекулярно, представлены клетками обычных и крупных размеров с выраженной атипией ядер, определяются безъядерные формы. Строма с геморрагиями. Синусы очагово расширены, полнокровны. Степень ретикулинового фиброза стромы при окраске по Gomori FM 1 на большом протяжении. с участками MF-2 менее 30%. Заключение: морфологическая картина характеризует лимфопролиферативное новообразование, неклассифицируемое (МПН-Н). На морфологическом уровне и при гистохимическом исследовании обнаружены признаки, обусловливающие необходимость проведения дифференциальной диагностики между эссенциальной тромбоцитемией и префиброзной стадией первичного миелофиброза.
Мутация гена JAK-2 V617F от 12.12.2022г.: клетки с мутацией составляют 7% от общего числа клеток в препарате. Мутация 9 экзона гена CALR от 12.12.2022г.: мутация не обнаружена. Мутация гена MPLW515L/К от 12.12.2022г.: мутация не обнаружена. Показатели коагулограммы в норме.
Диагноз: «Миелопролиферативное заболевание: эссенциальная тромбоцитемия».
С середины декабря 2022г. назначена терапия гидроксикарбамидом 500мг/сут., тромбо-АСС 100мг утром.
На представленной ниже диаграмме отражена динамика уровня тромбоцитов крови до и после назначения гидроксикарбамида (рис.).
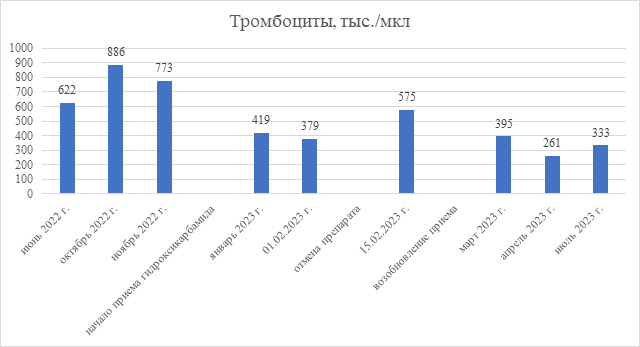
Динамика показателей тромбоцитов крови до и после назначения гидроксикарбамида
Контроль ультразвуковой диагностики органов брюшной полости от января 2023г.: селезенка 95х45 мм, печень не увеличена; от апреля 2023г.: селезенка 99х44 мм, печень не увеличена.
В августе 2023г. пациентка консультирована в ФГБНУ НИИ ревматологии им. В.А. Насоновой. Был рекомендован перевод на терапию таргетными синтетическими препаратами (тофацитинибом) ввиду непереносимости нескольких БПВП и наличия миелопролиферативного заболевания.
Результаты исследования и их обсуждение
Тромбоцитоз – одно из самых часто встречаемых гематологических феноменов ревматоидного артрита, поэтому при назначении терапии БПВП и глюкокортикостероидов закономерна нормализация показателей тромбоцитов крови. Сохранение упорного тромбоцитоза, резистентного к проводимой терапии у таких пациентов, является показанием для поиска миелопролиферативного процесса. В нашем клиническом случае миелопролиферативное заболевание было заподозрено достаточно рано, однако отсутствие маркеров эссенциального тромбоцитоза при первоначальном диагностическом поиске не является гарантом безопасности в дальнейшем.
По факту обнаружения мутации в гене JAK2V617F пациентка выразила убежденность в том, что причиной данной мутации послужил длительный прием метотрексата. Однако исследования зарубежных авторов опровергают это предположение.
Так, в работе Chinnaiya K., Lawson M.A. и соавторов было доказано, что в низких дозах метотрексат действует как ингибитор передачи сигналов JAK/STAT in vivo, а также значительно редуцирует гематологические проявления и спленомегалию у мышиной модели миелопролиферативных заболеваний человека. Итальянские авторы Palandri F., Labate C. и соавторы также продемонстрировали схожие результаты после лечения метотрексатом у пациентов с миелопролиферативными заболеваниями (МПЗ). В этих работах высказываются идеи использовать низкие дозы метотрексата в лечении МПЗ человека в качестве ингибитора JAK/STAT[12; 13].
Общность патогенеза МПЗ и РА на уровне патологической активации передачи сигналов JAK/STAT определила общность подходов к терапии этих состояний.
Ингибиторы JAK-киназ широко используются в практической медицине. Ингибитор JAK-1 и JAK-2 руксолитиниб зарегистрирован для лечения пациентов с эссенциальной тромбоцитемией, первичным миелофиброзом и истинной полицитемией; ингибитор JAK-1 и JAK-2 барицитиниб – только для пациентов с ревматоидным артритом; ингибитор преимущественно JAK-1 и JAK-3 тофацитиниб применяется в лечении ревматоидного и псориатического артритов, а также язвенного колита; селективный ингибитор JAK-1 упадацитиниб предназначен для пациентов с ревматоидным, псориатическим артритами, а также спондилоартритами[14].
Как селективные, так и неселективные ингибиторы JAK инициируют идентичные гематологические феномены: снижение уровня нейтрофилов и лимфоцитов. Однако преимущественное ингибирование активности JAK-2, как в случае с барицитинибом и в меньшей степени упадацитинибом, приводит еще и к снижению эритропоэза, миелопоэза, активации функции тромбоцитов, т.е. тромбоцитозу, что обусловлено влиянием JAK-2 на синтез гемопоэтических цитокинов[15]. Терапия тофацитинибом демонстрировала, напротив, снижение уровня тромбоцитов крови.
Таким образом, выбор тофацитиниба в качестве дальнейшей терапии ревматоидного артрита у данной пациентки представляется перспективным с точки зрения потенциально позитивного влияния на уровень тромбоцитов наряду со специфическим влиянием гидроксикарбамида.
Выводы
Представленный клинический случай демонстрирует важность динамического наблюдения пациентов с ревматоидным артритом и тромбоцитозом, резистентным к терапии у врача-гематолога, для своевременной диагностики миелопролиферативного заболевания. Тромбоцитоз, трактуемый проявлением активности ревматоидного артрита, требует усиления базисной противовоспалительной терапии. В случае наличия у пациента сопутствующей эссенциальной тромбоцитемии данная тактика является необоснованной и требует назначения специфической терапии.
Библиографическая ссылка
Емельянова В.А., Матющенко С.В., Расевич Т.Г., Левченко В.А. СИМПТОМАТИЧЕСКИЙ ТРОМБОЦИТОЗ ИЛИ ЭССЕНЦИАЛЬНАЯ ТРОМБОЦИТЕМИЯ В ПАЛИТРЕ РЕВМАТОИДНОГО АРТРИТА: ГДЕ ГРАНЬ? // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33079 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33079



