Ожирение в настоящее время является одной из самых важных медицинских проблем. Известно, что ожирение – фактор риска развития целого ряда опасных заболеваний, включающих гипертоническую болезнь, ишемическую болезнь сердца, сахарный диабет второго типа, злокачественные новообразования [1, 2]. Роль ожирения в развитии злокачественных опухолей связана с целым рядом метаболических изменений, в частности с повышением уровня глюкозы крови и развитием инсулинорезистентности [3]. Кроме того, активации канцерогенеза при ожирении способствуют повышение уровня жирных кислот в крови, дисбаланс эстрогенов, андрогенов и адипокинов, вялотекущее хроническое воспаление. Важную роль в ряду способствующих канцерогенезу процессов, ассоциированных с ожирением, играет развитие окислительного стресса, связанного с дисбалансом про- и антиоксидантов [2]. Меланома – злокачественное новообразование, заболеваемость которым быстро увеличивается во всем мире [4]. Роль ожирения в патогенезе меланомы до сих пор окончательно не ясна. Тем не менее, существуют данные, что повышение массы тела может способствовать меланомагенезу [5]. Использование стратегии снижения калорийности питания увеличивает продолжительность жизни, снижает риск развития ассоциированных со старением болезней, к числу которых относятся и онкологические заболевания [6].
Таким образом, целью данного исследования является выявление влияния 30%-ного снижения калорийности питания мышей с меланомой В16 на рост опухоли и такие показатели антиоксидантной системы, как активность супероксиддисмутазы и уровень диеновых конъюгатов в ткани опухолевого узла.
Материал и методы исследования
Для исследования воздействия ограничения калорийности питания на рост и развитие опухоли были использованы половозрелые мыши-самки линии С57Bl/6 в возрасте 7–8 недель со средней массой тела 16,5 г. Животные были предоставлены Филиалом НИЦ «Курчатовский институт» ПИЯФ – ПЛЖ «Рапполово». Исследование было одобрено этическим комитетом ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России (протокол № 119 от 07.06.2023 г.). Температура воздуха в помещении поддерживалась на уровне 20–22ºС. Контрольная группа – мыши на базовой диете (питание ad libitum), опытная группа – ограничение калорийности питания на 30% от диеты, удовлетворяющей физиологические потребности животных, исходя из веса животных. Внешние признаки оценивались ежедневно путем балльной оценки изменения окраса шерсти и волосяного покрова. Для кормления животных был использован полнорационный сухой гранулированный корм для содержания лабораторных мышей «ЧАРА» (ООО «Фаворит», Россия). После содержания животных на данных режимах питания в течение 3 месяцев животным экспериментальной группы была произведена трансплантация опухолевых клеток. Для воспроизведения модели меланомы линии B16 мы вводили подкожно в боковую поверхность живота 1x106 суспензии клеток до формирования солидной опухоли в размере 20 мм. Культура клеток меланомы была любезно предоставленаФГБНУ «НИИ фундаментальной и клинической иммунологии». Формирование опухолевого узла происходило в течение 15 суток после имплантации клеток меланомы. На 15-е сутки мы осуществили линейные замеры опухоли в двух взаимно перпендикулярных направлениях. Объем опухоли рассчитывали по формуле: V = (A × (B)2) / 2, где А – больший, а В – меньший линейный размер узла.
Оценку содержания диеновых конъюгатов с учетом молярного коэффициента экстинкции [7] и расчет активности СОД [8] проводили спектрофотометрически на спектрофотометре Genesis 10S UV-VIS, Thermo Fisher Scientific (USA) в гомогенатах опухолевой ткани. Принцип метода определения диеновых конъюгатов основан на том, что вследствие π-π переходов спектры коньюгированных гидроперекисей полиненасыщенных жирных кислот характеризуются интенсивным поглощением в ультрафиолетовой области спектра с максимумом при 232–234 нм. На первом этапе липиды экстрагировали стократным избытком смеси растворителей. В гомогенизатор вносили 0,1 г ткани, добавляли 5 мл изопропилового спирта и тщательно растирали до получения гомогенной суспензии. Содержимое гомогенизатора количественно переносили в мерную центрифужную пробирку, в которую затем добавляли 5 мл гептана. Экстракт центрифугировали в течение 10 мин при 1700g. Надосадочную фракцию переносили в градуированную пробирку и добавляли 1/5 объема раствора KCl для отмывки липидного экстракта от нелипидных примесей. После тщательного встряхивания образовавшаяся эмульсия расслаивалась на две прозрачные фазы. В гептановом экстракте (верхняя фаза) измеряли спектрофотометрически содержание сопряженных диенов в кювете с длиной оптического пути 1,0 см против гептана. Расчет количества ДК производили с учетом молярного коэффициента экстинкции (27000 М-1´см-1) и выражали в молях на 1 г ткани.
Принцип метода определения активности СОД основан на ингибировании реакции аутоокисления адреналина в щелочной среде в присутствии супероксиддисмутазы (СОД) вследствие дисмутации супероксидных анион-радикалов, которые являются продуктом одного из этапов. Об интенсивности аутоокисления адреналина, исходная концентрация которого в пробе составляет 256 мкМ, судят по динамическому нарастанию поглощения при длине волны 347 нм, обусловленному накоплением продукта окисления, не описанного ранее в литературе, и опережающему по времени образование адренохрома, имеющего максимум поглощения при 480 нм. В качестве источника СОД использовали опухолевую ткань. В пробирку вносили 50 мг ткани и 450 мкл дист. Н2О, охлажденной до 0ºС. После этого пробы перемешивали и оставляли при комнатной температуре на 10 минут. Полученную суспензию перемешивали и центрифугировали при 6000g в течение 10 минут. Супернатант использовали для определения активности СОД. После внесения адреналина в контрольную пробу, содержащую бикарбонатный буфер, содержимое кюветы тщательно и быстро перемешивали. Изменение оптической плотности регистрировали через каждые 30 с в течение 3 мин в кювете с толщиной слоя 1,0 см. Измерение проводили против контрольной пробы. Аналогичным образом обрабатывали и опытную пробу. Для расчета активности СОД использовали показатели величины поглощения контрольной и опытной проб. Активность фермента выражали в у.е./мин*г ткани.
Экспериментальные данные обрабатывали с помощью пакета прикладных программ Microsoft Office Excel 2019. Определяли средние значения, доверительный интервал и ошибку среднего. Достоверность различий между выборками оценивали с помощью критерия Манна–Уитни. Значимым считали различие при p<0,05.
Результаты исследования и их обсуждение
При взвешивании мышей контрольной и опытной групп после содержания на режиме снижения калорийности и обычной диете в течение 3 месяцев, перед процедурой перевивки опухолевых клеток мышам опытной группы было установлено, что при содержании животных на режиме ограничения калорийности происходит статистически значимое снижение веса животных опытной группы – в 1,09 раза (рис. 1).
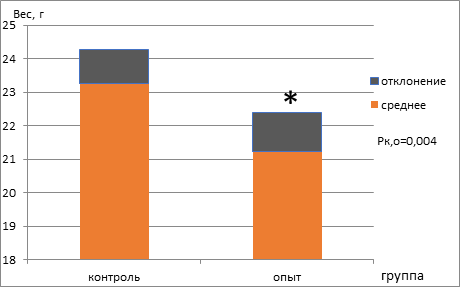
Рис. 1. Вес мышей с экспериментальной меланомой В16, находящихся на базовой диете (контроль) и режиме ограничения калорий (опыт)
При ежедневной оценке внешнего вида и двигательной активности животных контрольной и опытной групп после перевивки опухоли выявлено, что внешний вид животных существенно не изменялся. Шерстяной покров яркий – 2 балла. Тем не менее, двигательная активность мышей, находящихся на режиме ограничения калорийности питания, резко отличалась от активности мышей в группе на базовой диете (питание без ограничений). Животные проявляли высокую двигательную активность как в плане дистанции, так и в плане скорости передвижения и поисковой активности. Таким образом, оценка для группы, находящейся на базовой диете, соответствовала 4 баллам, тогда как для группы на режиме ограничения калорийности балльная оценка соответствовала 5 (табл. 1).
Таблица 1
Внешние признаки – окрас шерсти и волосяного покрова; изменение двигательной активности в группах мышей с экспериментальной меланомой В16, находящихся на базовой диете (контроль) и режиме ограничения калорий (опыт)
|
Внешние признаки |
|||||||||||||||
|
Окрас шерсти и волосяного покрова (баллы) |
|||||||||||||||
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
контроль |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
опыт |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
2 |
|
Изменение двигательной активности (баллы) |
|||||||||||||||
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
контроль |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
4 |
|
опыт |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
После трансплантации меланомы В16 проводили оценку динамики роста опухоли с 7-х суток после трансплантации, осуществляя замеры линейных замеров опухоли и рассчитывая объем опухолевого узла. Установлено, что на 15-е сутки средний показатель объема опухоли в группе мышей с ограниченной калорийностью питания статистически значимо ниже, чем в группе мышей, содержащихся на базовой диете (рис. 2).
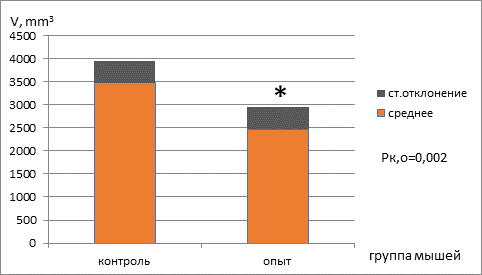
Рис. 2. Объем опухолевого узла (мм3) в группах мышей, находящихся на базовой диете (контроль) и режиме ограничения калорий (опыт)
Далее проводилось определение активности супероксиддисмутазы и содержания диеновых конъюгатов спектрофотометрически. Установлено, что активность супероксиддисмутазы статистически значимо снижалась в 3,5 раза, а содержание диеновых конъюгатов становилось меньше в 3,4 раза (рис. 3, 4).
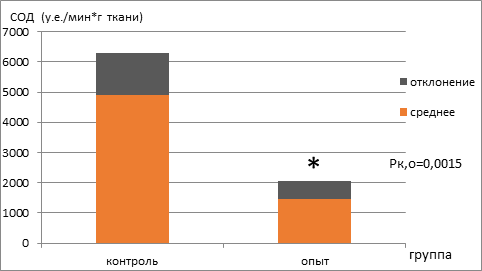
Рис. 3. Активность супероксиддисмутазы (у.е./мин*г ткани) в группах мышей с экспериментальной меланомой В16, находящихся на базовой диете (контроль) и режиме ограничения калорийности (опыт)
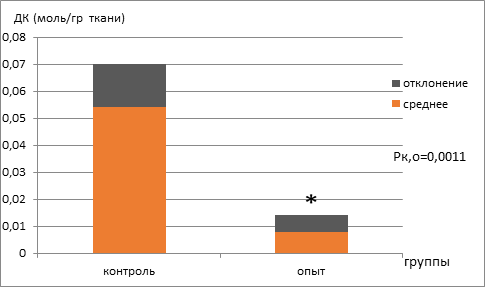
Рис. 4. Концентрация диеновых конъюгатов (моль/г ткани) в группах мышей с экспериментальной меланомой В16, находящихся на базовой диете (контроль) и режиме ограничения калорийности (опыт)
Существуют данные, что ограничение калорийности оказывает влияние на целый ряд клеточных процессов, ассоциированных с пролиферацией опухолевых клеток, изменяя метаболизм белков, жиров и углеводов [9]. Кроме того, множество факторов могут регулировать процессы роста опухолевых клеток, оказывая стимулирующий или блокирующий эффекты. Среди таких факторов, регуляторная активность которых, как предполагают, контролируется, в том числе, изменением калорийности питания, можно назвать и микроРНК. Уменьшение калорийности питания меняет как профиль микроРНК, в частности, снижая экспрессию miR-210, miR-132, miR-29a, miR-34a, miR-132, miR-378, miR-29a-3p, miR-454-3p, miR-20b-5p, miR-210, принимающих участие в активации или блокаде сигнальных каскадов, играющих ключевую роль в регуляции роста опухолевых клеток и других процессов, ассоциированных с канцерогенезом, так и действует непосредственно на сами сигнальные пути, например сигнальный путь mTOR и JAK-STAT, снижая их способствующую росту и прогрессии злокачественной опухоли активность [9]. Так, установлено, что снижение калорийности питания стимулирует сигнальный путь eIF2, что приводит к блокаде синтеза белков и остановке клеточного цикла в фазе G2/М [10].
Повышение продукции свободных радикалов и развитие окислительного стресса в целом ряде работ рассматриваются в качестве факторов, способствующих канцерогенезу. Так, показано, что развитие ассоциированного с гипоксией и гиперпродукцией свободных радикалов стресса эндоплазматического ретикулума приводит к блокаде апоптоза и индукции аутофагии, стимуляции синтеза белков и нуклеиновых кислот, что, в конечном итоге, способствует усилению пролиферации опухолевых клеток и прогрессии злокачественного новообразования [11]. Кроме того, гипоксия и окислительный стресс в клетках меланомы WM793B приводят к повышению экспрессии VEGFA, фактора роста сосудистого эндотелия, играющего важную роль в ключевых процессах канцерогенеза, включающих пролиферацию опухолевых клеток и неоангиогенез [12, 13, 14]. Таким образом, изменение активности факторов антиоксидантной защиты может быть связано с усилением или, наоборот, торможением пролиферационного потенциала опухолевых клеток. В нашей работе мы исследовали изменение активности супероксиддисмутазы и содержание диеновых конъюгатов в ткани опухоли при воздействии снижения калорийности на 30%. Известно, что супероксиддисмутаза – один из ключевых ферментов антиоксидантной системы, принимающий участие в реакции дисмутации супероксидных анион-радикалов. Снижение активности супероксиддисмутазы в контексте нашего исследования может свидетельствовать о снижении уровня окислительного стресса, что подтверждается уменьшением содержания диеновых коньюгатов, продуктов перекисного окисления липидов, отражающих выраженность окислительного стресса.
Заключение
Можно сделать предположение, что ограничение калорийности питания на 30% вызывает установленное нами уменьшение объема опухолевого узла, обусловленное снижением пролиферации опухолевых клеток, что, возможно, связано с активацией внутриклеточных процессов, нарушающих синтез структурных компонентов клетки и блокирующих клеточный цикл, отчасти обусловленных снижением уровня окислительного стресса при голодании.
Библиографическая ссылка
Сергеева Е.Ю., Фефелова Ю.А., Титова Н.М. ОГРАНИЧЕНИЕ КАЛОРИЙНОСТИ ПИТАНИЯ НА 30% У МЫШЕЙ С МЕЛАНОМОЙ В16 ПРИВОДИТ К СНИЖЕНИЮ ОБЪЕМА ОПУХОЛЕВОГО УЗЛА И УМЕНЬШЕНИЮ ВЫРАЖЕННОСТИ ОКИСЛИТЕЛЬНОГО СТРЕССА В ОПУХОЛЕВОЙ ТКАНИ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33041 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33041



