Введение
Извлечение тяжелых цветных металлов из промышленных отходов и вторичных руд осуществляют [6; 8] с применением аммиачных и аммиачно-аммонийных растворов, получая при этом экстракты, содержащие, как правило, тетрааммиакаты цинка и меди. Переработка экстрактов [1; 2] связана с термической отгонкой аммиака и осаждением гидроксидов. На стадиях извлечения металлов и осаждения их из раствора важно знать парциальное давление аммиака и воды для определения количеств аммиака, испаряемых из растворов, отдуваемых при фильтрации, и затрат теплоты для отгонки аммиака.
Цель исследования
Изучить термодинамическое равновесие в системе «вода – растворенные аммиак и хлорид аммония», содержащей аммиакаты цинка и меди в количестве, соответствующем экстрагированию названных металлов из промышленных отходов и вторичных руд, определить энтальпии испарения аммиака, нормальную температуру кипения экстрактов.
Метод исследования
Определение парциального давления аммиака и паров воды над водно-аммиачными растворами, содержащими тетрааммиакаты меди и цинка, проводили динамическим методом [4] в диапазоне температур 293–353 К на установке, описанной нами в литературе и модернизированной с учетом особенностей изучаемой системы (рис. 1).
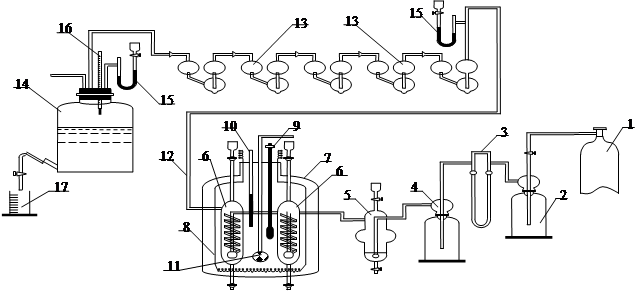
Рис. 1. Схема экспериментальной установки определения парциального давления паров воды и аммиака над растворами тетрааммиакатов.
Азот из баллона 1 через редуктор и регулятор расхода со скоростью 1 л/час пропускали через осушитель с серной кислотой 2, реометр 3, буферную емкость 4 в преднасытитель 5, заполненный исследуемым раствором аммиаката, а затем в два насытителя 6, соединенные последовательно и находящиеся в водяном стеклянном термостате 7, снабженном электронагревателем 8. Объем залитого раствора в преднасытитель 5 и два насытителя 6 обеспечивал постоянство концентрации в процессе опыта. Температуру в термостате регулировали с помощью контактного термометра 9 и контрольного термометра 10 с точностью 0,1 °С. Равномерность нагрева осуществляли перемешиванием воды воздухом, подаваемым воздуходувкой через барботер 11. Азот, насыщенный парами воды и аммиака, по обогреваемой трубке 12 поступал в 5 последовательно соединенных поглотителей 13 (кали-аппараты), заполненных серной кислотой. Азот, освобожденный от аммиака и паров воды, собирали в аспиратор 14, в котором измеряли давление и температуру газа над водой с помощью U-образного манометра 15 и термометра 16. Количество пропущенного азота определяли по объему вытекшей воды в мерном цилиндре 17, массу поглощенных аммиака и воды – по привесу кали-аппаратов 13, количество испарившегося аммиака находили формалиновым методом [10], количество воды – по разности между привесом и количеством испарившегося аммиака.
Для приготовления растворов тетрааммиакатов цинка и меди использовали реактивы квалификации ХЧ: оксид меди (ГОСТ 16539-79*), оксид цинка (ГОСТ 10262-73*), хлорид аммония (ГОСТ 3773-72*).
Парциальное давление аммиака рассчитывали по формуле:
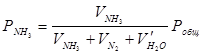 , Па , (1)
, Па , (1)
где ![]() – объем сухого аммиака, поглощенного в ходе опыта, мл;
– объем сухого аммиака, поглощенного в ходе опыта, мл; ![]() – объем пропущенного сухого азота при нормальных условиях, мл;
– объем пропущенного сухого азота при нормальных условиях, мл; ![]() – объем паров воды, уловленной в поглотителях, мл; Pобщ – абсолютное давление в последнем насытительном сосуде, Па.
– объем паров воды, уловленной в поглотителях, мл; Pобщ – абсолютное давление в последнем насытительном сосуде, Па.
Парциальное давление паров воды рассчитывали по формуле:
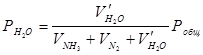 , Па . (2)
, Па . (2)
Для проверки достоверности экспериментальных результатов были определены парциальные давления аммиака и воды над растворами с концентрацией 2,87–13,34 моль/л NH3 в интервале температур 293–343 К. Полученные результаты хорошо согласуются со справочными величинами [5], систематическая ошибка не превышает 0,15%. По этим результатам рассчитаны значения активности воды как отношение парциального давления паров воды над раствором к парциальному давлению паров воды над чистой водой. Для примера: давление паров воды над чистой водой при 293 К составляет 2338,1 Па, над 2,87 и 13,34 моль/л аммиачной водой 2172,0 и 1222,5 Па, активность воды ![]() = 0,93 и 0,52 соответственно.
= 0,93 и 0,52 соответственно.
Результаты исследований
Определение парциальных давлений аммиака и паров воды над растворами с исходной концентрацией аммиака 2,87 моль/л и хлорид-иона 1,13 моль/л NH4Cl проводили при температуре 293 К, меняя концентрацию ионов меди в интервале 0-0,284 моль/л, фоновая изоконцентрация ионов цинка при этом составляла 0,382 моль/л. Выбор концентраций меди и цинка соответствует концентрациям растворов, получаемым при извлечении цветных металлов из промышленных отходов [6; 7]. Результаты исследований приведены на рис. 2, из которого следует, что увеличение массовой концентрации ионов меди в растворе понижает парциальное давление аммиака и воды. Заметное снижение наблюдается при малых концентрациях ионов меди (до 0,016 моль/л), что обусловлено образованием амминов меди, которые более прочно удерживают аммиак в комплексах, чем гидратированная форма NH3(aq).
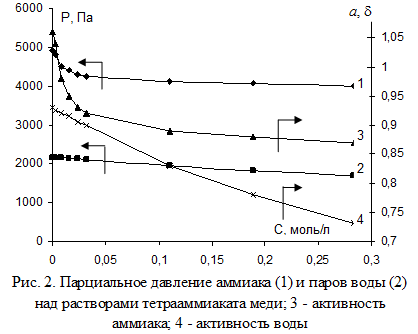
Отмечено, что абсолютное уменьшение парциального давления аммиака больше, чем воды. Понижение активности воды больше, чем снижение отношения парциального давления паров аммиака над раствором аммиаката к давлению паров аммиака над чистой аммиачной водой той же концентрации и температуры (по аналогии с водой назовем эту величину активностью аммиака d). Различен и характер изменения этих величин: для парциального давления и активности воды свойственно уменьшение по линейному закону (Р = -1688Cu2+ + 2157,9, R2 =0,99, α = -0,7212Cu2+ + 0,9238, R2 =0,99), для аммиака – по криволинейному.
Определение влияния концентрации цинка в тетрааммиакатных растворах на парциальное давление аммиака и паров воды проводили при тех же температуре и исходных концентрациях аммиачной воды и хлорида аммония, содержащей 0,016 моль/л аммиаката меди (рис. 3).
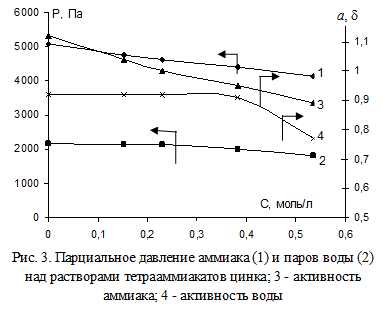
Отмечено, что увеличение концентрации аммиаката цинка в растворе от 0 до 0,535 моль/л вызывает постепенное снижение парциального давления аммиака и его активности. Активность воды заметно уменьшается после концентрации цинка 0,382 моль/л.
Исследовали ход изменения парциального давления аммиака и паров воды от концентрации хлорида аммония, при температуре 293 К над растворами с концентрацией аммиака 2,87 моль/л, в присутствии аммиакатов цинка 0,382 моль/л и меди 0,016 моль/л (рис. 4).
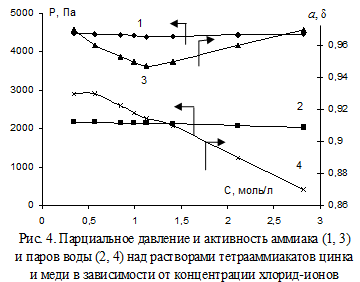
Отмечено, что присутствие хлорида аммония в аммиачной воде, не содержащей цинка, увеличивает парциальное давление аммиака над раствором, при этом активность аммиака становится больше единицы. Повышение парциального давления (∆Р аммиака) над аммиачной водой остаточной концентрации (после образования тетрааммиаката) в присутствии хлорида аммония 1,13 моль/л тем больше, чем больше концентрация растворенного комплексообразователя (табл. 1).
Таблица 1. Превышение парциального давления аммиака над аммиачной водой остаточной концентрации
|
СZn, моль/л |
0,535 |
0,382 |
0,229 |
0,153 |
0 |
|
|
1,80 |
2,11 |
2,41 |
2,56 |
2,87 |
|
|
0,05 |
0,37 |
0,67 |
0,89 |
1,13 |
|
∆Р, Па |
1119,8 |
898,4 |
713,0 |
671,8 |
452,6 |
Зависимость ∆Р от остаточной концентрации аммиака аппроксимируется уравнением прямой линии ∆Р = - 607,93![]() + 2199,7 с величиной достоверности аппроксимации R2=0,993; при этом остаточная концентрация аммиака (моль/л) определяется из выражения:
+ 2199,7 с величиной достоверности аппроксимации R2=0,993; при этом остаточная концентрация аммиака (моль/л) определяется из выражения: ![]() . Следовательно, аминный комплекс в условиях малого остаточного содержания хлорида аммония сам вытесняет растворенный аммиак подобно хлориду аммония.
. Следовательно, аминный комплекс в условиях малого остаточного содержания хлорида аммония сам вытесняет растворенный аммиак подобно хлориду аммония.
Из результатов опытов также следует, что увеличение концентрации хлорид-ионов в растворе вызывает значительное снижение активности воды и экстремально влияет на активность аммиака – минимум наблюдается в области 0,8–1,4 моль/л хлорида аммония, что можно объяснить увеличением буферной емкости раствора и понижением степени диссоциации гидрата аммиака. Рост активности после минимума происходит за счет вытеснения NH3 из раствора, содержащего более 1 моль/л хлорида аммония.
На последнем этапе была изучена зависимость парциального давления аммиака и паров воды от температуры раствора. Исследования проводили в диапазоне температур 293–353 К над раствором 2,87 моль/л аммиака в присутствии аммиакатов цинка 0,382 моль/л, меди 0,016 моль/л и хлорида аммония 1,13 моль/л. Результаты исследований и обработка полученных данных представлены в таблице 2, из которой следует, что повышение температуры вызывает закономерное увеличение парциального давления аммиака и паров воды, значительный прирост начинается с Т = 303 К, причем возрастание парциального давления паров воды интенсивнее, чем аммиака. Температурный коэффициент роста давления аммиака в интервале 333-353 К в среднем составляет 1.2, воды - 1.3. В то же время установлено, что с ростом температуры выше 323 К активность воды в растворе, содержащем комплексное соединение, снижается. Существенно снижают активность воды концентрации аммиака, комплексообразователя и хлорида аммония более 1,409 моль/л в растворе.
Таблица 2. Влияние температуры раствора на парциальное давление паров аммиака и воды
|
Температура, К |
РNH3, Па |
Активность NH3 |
РН2О, Па |
Активность воды |
1/T·103 |
ln РNH3 |
ln РН2О |
|
293 |
4398,3 |
0,95 |
2133,6 |
0,91 |
3,4 |
8,39 |
7,67 |
|
303 |
7143,3 |
0,97 |
3952,1 |
0,93 |
3,3 |
8,87 |
8,28 |
|
313 |
10271,9 |
0,96 |
6640,9 |
0,90 |
3,2 |
9,24 |
8,80 |
|
323 |
16504,4 |
0,98 |
11596,6 |
0,94 |
3,1 |
9,71 |
9,36 |
|
333 |
20433,8 |
0,98 |
18186,7 |
0,91 |
3,0 |
9,92 |
9,81 |
|
343 |
25631,0 |
0,99 |
24131,8 |
0,77 |
2,9 |
10,15 |
10,09 |
|
353 |
29432,1 |
0,99 |
30442,1 |
0,64 |
2,8 |
10,29 |
10,32 |
Одной из причин возрастания парциального давления аммиака над раствором аммиаката является разложение аммиакатов при нагревании. Это подтверждается ростом констант нестойкости тетрааммиакатов от температуры: для Т = 293 К Кн[Zn(NH3)4]2+ = 3,0·10-10; Кн[Cu(NH3)4]2+ =1,0·10-13, при Т=303 К они соответственно равны 3,46·10-10 и 2,14·10-13 [5]. Появление «свободного» аммиака и двойное его гидратирование [3], вероятно, являются причиной снижения активности воды при увеличении температуры раствора комплексообразователей.
В изученном интервале температурная зависимость давления аммиака и паров воды начиная с 303 К хорошо описывается уравнением Клаузиуса:
ln Р = – DНисп / RТ + С, (3)
где С – константа интегрирования; Р – парциальное давление, Па; Т – температура, К; DНисп – теплота парообразования, Дж/моль; R – универсальная газовая постоянная, 8,314 Дж/мольК.
По данным равновесия «жидкая фаза – паровая фаза» были определены энтальпии испарения воды и дифференциальная энтальпия растворения аммиака (численно равная энтальпии испарения) в системе H2O-NH3-NH4Сl, содержащей аммиакаты цинка и меди. Паровая фаза рассматривалась в обычном предположении как смесь идеальных газов. Для сравнения энтальпий испарения из аммиачной воды и из комплексных растворов приведена таблица 3 указанных величин, полученных графическим дифференцированием в интервале температур от 293 до 323 и от 323 до 353 К. Из результатов следует, что при температуре кипения раствора при абсолютном давлении 60 кПа (разряжение 380 мм рт.ст., Т=353 К - технологические условия работы испарителя) при полуторном избытке хлорида аммония на образование тетраамминов энтальпия испарения аммиака в 1,9 раза ниже, чем при 323 К и меньше в 1,1 раза, чем из чистой 5%-ной аммиачной воды при атмосферном давлении..
Таблица 3 - Энтальпии испарения аммиака и воды из растворов
|
Концентрация: аммиак, хлорид аммония, цинк, медь, моль/л |
1,146 - - - |
1,412 - - - |
2,87 - - - |
2,87 1,13 0,382 0,016 |
|
|
33,1 |
33,15 |
34,3 |
34,74 |
|
|
43,67 |
43,8 |
44,02 |
44,88 |
|
|
25,77 |
27,44 |
20,34 |
18,37 |
|
|
39,91 |
39,91 |
34,41 |
24,87 |
Усредненные в интервале температур 293-353 К значения констант интегрирования и теплот испарения аммиака (1) и паров воды (2): С1 = 18,87; DНисп1 = 25,17 кДж/моль; С2 = 111,5; DНисп2 = 33,90 кДж/моль.
Выводы
1. Полученные результаты экспериментальных исследований равновесия пар-жидкость в системе H2O – NH3 – NH4Cl, содержащей аммиакаты цинка и меди, дополняют сведения о физико-химических свойствах сложных тетрааммиакатных систем [9].
2. Установлены закономерности влияния растворенных хлорида аммония и аммиакатов цветных металлов на парциальное давление и активности воды и аммиака в изученной системе.
3. Определены энтальпии испарения и константы интегрирования уравнения Клаузиуса в области температур 293–303 и 323–353 К. По усредненным значениям энтальпии и константы интегрирования найдена нормальная температура кипения и выбрано абсолютное давление для отгонки аммиака.
4. Результаты необходимы в расчетах аппаратуры на стадии извлечения, фильтрации растворов и отгонки аммиака для выделения оксидов меди и цинка из экстрактов.
Рецензенты:
Когтев Сергей Евгеньевич, доктор технических наук, профессор, директор по развитию производства, ООО «Синтез ПКЖ», г. Дзержинск.
Сидягин Андрей Ананьевич, доктор технических наук, профессор, профессор кафедры «Машины и аппараты химических и пищевых производств», Дзержинский политехнический институт (филиал) Нижегородского государственного технического университета им. Р.Е. Алексеева, г. Дзержинск.
Библиографическая ссылка
Перетрутов А.А., Чубенко М.Н., Ким П.П., Ксандров Н.В., Гагарина Т.Б. РАВНОВЕСИЕ ПАР-ЖИДКОСТЬ В СИСТЕМЕ H2O-NH3-NH4CL, СОДЕРЖАЩЕЙ АММИАКАТЫ ЦИНКА И МЕДИ // Современные проблемы науки и образования. 2013. № 2. ;URL: https://science-education.ru/ru/article/view?id=9139 (дата обращения: 07.03.2026).



