Введение
Атрофические рубцы представляют собой дефекты кожного покрова, которые визуально характеризуются наличием углублений на коже и образуются вследствие нарушения репаративного ремоделирования дермы [1]. Современные данные указывают, что, в отличие от келоидных и гипертрофических рубцов, при формировании атрофических рубцовых дефектов над анаболическими процессами преобладают катаболические, что проявляется в виде снижения неоколлагенеза, а также истончения коллагеновых и эластиновых волокон [2]. Образованию атрофических рубцовых дефектов также способствуют чрезмерное разрушение коллагена протеолитическими ферментами (матриксными металлопротеиназами (MPP)), снижение концентрации их тканевых ингибиторов [3, 4] и повышение экспрессии провоспалительного транскрипционного ядерного фактора каппаВ (NF-κB). Кроме того, отмечают усиление выработки провоспалительных цитокинов, подавление пролиферации клеток и разрушение внеклеточных структур [5].
Наиболее частые причины образования рубцов включают акне[6], при котором в 95% случаев данные изменения относятся к атрофическому типу[7]. Это, по всей видимости, связано с длительностью и интенсивностью воспаления при данном заболевании. Несколько реже атрофические рубцы наблюдают после ветряной оспы, лейшманиоза, хирургических вмешательств и травм[8]. Что касается лица, то, согласно данным исследования, включавшего 428пациентов, атрофические рубцы в этой области составляют 42,8% всех рубцовых дефектов. При этом чаще всего рубцы атрофического типа в области лица образуются после различных дерматологических заболеваний за исключением акне (88,0%), после акне (61,3%), хирургических манипуляций (28,1%) и травм (47,9%) [9].
Атрофические рубцы не представляют собой прямой угрозы физическому здоровью, однако их наличие, особенно на открытых участках тела и лице, может стать причиной ухудшения качества жизни и эмоционального состояния вплоть до развития депрессии, снижения самооценки, появления чувства неловкости и стыда, а также нарушений в социальной и трудовой сферах пациента [10, 11]. Несмотря на это, унифицированные рекомендации и стандартизированные схемы лечения атрофических рубцов, обеспечивающие их полное устранение, в настоящее время отсутствуют как в западной, так и в отечественной практике [12], а выбор эффективной тактики лечения часто остается спорным ввиду недостатка надежных доказательных данных. Тем не менее доступные сегодня методы позволяют снизить выраженность атрофических рубцов, сгладить рельеф кожи и добиться эстетически благоприятных результатов.
К высокоэффективным методам коррекции атрофических рубцов относят радиочастотную(РЧ) терапию, которая заключается в воздействии на кожу радиочастотным электрическим током, что позволяет достигать местного нагревания дермы и за счет этого усиливать ее ремоделирование и стимулировать неоколлагенез и неоэластиногенез [13, 14]. В исследовании при проведении курса РЧ-терапии из 3‒4процедур фиксировали уменьшение выраженности атрофических рубцов на 25‒75% [15]. Повышению эффективности такой терапии способствует сочетание радиочастотного воздействия с микронидлингом [16]. Использование микроигл обеспечивает контролируемую, точечную доставку энергии в различные слои кожи, в том числе более глубокие, что приводит к появлению в них термических микроповреждений с последующей активацией фибробластов, повышением синтеза коллагена и других компонентов внеклеточного матрикса [14]. Кроме того, изолирование игл друг от друга и проведение энергии исключительно в структуры, которые прилегают к концу игл, обеспечивает снижение риска нецелевого воздействия и сокращение сроков восстановления кожи [17].
Еще одним методом устранения атрофических рубцовых дефектов является субцизия, эффективность которой в настоящее время считают довольно высокой [18, 19]. Техника ее выполнения заключается в следующем: под рубцовое изменение вводят иглу и с ее помощью рассекают фиброзные тяжи, которые скрепляют дерму с подлежащими структурами. Это приводит к стимуляции естественных процессов регенерации и формированию ткани denovo, что позволяет приподнять рубец и устранить углубление на коже. Субцизия обеспечивает снижение выраженности атрофических рубцов в среднем на 50–70% в зависимости от применяемой техники и дополнительных методов [18, 19]. Для повышения эффективности субцизию можно комбинировать с введением под атрофический рубец инъекционного имплантата на основе гиалуроновой кислоты(ГК) [20, 21]. Помимо чисто механического заполнения пространства, формируемого при субцизии, такой подход позволяет стимулировать синтез коллагена, других белковых структур и, следовательно, усилить эффект сглаживания поверхности кожи.
Клиническая эффективность применения дермальных филлеров на основе ГК в лечении атрофических рубцов доказана в различных научных исследованиях. Например, в своей работе A.Sparavigna и соавт. установили, что через 4месяца после двух инъекционных процедур происходит уменьшение глубины атрофических рубцов на 20% (p<0,0001) и их выраженности на 31% (p<0,0001) при оценке по шкале Гудмана– Барона [22]. В другом исследовании при коррекции атрофических рубцов различного генеза в области лица путем введения дермального филлера на основе ГК улучшение и выраженное улучшение было отмечено в 74% случаев [8]. В недавней статье О.М.Капулер и соавт. также приводят клинические примеры высокоэффективной коррекции атрофических рубцов дермальными филлерами линейки MiraLine (Feel Korea, Южная Корея) [23]. Данные филлеры в своем составе имеют высокомолекулярную ГК неживотного происхождения и изготовлены с применением технологии МСОтм (англ. Minimising Cross-Linking Agent by Optimising Reaction), которая позволяет создавать препараты с заданными реологическими свойствами и высокой стабильностью. В другой работе О.М.Капулер и соавт. установили хорошую биосовместимость филлеров линейки MiraLine и их полную элиминацию после введения гиалуронидазы (через 2–5мин). Данные ультразвукового исследования (УЗИ), которое выполняли через 3–4недели после введения филлера, свидетельствовали об отсутствии воспалительного процесса, фиброзирования и об эффективной интеграции материала в окружающие ткани [24].
Результаты рандомизированных клинических исследований и исследований типа split-face указывают, что комбинированные подходы к лечению атрофических рубцов по эффективности превосходят тактику, основанную на применении одной методики,– как с точки зрения снижения выраженности рубцовых дефектов, так и по степени удовлетворенности пациентов результатами коррекции [20, 25].
Для повышения эффективности и безопасности коррекции атрофических рубцов, а также для контроля результатов лечения можно прибегать к УЗИ высокого разрешения [24]. Данная неинвазивная процедура позволяет объективно измерять толщину дермы и ее слоев, глубину залегания рубца, его эхогенность и наличие фиброзных тяжей, визуализировать сосуды и точно определять плоскость воздействия, в том числе введения дермального филлера [26]. Имеются данные о варьировании определяемой при УЗИ толщины дермы в зависимости от возраста и зоны лица, что важно учитывать при планировании коррекции и оценке ее результатов [27]. Таким образом, УЗИ представляется важной частью плана коррекции атрофических рубцов, поскольку позволяет точно и объективно оценить состояние кожных структур, обеспечить индивидуальность подхода, минимизировать риски и объективно изучить изменения.
Цель исследования – изучение эффективности и безопасности радиочастотной обработки атрофических рубцовых дефектов в комбинации с субцизией и инъекцией дермального филлера на основе стабилизированной ГК по сравнению только с радиочастотной терапией.
Материал и методы исследования
Одноцентровое проспективное рандомизированное сравнительное исследование эффективности и безопасности комбинированного лечения атрофических рубцов проводили на кафедре дерматовенерологии и косметологии Академии постдипломного образования ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий Федерального медико-биологического агентства России» (Москва) в период с 2023 по 2024г.
В исследовании приняли участие 84пациента женского (n = 60; 72%) и мужского пола (n = 23; 28%) в возрасте 20–58 лет с клиническим диагнозом атрофических рубцов, расположенных в зоне лица, которые возникли после акне (61,9% случаев), ветряной оспы (20,2%) и хирургических манипуляций (17,9%). Из исследования исключали пациентов с противопоказаниями к радиочастотному воздействию, с наличием онкологических, воспалительных, инфекционных и психических заболеваний, в том числе алкогольной или наркотической зависимости, кожных заболеваний в фазе обострения и множественных новообразований в предполагаемой области обработки (папиллом, невусов и др.). Кроме того, к исследованию не допускали беременных и кормящих грудью женщин, пациентов с небиодеградируемыми филлерами и имплантатами в предполагаемой области обработки, а также при планировании хирургических или стоматологических вмешательств на период исследования. Все пациенты, включенные в исследование, предоставили письменное информированное согласие и участвовали в исследовании добровольно.
Включенных в исследование пациентов в порядке рандомизации (в соотношении 1:1) распределили в две группы. Пациенты группы1 проходили 3процедуры РЧ-терапии атрофических рубцов с интервалом в 3недели, тогда как пациентам группы2 в дополнение к трем указанным процедурам проводили субцизию и инъекционное введение дермального филлера на основе ГК через 3недели после завершения РЧ-терапии. Радиочастотное воздействие выполняли игольчатым электродом с 25изолированными микроиглами с позолотой (режим: RF+ microneedle 25pin; количество проходов в области обработки– 2; мощность – 6Вт при первом проходе и 4Вт при втором проходе; глубина проникновения микроигл – 1,5мм при первом проходе и 0,8мм при втором проходе). Для субцизии использовали иглу размера21G. В качестве инъекционного имплантата применяли дермальный филлер MiraLineFine, 24мг/мл (Feel Korea, Южная Корея), содержащий стабилизированную ГК. Общий объем введенного филлера составил 0,5–1мл. Перед радиочастотным воздействием и субцизией проводили обработку лица дезинфицирующим средством; аппликационную анестезию не применяли.
До начала лечения осуществляли сбор анамнеза и объективное обследование, в том числе определение текстуры и глубины рубцовых дефектов; фотографирование в стандартизированных условиях; оценку выраженности рубцовых изменений по шкале Гудмана– Барона [28]; оценку удовлетворенности пациента внешним видом лица по шкале FACE-Q [29] от плюс 3баллов («очень удовлетворен») до минус 3баллов («очень неудовлетворен»); УЗИ в B-режиме на глубине 5‒20мм для выяснения таких характеристик рубцов, как их толщина и глубина расположения, а также для установления толщины нормальной кожи, прилегающей к рубцу (аппарат LOGIQe®; GEHealthCare, США). Кроме того, выполнено 3D-сканирование на аппарате Antera3D® (Miravex Limited, Ирландия) для объективного описания рельефа кожи в зоне рубцовых изменений.
Для оценки эффективности коррекции через 2‒3недели после завершения полного курса лечения проводили повторное фотографирование и трехмерное сканирование на аппарате Antera3D®, оценку по шкале выраженности рубцовых изменений (Гудмана– Барона) и шкале FACE-Q, УЗИ в B-режиме и оценку общего эстетического улучшения по шкале GAIS (англ. Global Aesthetic Improvement Scale) по мнению врача (англ. Physician GAIS, PGAIS) и пациента (англ. Subject GAIS, SGAIS) [30] от плюс 3баллов («выраженное улучшение») до минус 3баллов («выраженное ухудшение»). Кроме того, по завершении лечения выполняли трехмерную стандартизированную оценку состояния кожи с использованием системы VISIA [31]. Для оценки были приняты следующие значения: 0‒25%– неудовлетворительно, 26‒50%– удовлетворительно с умеренным улучшением, 51‒75%– удовлетворительно с заметным улучшением, 76‒100%– почти полное или полное устранение рубцовых дефектов с высокой удовлетворенностью пациента.
Для оценки безопасности в течение всего периода исследования регистрировали нежелательные явления (НЯ) как по сообщениям пациентов, так и проактивно во время осмотра области обработки врачом. Интенсивность боли во время процедур измеряли с помощью 10-балльной визуальной аналоговой шкалы (ВАШ) [32], а выраженность эритемы и отека– по 5-балльной шкале.
Статистический анализ: принятый уровень значимостиα для двусторонних доверительных интервалов (ДИ) и при тестировании статистических гипотез составлял 5%; статистическую значимость различий подтверждали при р<0,05. Соответствие интервальных данных закону о нормальном распределении устанавливали при помощи критериев Шапиро– Уилка и Холмогорова– Смирнова. Ввиду того, что распределение данных не соответствовало нормальному, описательные статистические показатели представлены в виде медианы (Me) и межквартильного интервала (IQR). Для проверки гипотез прибегали к различным непараметрическим методам в зависимости от изучаемого показателя. Статистический анализ выполняли с использованием компьютерных программ STATISTICA и AtteStat.
Результаты исследования и их обсуждение
На исходном уровне две группы пациентов статистически значимо не различались по большинству клинических характеристик и по всем оцениваемым показателям (p>0,05; таблица).
Показатели в группах исследования до начала лечения
|
Характеристика |
Группа 1 (n=42) |
Группа 2 (n=42) |
р |
|
Возраст, лет; Ме (IQR) |
39 (35,5–43,5) |
37 (33,0–40,0) |
0,053U |
|
Пол, n (%): |
|
|
|
|
мужской |
11 (26%) |
12 (29%) |
0,807χ² |
|
женский |
31 (74%) |
30 (71 %) |
|
|
Состояние дермы в области рубцов |
|||
|
Толщина неизмененной дермы по результатам УЗИ, мм; Ме (IQR) |
2,0 (1,8–2,3) |
1,9 (1,8–2,1) |
0,176U |
|
Толщина дермы в проекции рубца по результатам УЗИ, мм; Ме (IQR) |
1,7 (1,6–1,9) |
1,6 (1,4–1,7) |
0,054U |
|
Оценка по клиническим шкалам |
|||
|
Оценка выраженности рубцов по шкале Гудмана – Барона, баллы; Ме (IQR) |
3 (2–3) |
3 (2–4) |
0,056U |
|
Удовлетворенность внешним видом лица по шкале FACE-Q, n (%) |
40 (95%) |
39 (93%) |
> 0,999φ |
Примечание: Ме– медиана; IQR– межквартильный размах, УЗИ– ультразвуковое исследование. Значениер согласно: U – критерию Манна – Уитни; φ– точному критерию Фишера.
Составлена авторами на основе данных, полученных в ходе исследования.
После полного курса лечения увеличение толщины дермы в проекции рубца было выявлено у 90% пациентов из группы2, прошедшей РЧ-терапию, субцизию и введение дермального филлера на основе ГК, по сравнению с 67% у пациентов из группы1, которая получила только РЧ-терапию (рис.1).
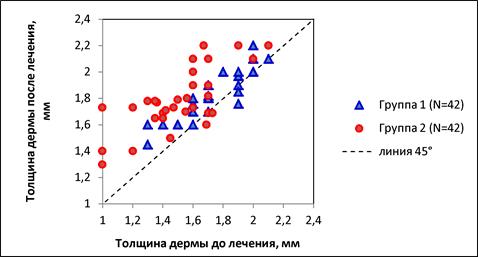
Рис.1. Изменение толщины дермы в проекции рубца в группах исследования. Положение точки выше пунктирной линии указывает на увеличение значения, ниже пунктирной линии– на уменьшение значения, на пунктирной линии– на отсутствие изменения значения
Примечание: составлен авторами на основании собственных данных
В проекции рубца толщина дермы по завершении лечения составила 1,8мм как в группе1, так и в группе2, и статистически значимое различие по данному показателю отсутствовало (р = 0,431). Однако величина прироста толщины дермы в сравнении с исходными значениями в группе2 (+18,8%) была в 3,5раза выше, чем в группе1 (+5,3%), а различие между группами по величине прироста было статистически значимым (p<0,001). Это свидетельствует о гораздо более высокой эффективности комбинированного лечения по данному показателю.
До начала лечения выраженность атрофических рубцов по шкале Гудмана– Барона была в 65% случаях от умеренной до тяжелой (3–4балла), а в 35% случаев– макулярной или слабой (1–2балла). По завершении полного курса лечения оценки по шкале Гудмана– Барона между группами исследования статистически значимо не различались (р = 0,084). Тем не менее динамика изменения данных оценок достигла статистической значимости в обеих группах (р<0,05) и указывала на более высокую эффективность комбинированного лечения, поскольку в группе1, получавшей только РЧ-терапию, снижение балла по шкале Гудмана– Барона составило 10,0%, а в группе2, получавшей комбинированную терапию, – 30,8%, то есть было в 3,1раза выше. Кроме того, у 7,5% пациентов из группы1 оценка по шкале Гудмана– Барона не изменилась, при этом в группе2 таких пациентов не было (рис.2).
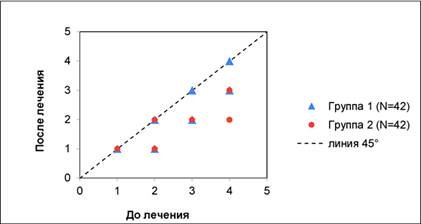
Рис.2. Изменение выраженности атрофических рубцов по шкале Гудмана– Барона в группах исследования
Примечание: составлен авторами на основании собственных данных
До начала лечения в подавляющем большинстве случаев (94%) участники были неудовлетворены внешним видом лица. По завершении полного курса лечения улучшение оценки по шкале FACE-Q и, соответственно, повышение удовлетворенности внешним видом лица выявлено в обеих группах исследования (рис.3 и 4). Динамика изменения оценки по данной шкале была статистически значимой (р<0,05) как в группе1, так и в группе2.
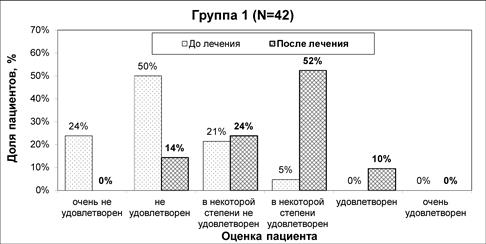
Рис.3. Изменение оценки удовлетворенности пациентов внешним видом лица по шкале FACE-Q (группа1)
Примечание: составлен авторами на основании собственных данных
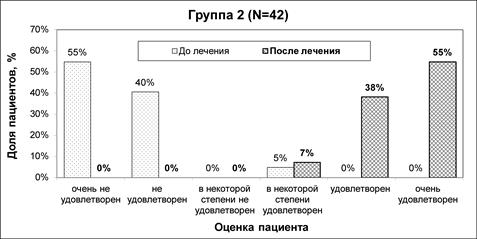
Рис.4. Изменение оценки удовлетворенности пациентов внешним видом лица по шкале FACE-Q (группа2)
Примечание: составлен авторами на основании собственных данных
После лечения различие оценок по шкале FACE-Q между группами исследования достигло статистической значимости (р<0,001). Несмотря на то, что 62% пациентов в группе1 указали на некоторую степень удовлетворенности результатами коррекции, были и те (38%), кто остался в определенной мере неудовлетворен лечением. При этом в группе2 результатами коррекции были удовлетворены все пациенты, в том числе «очень удовлетворены» (55%) и «удовлетворены» (38%).
Согласно оценке общего эстетического улучшения по мнению пациента (SGAIS), комбинированное лечение превосходило применение только РЧ-терапии: «выраженное улучшение» отметила большая часть пациентов в группе2 (71%); в группе1 об «улучшении» сообщили 67% пациентов, а об отсутствии изменений– 33% пациентов (рис.5). При оценке общего эстетического улучшения по мнению врача (PGAIS) «выраженное улучшение» отмечено также у 71% участников из группы2 (рис.6), что свидетельствует о более высокой эффективности комбинированного подхода.
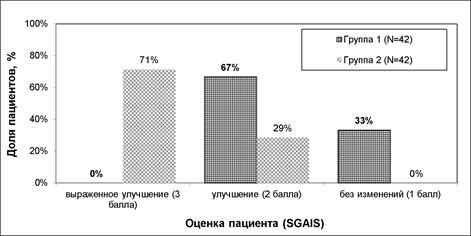
Рис.5. Общее эстетическое улучшение по мнению пациента (SGAIS) в динамике
Примечание: составлен авторами на основании собственных данных
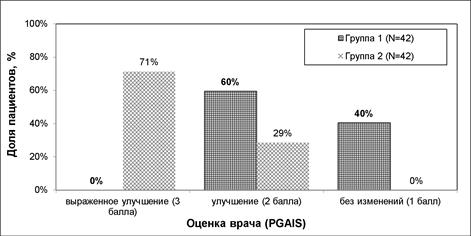
Рис. 6. Общее эстетическое улучшение по мнению врача (PGAIS) в динамике
Примечание: составлен авторами на основании собственных данных
При оценке общего эстетического улучшения по мнению врача (PGAIS) и пациента (SGAIS) между группами1 и2 было установлено статистически значимое различие (р<0,001), при этом согласованность оценок по мнению врача и пациента была высокой.
По результатам трехмерного сканирования микрорельефа кожи в области поражений и измерения объема углублений на аппарате Antera3D® была подтверждена более высокая эффективность комбинированного лечения. В группе2 выявлено более выраженное уменьшение шероховатости кожи (в 2,5раза), глубины (в 1,9раза) и ширины (в 1,8раза) рубцовых дефектов, а также улучшение текстуры кожи (в 2,1раза) и сглаживание морщин (в 2раза) (рис. 7). Клинический пример и образец визуализации на аппарате Antera3D® представлены на рис.8.
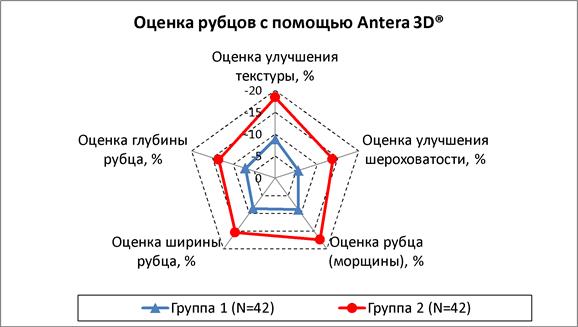
Рис.7. Процентное изменение показателей выраженности рубцовых дефектов (Me)
Примечание: составлен авторами на основании собственных данных
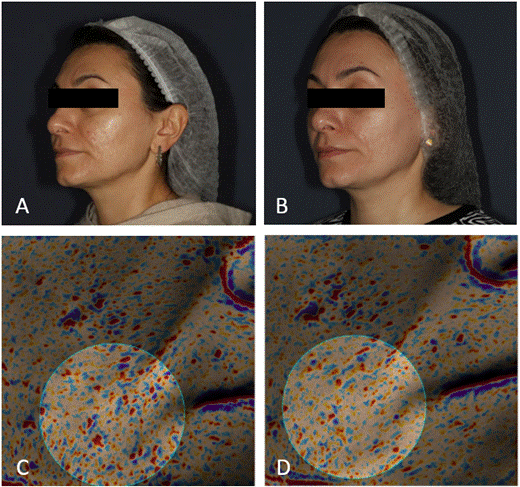
Рис.8. Атрофические рубцы, возникшие после акне. Фотография A)до лечения и B)после лечения (пациентка 39лет, группа2). Визуализация рубца на аппарате Antera3D® C)до лечения и D)после лечения
Примечание: составлен авторами на основании собственных данных
При оценке с использованием системы VISIA выявлено преимущество комбинированного лечения: если брать всех пациентов, то в группе1 улучшение было на 10–50%, а в группе2 – на 26–75% (рис.9).
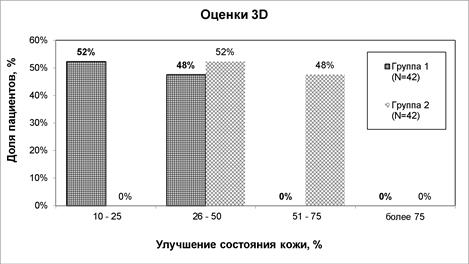
Рис.9. Распределение пациентов с учетом категорий системы VISIA
Примечание: составлен авторами на основании собственных данных
Различие оценок, полученных с использованием системы VISIA, между группами исследования достигло статистической значимости (р<0,001), при этом в группе комбинированного лечения у 48% пациентов отмечено улучшение на 51–75%. Пациентов с такой степенью улучшения в группе применения только РЧ-терапии не было.
Развития серьезных нежелательных явлений в период исследования не зарегистрировано. По выраженности эритемы, отека и кровоизлияния группы исследования статистически значимо различались (р<0,05), причем преимущество было у группы комбинированного лечения. Интенсивность боли в группах исследования значимо не различалась (p>0,05).
Таким образом, по совокупности показателей эффективности можно сделать вывод о превосходстве комбинированного лечения, включающего радиочастотную обработку, субцизию и введение дермального филлера на основе ГК, над проведением только РЧ-терапии, при сопоставимости профиля безопасности обоих подходов.
Полученные в настоящем исследовании результаты подтверждают более высокую эффективность комбинированного подхода к лечению атрофических рубцов, который включает РЧ-терапию, субцизию и инъекционное введение дермального филлера на основе ГК, по сравнению с применением только РЧ-терапии. Согласно объективной оценке, выполненной в рамках УЗИ, комбинированное лечение обеспечило усиленные синтез компонентов внеклеточного матрикса и стимуляцию регенеративных процессов в коже и за счет этого– увеличение толщины дермы в проекции рубца практически у всех участников (90%). Кроме того, после комбинированного лечения наблюдали более выраженное снижение степени тяжести атрофических рубцовых дефектов по шкале Гудмана– Барона, более чем трехкратно превосходящее результат в группе применения только РЧ-терапии.
Отдельное внимание следует уделить результатам трехмерного сканирования микрорельефа кожи с помощью аппарата для 3D-визуализации и диагностики кожи. Этот инновационный метод обеспечивает высокую воспроизводимость результатов и в последнее время занял прочное место в арсенале практикующих врачей. В настоящем исследовании сканирование с помощью 3D-аппарата позволило установить более высокую эффективность комбинированного лечения по всем изученным показателям, в том числе более выраженное снижение шероховатости кожи, улучшение текстуры, сглаживание морщин и уменьшение глубины и ширины рубцовых изменений (пример визуализации – рис.8). Кроме того, превосходство комбинированного подхода подтвердили результаты объективной оценки состояния кожи с использованием системы VISIA.
Итоги субъективной оценки визуального эффекта лечения подтвердили результаты объективной оценки. Так, по шкале FACE-Q оценка удовлетворенности пациента внешним видом лица после лечения в группах исследования статистически значимо различалась в пользу комбинированного подхода (р<0,001), результатами применения которого остались довольны практически все участники соответствующей группы. Результаты определения общего эстетического улучшения по мнению врача (PGAIS) и пациента (SGAIS) в группах исследования также статистически значимо различались в пользу комбинированной терапии (р<0,001), при этом в группе применения только РЧ-терапии были такие пациенты, у которых после прохождения лечения какие-либо изменения отсутствовали (40% при оценке по шкале PGAIS и 33% при оценке по шкале SGAIS). Кроме того, у комбинированного лечения был установлен более благоприятный профиль безопасности.
Заключение
Радиочастотная обработка в сочетании с рассечением фиброзных тяжей путем субцизии и механическим поднятием рубца за счет введения имплантата на основе ГК позволяет улучшить как объективные, так и субъективные результаты коррекции атрофических рубцовых дефектов, причем безопасность при комбинировании этих методов сопоставима с таковой при проведении только РЧ-терапии. Комбинированная терапия позволяет более эффективно улучшать текстуру и рельеф поверхности кожи, уменьшать выраженность рубцовых изменений и обеспечивает высокую удовлетворенность пациентов результатами коррекции. В связи с этим данный подход можно рекомендовать к применению в клинической практике при работе с пациентами, обратившимися с целью коррекции атрофических рубцов, в частности в области лица.
Конфликт интересов
Финансирование
Библиографическая ссылка
Акопян И.Х., Мураков С.В., Васильев С.В. КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ АТРОФИЧЕСКИХ РУБЦОВ РАДИОЧАСТОТНЫМ ВОЗДЕЙСТВИЕМ В КОМБИНАЦИИ С СУБЦИЗИЕЙ И ПОСЛЕДУЮЩИМ ВВЕДЕНИЕМ ИНЪЕКЦИОННОГО ИМПЛАНТАТА НА ОСНОВЕ ГЕЛЯ СТАБИЛИЗИРОВАННОЙ ГИАЛУРОНОВОЙ КИСЛОТЫ // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34423 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34423



