Введение
В связи с неблагоприятной демографической ситуацией есть необходимость сохранения жизни каждого живорожденного ребенка. Паспорт национального проекта «Здравоохранение», сформированный во исполнение Указа Президента Российской Федерации, установил его целевым индикатором качества медицинской помощи в сфере охраны материнства и детства, поэтому тщательный анализ случаев младенческой смертности играет важную роль в дальнейшем ее снижении. Случай врожденного цирроза печени у ребенка с экстремально низкой массой тела, по нашему мнению, заслуживает особого внимания, поскольку на современном этапе отмечается рост оппортунистических инфекций.
Цирроз печени характеризуется разрастанием соединительной ткани и трансформацией органа с образованием структурно-аномальных узлов-регенератов [1]. В вопросе этиологии врожденного цирроза нет единого мнения, но можно привести следующие возможные причины развития врожденного цирроза печени: инфекционные внутриутробные гепатиты в связи с поражением печени в антенатальном периоде (фетальный гепатит). Установлено, что в структуре вирусных циррозов печени у детей превалирует смешанная этиология [2]. Невыявленные метаболические нарушения: болезнь Коновалова – Вильсона (гепатолентикулярная дегенерация), гемохроматоз, тирозиноз, галактоземия, гликогенозы, дефицит альфа1-антитрипсина); аномалии развития желчевыводящих путей: вторичный билиарный цирроз, атрезия желчевыводящих путей и прочие аномалии [3].
Цель исследования – представление и анализ клинического примера новорожденной девочки с экстремально низкой массой тела, рожденной путем кесарева сечения, с очень тяжелым состоянием при рождении (за счет дыхательной недостаточности, острой сердечно-сосудистой недостаточности, угнетения центральной нервной системы).
Материал и методы исследования
Проведен анализ медицинской карты стационарного больного и протокола патологоанатомического исследования.
Результаты исследования и их обсуждение
Новорожденная девочка, вес при рождении 970 г, в анамнезе у матери одна операция кесарева сечения в 2014 г. по поводу заднего асинклитизма (без осложнений). Во время настоящей беременности на сроке 16 недель был токсикоз, на сроке 10 недель был выделен Esherichia coli 10/5 в моче. По данному поводу получала цефтриаксон. На ранних сроках находилась на стационарном лечении по поводу угрожающего аборта (гематома). В 19–20 недель перенесла ротавирусную инфекцию, в 24 недели впервые диагностировано абсолютное маловодие. Направлена на госпитализацию в ГБУЗ РМ МРЦКБ, где было проведено комплексное обследование, в анализе крови на ВУИ методом ИФА выявлены высокоавидные антитела G к цитомегаловирусу. При имеющихся у женщины осложнениях гестации (плацентарные нарушения, задержка роста плода, абсолютное маловодие, по данным допплерографии – нарушение ППК с нулевым диастолическим компонентом, реверсивный кровоток в венозном протоке, по данным КТГ – сомнительный тип, при проведенной в полном объеме профилактике РДС плода на сроке 24–25 недель 05.06.24 было показано экстренное родоразрешение путем операции кесарева сечения. Беременность 29/3 недель. Роды 09.07.2024, 10:24, в МРЦКБ г. Саранска. Пол женский, вес 970 г, рост 40 см, окружность головы 25 см, окружность грудной клетки 23 см. Оценка по шкале Апгар 4/6/7 баллов, по Сильверману 10 баллов, по Баллард 14 баллов. Состояние при рождении тяжелое за счет ДН, ОССН, угнетения ЦНС. Родилась в состоянии асфиксии средней степени тяжести. SpO2 48%. После рождения не кричит, не дышит. На 1-й минуте проведена интубация трахеи. На 5-й минуте дыхание ослабленное, крепитирующие хрипы. ЧСС 150 в мин. SpO2 75%. На 10-й минуте продолжается аппаратная ИВЛ. Введен Куросурф эндотрахеально болюсно в дозе 200 мг/кг. Кожные покровы бледно-розовые. ЧСС – 188–196 уд/мин. Дыхание проводится по всем легочным полям, равномерно ослаблено, влажные хрипы с обеих сторон. SpO2 – 92%. В динамике состояние нестабильное, прогрессивно ухудшающееся за счет полиорганной недостаточности: нарастания дыхательной недостаточности, сердечно-сосудистой недостаточности, острого почечного повреждения, продолжающегося геморрагического синдрома, печеночной недостаточности. Отмечаются частые эпизоды десатурации до 60% с последующим медленным восстановлением до 75%.
Были проведены лабораторные и инструментальные исследования, по их результатам отмечалось повышение щелочной фосфатазы, креатинина крови, повышение билирубина, в том числе прямой фракции до 32 мкмоль/л, гипоальбуминемия. В общем анализе крови: анемия тяжелой степени при рождении. По результатам КОС выявлен метаболический ацидоз, переходящий в декомпенсированный метаболический и респираторный ацидоз. На ЭХО-КГ: персистирование фетальных коммуникаций (открытый артериальный проток). На нейросонографии – отек, в лобных долях субэпендимальное кровоизлияние с обеих сторон. На УЗИ брюшной полости были выявлены признаки незначительного количества свободной жидкости в брюшной полости, расширения собственных вен печени, расширения левой долевой ветви воротной вены, увеличенного, деформированного желчного пузыря, повышения эхогенности паренхимы почек. Заключительный клинический диагноз: Тяжелое нетравматическое геморрагическое поражение ЦНС: ВЖК 2 степени с обеих сторон. Подоболочечное кровоизлияние в проекции левого полушария и ЗЧЯ. Очаговые изменения паренхимы мозга геморрагического характера в проекции левого полушария – лобной, теменной, затылочной долей. Кровоизлияние в полушарие и червь мозжечка. Болезнь печени, неуточненного генеза.
Терапевтическое ведение пациентов с циррозом печени и острой хронической печеночной недостаточностью основано на поддержке различных органных функций [4].В лечении данного ребенка были использованы: антибактериальная терапия; инфузионная терапия; гемостатическая терапия; с целью коррекции гемодинамических нарушений после перенесенной асфиксии при рождении назначен добутамин + эпинефрин 0,1% + допамин 0,5%, дексаметазон; трансфузии отмытых эритроцитов, свежезамороженной плазмы, криопреципитат, трансфузия тромбоконцентрата; с целью коррекции метаболического ацидоза натрия гидрокарбонат 4%; с целью профилактики развития бронхолегочной дисплазии – кофеина цитрат. Поскольку прижизненно у ребенка не был выявлен врожденный цирроз печени, терапия по данной нозологии не проводилась.
13.07.2024 за счет прогрессивного нарастания полиорганной недостаточности, геморрагического синдрома, шока смешанной этиологии – состояние терминальное. В 09.00 произошла остановка сердечной деятельности. Трехкратное введение эпинефрина 0,1 мл/кг с интервалом в 5 мин, непрямой массаж сердца успеха не имели. В 09:30 была констатирована биологическая смерть. Труп ребенка был отправлен на патологоанатомическое вскрытие с основным диагнозом: Тяжелое нетравматическое геморрагическое поражение ЦНС: ВЖК 2 степени с обеих сторон. Подоболочечное кровоизлияние в проекции левого полушария и заднюю черепную ямку. Кровоизлияние в полушарие и червь мозжечка. Болезнь печени неуточненного генеза.
Произведено вскрытие головного мозга (рис. 1): консистенция дряблая, вещество мозга на разрезах неоднородное, без уплотнений, архитектоника мозга не нарушена. Кора не дифференцирована, подкорковые ядра различимы, субкортикальные мелкоочаговые темно-красные кровоизлияния левой теменной и затылочной долей. Просвет боковых желудочков расширен с преобладанием правого, содержат темно-красные, блестящие свертки крови, полностью выполняющие просвет, сохраняющие свою форму, при снятии которых в переднем роге правого бокового желудочка определяется субэпендимальное кровоизлияние 1х0,5х0,5см с нарушением целостности эпендимы и прорывом в просвет. В левом боковом желудочке обширные перивентрикулярные очаги размягчения с геморрагическим пропитыванием и паренхиматозным кровоизлиянием практически на все полушарие. В просвете третьего и четвертого желудочков темно-красные свертки крови, плотно выполняющие просвет. На полушариях мозжечка определяется окутывающая гематома толщиной до 0,4 см темно-красного цвета в виде слепка, на стволе 0,3 см. Ткань мозжечка сероватого цвета, полушария в состоянии тотального некроза киселеобразной консистенции, в левом полушарии паренхиматозное кровоизлияние 2х0,5х0,5 см темно-красного цвета. Ствол мозга не изменен.
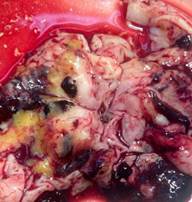
Рис. 1. Макропрепарат головного мозга (фото авторов)
Паренхиматозное кровоизлияние, представленное склеенными эритроцитами с краевым стоянием лейкоцитов, диапедезные кровоизлияния, очаги энцефалолизиса, периваскулярный, перицеллюлярный отек. Эпендима в единичных полях зрения отсутствует, имбибирована эритроцитами, широкая субэпендимальная зона глиоза (рис. 2).
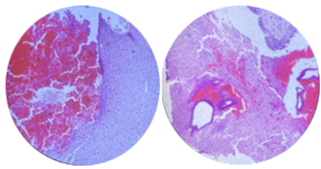
Рис. 2. Микропрепарат головного мозга
Примечание: составлен авторами по результатам данного исследования
Архитектоника строения печени нарушена («ложная долька») (рис. 3), часть гепатоцитов с признаками некробиоза, междольковое разрастание соединительной ткани с пролиферацией желчных ходов, фокусы гигантских многоядерных клеток, очаги и диффузные поля экстрамедуллярного кроветворения. Очаговый интрацеллюлярный и интралобулярный холестаз (рис. 4.).
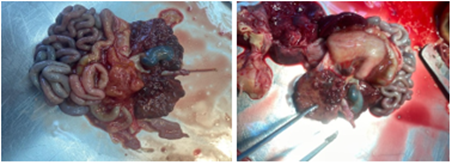
Рис. 3. Макропрепарат печени (фото авторов)
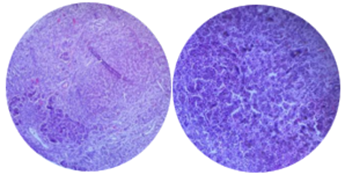
Рис. 4. Микропрепарат печени
Примечание: составлен авторами по результатам данного исследования
Межальвеолярные перегородки в легких были утолщены с полнокровными капиллярами. Просвет большей части альвеол, единичных бронхиол и сегментарных бронхов полностью выполнен эритроцитами, части – бесструктурными эозинофильными массами (рис.5).
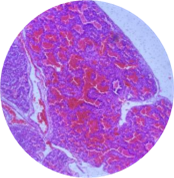
Рис. 5. Микропрепарат легкого
Примечание: составлен авторами по результатам данного исследования
Легкие большей частью безвоздушны, плотноватой консистенции. Ткань легкого на разрезе диффузно темно-красного цвета. Водная проба: при погружении кусочки, вырезанные из легкого, и целое легкое тотально тонут. Состояние поперечных срезов: полнокровие сосудов, тонкие, эластичные при надавливании стенки бронхов, с поверхности разреза выделяются геморрагические слизистые массы в умеренном количестве (рис. 6).
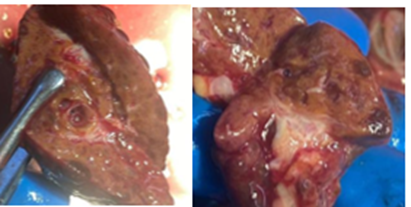
Рис. 6. Макропрепарат легкого (фото авторов)
Также при гистологическом исследовании плаценты были выявлены признаки виллузита – ворсинчатый хорион представлен незрелыми многолопастными ворсинами с отеком стромы, расширенными стромальными каналами, фокусы крупных синцитиальных узлов, некроза эпителия ворсин.
По результатам патологоанатомического вскрытия было выявлено полное расхождение заключительного клинического и патологоанатомического диагнозов. Патологоанатомический диагноз – Основное заболевание: Врожденный атрофический смешанный цирроз печени, декомпенсированный, неуточненной этиологии.
При исследовании данных анамнеза, лабораторных, патологоанатомических и инструментальных исследований выявлено, что у ребенка диагностирован врожденный атрофический смешанный цирроз печени, осложнившийся развитием внутриутробной печеночной недостаточности с нарушением белок-синтезирующей функции и коагулопатическими нарушениями, синдромом портальной гипертензии, о чем свидетельствуют ОАК, биохимические анализы крови, данные УЗИ при рождении, с развитием в раннем постнатальном периоде тяжелого ВЖК, гепаторенального синдрома, полиорганной недостаточности.
Смерть ребенка наступила на 5-е сутки жизни от мозговой декомпенсации. Причиной врожденного цирроза печени, вероятно, явилась перенесенная внутриутробная инфекция цитомегаловирусной этиологии, выявлены признаки очагового продуктивного виллузита (как проявление хронической формы гематогенной инфекции), а акцедентальная трансформация тимуса может быть фактором и маркером иммунодефицитного состояния ребенка, что и явилось причинами манифестации цитомегаловирусной инфекции и поражения печени у данного ребенка [5]. Обследование на ВУИ ребенку провести за 5 суток жизни было нецелесообразно, поскольку ребенок получал массивную трансфузионную терапию, серологическое исследование на ВУИ было бы неинформативным.
Приведенные выше данные отчетливо характеризуют наличие врожденной внутриутробной патологии, а также развитие множества осложнений, что в совокупности давало крайне неутешительные прогнозы на исход заболевания и в итоге привело к летальному исходу. Поэтому важной стратегией снижения частоты врожденной цитомегаловирусной инфекции является профилактика заболевания у беременных женщин путемраспространения информации о заболевании в общедоступных источниках и обучения несложным гигиеническим мероприятиям [6]. Интерес к данной проблеме специалистов обусловлен не только возможностью развития тяжелых форм этого заболевания у новорожденных и детей первого года жизни, но и потенциальным риском формирования прогностически неблагоприятных последствий [7].
Наиболее частой причиной возникновения данной патологии является цитомегаловирусная инфекция. Данный возбудитель относится к виду Cytomegalovirus hominis, семейству Herpesviridae (герпесвирус человека 5-го типа), роду Cytomegalovirus [8]. Зарегистрировано 4 штамма ЦМВ (АД169, Davis, Towne, Kerr), все они патогенны для человека. Источником инфекции является только инфицированный человек [9]. Если серонегативная женщина инфицируется цитомегаловирусом во время беременности, то, независимо от входных ворот инфекции, следствием активной репликации вируса в пораженных клетках является развитие транзиторной виремии, продолжительность которой зависит от скорости формирования приобретенного иммунитета. Наличие ЦМВ в крови ведет к инфицированию плаценты, ее поражению и передаче вируса плоду [10]. Проникший через плаценту вирус активно реплицируется в эндотелиальных клетках сосудов плода и распространяется с клетками крови в органы-мишени. В результате поражаются клетки почек (репликация вируса в которых приводит к попаданию вируса в амниотические воды), печени, миокарда, головного мозга. Могут формироваться хронический гепатит и цирроз печени, поражения почек (кистозные дисплазии, нефротический синдром), пневмосклероз, внутрижелудочковые кровоизлияния. Установлено, что наиболее часто инфицирование плода и развитие тяжелых вариантов ВУИ отмечаются в тех случаях, когда во время беременности женщина переносит первичную инфекцию [11]. Заражение плода в первой половине беременности наиболее опасно, так как цитомегаловирус обладает тератогенным свойством [12]. Тяжесть и степень выраженности органных нарушений вследствие внутриутробного инфицирования тем выше, чем ниже гестационный возраст плода [13]. При внутриутробном заражении ЦМВ инфекцией поражаются практически все органы и системы организма: ЦНС, печень – гепатомегалия, гепатит, холангит и внутрипеченочный холестаз; кроветворение – тромбоцитопения, анемия, экстрамедуллярное кроветворение [14]. Также поражаются почки, надпочечники, поджелудочная и щитовидная, слюнные железы и органы ЖКТ – эзофагит, гастрит, энтероколит с образованием язв слизистой кишки, легкие – пневмонит [15].
Заключение
Клинический случай подчеркивает широкий спектр симптоматических проявлений врожденного цирроза у новорожденных с экстремально низкой массой тела. Кроме того, он иллюстрирует, что при данном заболевании может отмечаться массивное внутричерепное кровоизлияние, связанное с дефицитом факторов коагуляционного гемостаза. Таким образом, этот пример указывает на необходимость комплексного подхода к диагностике и лечению, а также профилактике оппортунистических инфекций у беременных женщин, включая мультидисциплинарное ведение и междисциплинарное сотрудничество врачей разных специальностей.
Конфликт интересов
Библиографическая ссылка
Ледяйкина Л.В., Волкова А.О., Полякова А.В., Ледяйкина С.А., Пиксаева Е.С., Каминская Т.М., Ледяйкина М.В. КЛИНИЧЕСКИЙ СЛУЧАЙ ВРОЖДЕННОГО ЦИРРОЗА ПЕЧЕНИ У НЕДОНОШЕННОГО РЕБЕНКА // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34422 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34422



