Введение
Акне (Acne vulgaris) является одной из самых распространенных дерматологических патологий с хроническим течением. Она поражает сально-волосяной аппарат и наиболее часто локализуется на коже лица, груди и спины. В развитии заболевания на сегодняшний день важную роль отводят следующим патогенетическим факторам: воспалительному процессу, гиперпродукции себума, фолликулярному гиперкератозу и пролиферации Cutibacterium acnes (C. acnes) [1]. Согласно статистическим данным, акне поражает преимущественно подростков – более 80%, однако заболевание встречается и в других возрастных группах, у лиц обоих полов, что свидетельствует о сохраняющейся актуальности данной патологии [2; 3].
Известно, что в развитии акне имеют значение многочисленные факторы. Так, посредством влияния на продукцию кожного сала и дифференцировку себоцитов патогенез заболевания регулируется гормонами, а также факторами роста и транскрипции [4].
На сегодняшний день известно, что многие факторы активно участвуют в регенерации кожи и патогенезе акне. К ним относят фактор некроза опухоли, интерлейкины (IL)-1β, IL-17, IL-23. Рассматриваются возможности выделения антител, нацеленных на данные факторы, для терапии тяжелых форм акне [5].
Существуют сведения, согласно которым связанный с фактором некроза опухоли лиганд, индуцирующий апоптоз (Tumor necrosis factor-related apoptosis-inducing ligand, TNF-related apoptosis-inducing ligand, TRAIL) активирует запрограммированную гибель клеток через путь рецепторов смерти (или внешний путь) DR4 и DR5, активирующих каспазу-8, которая, в свою очередь, активирует каспазу-3 и приводит к процессу апоптоза [6]. Согласно другим источникам, TRAIL представляется одним из ключевых белков, участвующих в специфическом апоптотическом ответе клеток сальных желез на 13-цис-ретиноевую кислоту [7]. Подтверждается важная роль данного фактора в патогенезе акне - TRAIL участвует в апоптозе не только себоцитов, но и кератиноцитов, что позволило использовать его совместно с селективным ингибитором протеасом MG-132 для стимуляции гибели себоцитов, а показатель уровня TRAIL в обработанных MG-132 себоцитах был значительно повышен [8].
Однако имеющиеся на сегодняшний день данные о влиянии рассматриваемого фактора роста на патогенез акне носят противоречивый характер, что и определило высокую актуальность проведенного авторами исследования.
Цель исследования - оценка роли фактора роста TRAIL в патогенезе среднетяжелой формы акне и механизме терапевтического действия комбинированной терапии системным изотретиноином, фототерапии и внутридермального введения аутоплазмы.
Материалы и методы исследования
Авторами были использованы клинический и иммунологический методы для решения поставленной цели в ходе проведенного проспективного открытого нерандомизированного исследования. Под наблюдением находилось 95 человек в возрасте от 17 до 45 лет, которые были разделены на 3 группы. 75 больных акне среднетяжелой формы в возрасте от 17 до 45 лет (медиана возраста – 31 год), 35 мужчин и 40 женщин (46,7% и 53,3% соответственно), составивших основную группу и группу сравнения, а также 20 условно здоровых лиц контрольной группы. Основная группа была разделена на 2 подгруппы: 1А и 1Б. В подгруппе 1А основной группы пациенты получали комплексную терапию, включавшую системный изотретиноин (СИ) в дозировке 10 мг/сутки 4 месяца и лазерную терапию неодимовым лазером (Nd:YAG) 1064 нм с плотностью энергии – 22 Дж/см2, при общем времени воздействия на участок кожи 3 минуты, курсом 4 процедуры 1 раз в две недели, а также внутридермальное введение в область лица аутологичной плазмы объемом 4 мл, курсом 4 процедуры 1 раз в 2 недели. В подгруппе 1Б основной группы пациенты получали комплексную терапию, включавшую прием СИ в дозировке 10 мг/сутки 4 месяца и лазерную терапию неодимовым лазером (Nd:YAG) 1064 нм курсом 4 процедуры 1 раз в 2 недели. В группе сравнения пациенты получали СИ в дозе 0,5 мг/кг массы тела до набора кумулятивной дозы 120-150 мг в соответствии с клиническими рекомендациями [9]. Исследование проведено на кафедре кожных болезней и косметологии ФДПО ИНОПР ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России в клинических условиях и одобрено этическим комитетом. Всеми пациентами была подписана форма информированного согласия на участие в исследовании.
Всем пациентам проводился клинико-анамнестический анализ с оценкой жалоб, данных анамнеза, клинико-лабораторное обследование, включавшее общий клинический анализ крови, общий анализ мочи, биохимический анализ крови. Проведено стандартизированное физикальное обследование с фотодокументацией до, на каждом визите и после лечения. Оценка степени тяжести осуществлялась по классификации акне Американской академии дерматологии (American Academy of Dermatology, AAD) в модификации Самгина М.А.
Исследование иммунологических показателей проводилось в клинико-диагностической лаборатории отдела оказания специализированной медицинской помощи МНПЦДК ДЗМ. Методом твердофазного иммуноферментного анализа (ИФА) была проведена оценка фактора роста TRAIL в сыворотке крови с использованием набора Human TRAIL ELISA Kit (RayBiotech, Inc., США).
Распределение пациентов по количеству в группах представлено на рисунке 1.
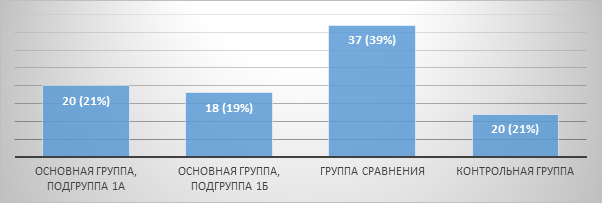
Рис. 1. Распределение пациентов по количеству в группах
Результаты исследования и их обсуждение
Показатели фактора роста TRAIL в сыворотке пациентов до и после проведенной терапии в подгруппе 1А основной группы представлены на рисунке 2.
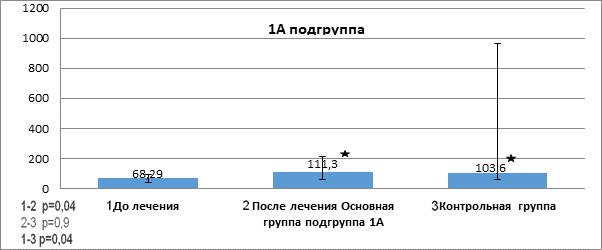
Рис. 2. Показатели фактора роста TRAIL (отн. ед.) в сыворотке пациентов до и после проведенной терапии в подгруппе 1А основной группы
Примечание: р* - статистически значимо, критерий Манна - Уитни (р< 0,05).
Как видно из данных рисунка 2, до начала терапии у всех пациентов было выявлено достоверное снижение показателя TRAIL (68,29(41,34;94,78) в сыворотке крови в сравнении с группой контроля (103,6(58,24; 964,9), p=0,04). После проведенной терапии в подгруппе 1А наблюдалось достоверное повышение показателя TRAIL (111,3(62,64; 210,9), p=0,04).
Показатели фактора роста TRAIL в сыворотке пациентов до и после проведенной терапии в подгруппе 1Б основной группы представлены на рисунке 3.
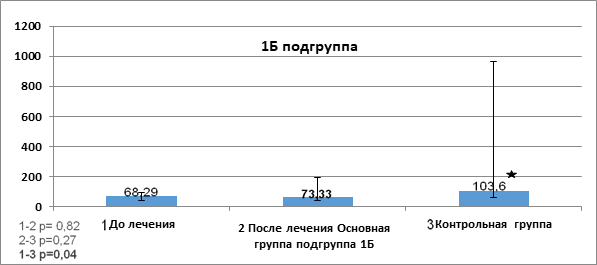
Рис. 3. Показатели фактора роста TRAIL (отн. ед.) в сыворотке пациентов до и после проведенной терапии в подгруппе 1Б основной группы
Примечание: р* - статистически значимо, критерий Манна - Уитни (р< 0,05).
Как видно из данных рисунка 3, после проведенной терапии было выявлено повышение показателя TRAIL (73,33 (30,73; 144,7) в подгруппе 1Б.
Показатели фактора роста TRAIL в сыворотке пациентов до и после проведенной терапии в группе сравнения представлены на рисунке 4.
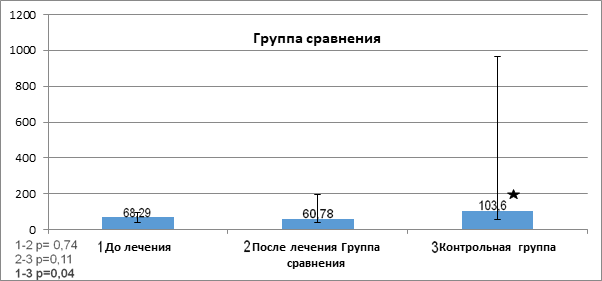
Рис. 4. Показатели фактора роста TRAIL (отн. ед.) в сыворотке пациентов до и после проведенной терапии в группе сравнения
Примечание: р* - статистически значимо, критерий Манна - Уитни (р< 0,05).
Как видно из данных рисунка 4, после проведенной терапии показатель TRAIL (60,78 (40,72; 193,7) в сыворотке крови у пациентов группы сравнения ниже показателя перед проведенной терапией (68,29 (41,34; 94,78).
Показатели фактора роста TRAIL в сыворотке пациентов после проведенной терапии в группах исследования представлены на рисунке 5.
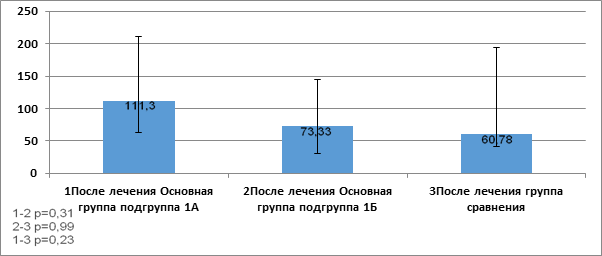
Рис. 5. Показатели фактора роста TRAIL (отн. ед.) в сыворотке пациентов после проведенной терапии в группах исследования
Примечание: р* - статистически значимо, критерий Манна - Уитни (р< 0,05).
Как видно из данных рисунка 5, после проведенной терапии показатель TRAIL повысился в основной группе по сравнению с группой сравнения (60,78 (40,72; 193,7). Необходимо отметить, что показатель TRAIL (111,3 (62,64; 210,9)) в сыворотке крови пациентов подгруппы 1А был значительно выше показателя у пациентов подгруппы 1Б основной группы (73,33 (30,73; 144,7), но не имел статистической разницы (р> 0,05).
Имеющиеся в настоящее время сведения о роли фактора TRAIL в развитии и течении акне малочисленны и не всегда однозначны.
Согласно данным источников зарубежной литературы, выступая в качестве медиатора апоптоза, TRAIL может участвовать в процессе патогенеза токсического эпидермального некролиза, что свидетельствует о его важной роли в воспалении кожи [10]. По мнению авторов другого исследования, TRAIL является главным стимулятором апоптоза себоцитов, вызванного СИ, трактующего подавление выработки кожного сала ретиноидом [11; 12]. Объяснить данный эффект можно тем, что изотретиноин, благодаря стимуляции экспрессии фактора транскрипции p53, вызывает экспрессию рассматриваемого нами фактора, а также подавляет рецепторы к инсулиноподобному фактору роста 1 (ИФР-1) и андрогенам [13-15].
Заключение
Проведенное исследование позволило выявить закономерность, согласно которой снижение показателя фактора роста TRAIL в сыворотке крови у больных акне среднетяжелой формы способно приводить к чрезмерному скоплению клеток в сальных железах и индуцировать реакцию воспаления при данном заболевании. Полученные результаты демонстрируют тенденцию, согласно которой повышение показателя TRAIL обеспечивается в результате комплексной терапии акне, включающей прием низких доз СИ, лазерную терапию неодимовым лазерным аппаратом (Nd:YAG) и аутоплазмотерапию, по сравнению с традиционным лечением, что, вероятно, может свидетельствовать о высокой результативности и ярко выраженном противовоспалительном эффекте терапии и, как следствие, о возможности применения диагностики TRAIL в качестве маркера воспаления при акне. Таким образом, показатель TRAIL в сыворотке у больных со среднетяжелой формой акне может рассматриваться как противовоспалительный фактор.
Одним из важных подходов в изучении акне является понимание патогенеза дерматоза и детализация факторов, оказывающих на него влияние. Определение у больных среднетяжелой формой акне фактора роста TRAIL в сыворотке крови может в дальнейшем являться дифференциальным маркером терапевтической тактики, а также лабораторным показателем эффективности проводимой у них терапии.
Конфликт интересов
Библиографическая ссылка
Демина О.М., Хатаева Д.И. ОЦЕНКА ФАКТОРА РОСТА, РОДСТВЕННОГО ФАКТОРУ НЕКРОЗА ОПУХОЛИ АПОПТОЗ-ИНДУЦИРУЮЩЕГО ЛИГАНДА ПРИ АКНЕ СРЕДНЕТЯЖЕЛОЙ ФОРМЫ И ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ // Современные проблемы науки и образования. 2025. № 6. ;URL: https://science-education.ru/ru/article/view?id=34375 (дата обращения: 12.02.2026).
DOI: https://doi.org/10.17513/spno.34375



