Введение
Относительно недавно человечество столкнулось с пандемией РНК-содержащего вируса из семейства Coronaviridae - SARS-CoV-2. Само его название отсылает к наиболее часто проявляющейся со стороны организма системной реакции: тяжелому острому респираторному синдрому (ТОРС), являющемуся затяжным, острым респираторным вирусным заболеванием. Однако интерес изучения патогенеза новой коронавирусной инфекции сосредоточен отнюдь не вокруг его активности в роли респираторного инфекционного агента. Развитие цитокинового шторма на фоне гиперергической активации лейкоцитов, синдром активации макрофагов (САМ), лимфогистиоцитоз и коагулопатия ответственны за неутешительность прогноза и хронизацию системного воспалительного процесса [1]. Характерными признаками болезни являются быстро прогрессирующая дыхательная недостаточность на фоне умеренно выраженных катаральных явлений, интоксикации с повышением температуры тела до 38-39°С, ознобом, мышечными и головными болями [2]. Международное сообщество впервые столкнулось с новой разновидностью SARS коронавируса, обладающей повышенной вирулентностью и специфической аффинностью к легочной ткани, в 2002 году (англ. SARS - severe acute respiratory syndrome) [3]. Получил он такое название в связи с тем, что явился причиной развития у людей атипичной интерстициальной пневмонии, ведущей к возникновению тяжелого ОРДС (острого респираторного дистресс-синдрома). Постепенно клинические особенности течения коронавирусной инфекции в течение пандемии COVID-19 начали пополняться новыми симптомами. Первые проявления данного заболевания со стороны органов дыхания и нервной системы сопровождались болью в горле, аносмией и извращенным восприятием вкуса (агевзией). По данным одного исследования было продемонстрировано, что у половины обследованных пациентов с COVID-19 уже в первые дни (в среднем на 2-е сутки) наблюдалась полная аносмия, в 43,5% случаев – агевзия [4]. Уже на данном этапе можно высказать предположение о нейротропности вируса SARS-CoV-2. Ранняя симптоматика инфекции также интересна реакциями со стороны ЖКТ (желудочно-кишечного тракта). Статистическая годовая сводка, проведенная в разгар пандемии, продемонстрировала, что в выборке, составившей 230 пациентов, проходивших амбулаторное лечение с подтвержденным COVID-19, у половины диагностированы гастроинтестинальные синдромы, такие как анорексия, тошнота, диарея, абдоминальные боли [5]. Изначально такие системные проявления требовали постановки дифференциального диагноза между обострениями хронических заболеваний ЖКТ или синдромом раздраженного кишечника и COVID-19. Однако только после изучения патогенеза и особенности тропности вируса SARS-CoV-2 к эпителиоцитам человеческого организма, врачи пришли к мнению, что нарушения со стороны пищеварительной системы могут свидетельствовать о заражении коронавирусной инфекцией [6; 7].
Можно подытожить: накопленные сведения о продромальном периоде новой коронавирусной инфекции помогают заподозрить болезнь еще до наступления активной системной репликации вируса. Однако тяжело соотнести патогенез таких осложнений постковидного синдрома (ПКС), как артериальная гипертония, васкулопатии и, в особенности, когнитивные нарушения с клиническим течением COVID-19. Вероятно, в основе жалоб на усталость, неспособность сосредоточиться, так называемый мозговой туман, депрессию, беспокойство, нарушения сна, а также многочисленные и разнообразные вегетативные, гастроинтестинальные, дерматологические, кардиоваскулярные расстройства, лежит гиперактивация провоспалительных процессов, вовлекающих эндотелий, как иммунную и эндокринную матрицу воспаления и существенно изменяющую свой метаболический профиль при вирусной репликации [8; 9].
Цель исследования - осуществить анализ патогенетических факторов, мишеней, механизмов эндотелиальной дисфункции после перенесенного инфекционного заболевания COVID-19, сформировать патогенетическую ось окислительного стресса, сдвигов в метаболизме эндогенного железа, ферремии, эндотелита и нейровоспаления в формировании расстройств когнитивного спектра в контексте постковидного синдрома.
Материалы и методы исследования
Проанализированы актуальные ресурсы платформ PubMed/Medline, материалы Кокрейновской библиотеки, eLibrary, рассмотрены рекомендации по ведению больных. В статью включены результаты оригинальных исследований и систематических обзоров за последние 5 лет. Выборку составили 126 источников, в написании данной статьи задействовано 43. Был произведен поиск информации по ключевым словам «эндотелиопатия», «окислительный стресс в течении COVID-19», «нейротропность COVID-19», «гиперферритинемия», «острофазные белки», «АПФ-2 (ангиотензинпревращающий фермент 2)», «поражения сосудистого эндотелия», «мозговой туман». На основании полученных данных было сформировано свое заключение в связи патогенетических механизмов, их обоснование.
Результаты исследования и их обсуждение
Патогенез COVID-19. Взгляд на полиморфизм клинических проявлений
Эпителиальные клетки, формирующие поверхностный слой дыхательных путей и слизистую оболочку желудочно-кишечного тракта, выполняют функцию первичных барьерных структур, через которые осуществляется инвазия коронавируса [1; 7]. Такая специфическая тропность вируса к ним связана с продукцией бокаловидными клетками и энтероцитами протеина АПФ-2. Альвеолоциты 2 типа и эпителиальные клетки тонкого кишечника отличаются высоким уровнем экспрессии АПФ-2, что позволяет объяснить причину преимущественного поражения дыхательных путей при COVID-19, а также вероятность возникновения у некоторых пациентов абдоминального и диспептического синдромов. АПФ-2 является цинк-зависимой карбоксипротеазой, которая катализирует расщепление, инактивацию, деградацию ангиотензина II с образованием ангиотензина 1-7. Вазоактивный пептид ангиотензин II ответствен за системную вазоконстрикцию. Ангиотензин 1-7, наоборот, опосредует вазодилатирующий, антипролиферативный и антифиброзный эффекты [10]. Следовательно, АПФ-2 участвует не только в регуляции артериального давления человека. Кроме того, что протеин АПФ-2 является мощным ингибитором активности ренин-ангиотензиновой системы, индуцирует вазодилатацию, вызывает натрийурез вследствие синтеза альдостерона и ингибирует активность воспалительного процесса, он также является рецептором коронавирусов SARS-CoV-2 и взаимодействует с транспортерами аминокислот и интегринами [11]. Однако присутствие АПФ-2 на клетках нижних дыхательных путей, кишечника, а также внутренних стенок артерий и вен само по себе не гарантирует проникновения вируса в клетку. Активация S-белка (спайк-белка) вируса и собственно его эндоцитоз происходят при участии одной из трансмембранных сериновых протеаз - TMPRSS2 (Transmembrane protease, serine 2) [12; 13]. Причем интересен тот факт, что экспрессия двух этих мишеней для вируса различна и достигает максимума в различных органах. АПФ-2 и TMPRSS2 примерно одинаково экспрессируются в коре головного мозга, но при этом АПФ-2 относительно хорошо представлен в таких зонах, как черное вещество (substantia nigra), желудочки мозга, а гиперэкспрессия данного рецептора характерна для пириформной коры (часть обонятельной коры лимбической системы). Гиперэкспрессия молекул АПФ-2 в головном мозге и их прямое повреждение вирусом является одним из механизмов патогенеза когнитивных нарушений при постковидном синдроме, о котором будет сказано далее. Диссеминация вируса SARS-CoV-2 далеко за пределы очага воспаления неудивительна: обилие распределения рецепторов-мишеней в клетках эпителиального происхождения является одним из субстратов возникновения полиорганной недостаточности, активации лимфогистиоцитарного звена в формировании системного иммунного ответа. При вирусном заражении эндотелиальных клеток вирусом SARS-CoV-2 последние активируются и становятся дисфункциональными [13; 14].
Эндотелиопатия как ключевое звено хронического воспаления при COVID-19
Морфологическим субстратом репликации и длительной персистенции вируса SARS-CoV-2 является вызываемая им эндотелиальная дисфункция, носящая иммуноопосредованный характер. Эндотелий сосудов является самым большим по площади в человеческом организме эндокринным органом, нормальное функционирование которого поддерживает адекватное соотношение прокоагулянтных и антикоагулянтных систем, модулирует воспаление, регулирует сосудистый тонус и проницаемость сосудов [15]. К факторам риска повреждения эндотелия относятся гиперхолестеринемия, гипергомоцистеинемия, повышенный уровень провоспалительных цитокинов (IL-1β и IL-6, ФНО-α) [16]. Нарушение проницаемости сосудистой стенки, усиленная продукция активных форм кислорода, провоспалительных медиаторов и деградация оксида азота (NO) является фактором альтерации и, как следствие, воспаления эндотелиальной выстилки сосудов. Т.О. Бурдиенко в своем исследовании утверждает: при заражении COVID-19 в организме человека, уже имеющего предрасположенность к эндотелиальной дисфункции на фоне течения таких заболеваний, как сахарный диабет, гипертоническая болезнь, происходит формирование и замыкание «порочного круга», играющего значимую роль в возникновении дыхательной недостаточности у пациентов и приводящего в итоге к развитию эндотелита [17]. Сказанное выше лишь подтверждает доводы о том, что персистенция вируса ведет к хронизации многих заболеваний.
Замкнутый круг эндотелита
Замкнутый круг повреждения эндотелия начинается с контакта SARS-CoV-2 с рецепторами АПФ-2 на мембране перицитов, процессингом нуклеокапсида и эндоцитоза в клетку посредством TMPRSS2 [18]. Проникновение в них вируса блокирует функцию АПФ-2, обладающего регуляторным действием на ангиотензинпревращающий фермент и выравнивающего каскад констрикторных и вазодилатируюших влияний на сосуд. АПФ-2, в норме обеспечивающий вазодилатирующий и противовоспалительный эффект, под действием вирусной РНК, перестает сдерживать вазоконстрикцию ангиотензина II. Это, в свою очередь, приводит к замедлению кровотока, следующей за ним гипоксии, активации тканевых протеаз, альтерации и развитию воспаления. Воспаление в стенке сосуда всегда отличается весьма неоптимистичным течением. Являясь активным эндокринным органом, эндотелий может как самостоятельно продуцировать медиаторы воспаления, так и быть матрицей для взаимодействия с уже циркулирующими в крови. Воспалительный ответ сопровождается выработкой привлеченными в очаг воспаления макрофагами цитокинов и хемокинов (IL-1, IL-2, IL-4, IL-6, IL-7,IL-10, IL-12, IL-16, IL-17, M-CSF, G-CSF, GM-CSF, IP-10, IFN-y, МСР-1, МІР 1-а, фактора роста гепатоцитов (HGF), ФНО-α и фактора роста эндотелия сосудов (VEGF) [19]. Однако интерес в развитии эндотелиопатии сосредоточен не в самих провоспалительных медиаторах, а в привлечении ими нейтрофилов в очаг воспаления, что еще больше усугубляет процесс альтерации эндотелиальных клеток. Нейтрофилы являются самыми ранними клетками врождённого иммунного ответа при инфекционном процессе, которые осуществляют борьбу с патогенами за счёт фагоцитоза, продукции активных форм кислорода (АФК) и высвобождения нейтрофильных экстрацеллюлярных ловушек (NET). Кроме того, дегрануляция нейтрофилов и выделение ими хемокинов и цитокинов моделирует воспаление и так поврежденной интимы сосудов во время инфекции, а АФК и нейтрофильные ловушки участвуют в повреждении тканей, и в частности того же эндотелия [20]. Тем самым происходит замыкание порочного круга эндотелиопатии (рис.).
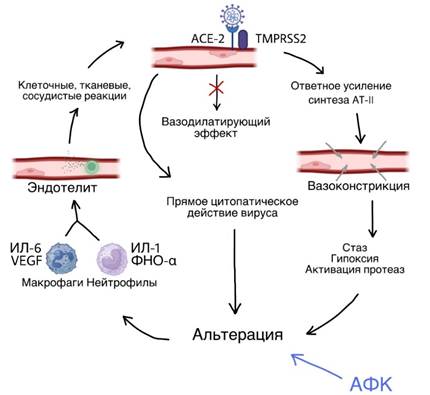
Замкнутый круг эндотелита. Дисбаланс вазоконстрикторных и вазодилатирующих эффектов вызывает расстройства микроциркуляторного характера, что в совокупности с прямым цитопатическим действием SARS-CoV-2 ведет к альтерации сосудистой стенки, активации синтеза провоспалительных цитокинов (составлено авторами)
Роль активных форм кислорода в патогенезе COVID-19
Обратимся к продукции активных форм кислорода, чья роль в повреждении клеток и тканей в ходе течения COVID-19 велика. Нейтрофилы, мигрировавшие в очаг повреждения и воспаления эндотелия, при помощи оксидаз переводят молекулярный кислород в атомный, инициируя при этом респираторный взрыв. Окислительный стресс влияет на становление постковидного синдрома, и в особенности нейродегенеративных заболеваний. Дисфункция митохондриальных оксидаз возбудителем COVID-19 продемонстрирована в опыте авторов О.А. Шукалович и Е.Ф. Туровининой, доказывающих, что усиление перфузии в микроциркуляторном русле ведет к активации продукции АФК и истощению антиоксидантных систем организма [21]. Действительно, дыхательная цепь митохондрий является основным источником АФК в клетках. В ней происходит диссипация (утечка) электронов с I и III митохондриальных ферментных комплексов [22]. В связи с этим примерно 2-5% поступающего кислорода превращается в активную форму. Выработка O2•- в митохондриях зависит от активности дыхания и изменений частичного давления кислорода (гипоксия в случае инфекционного течения SARS-CoV-2) [23]. Однако изучение мембранотоксического действия гидроперекисей липидов не ограничивается типовым патологическим процессом образования активных форм кислорода нейтрофилами. Рассмотренный процесс лишь косвенно связан с действием SARS-CoV-2 и опосредован через вызываемую им вазоконстрикцию. Но также известен механизм прямого влияния вируса на рецепторы АПФ-2 эндотелиальных клеток. Замечено, что гиперпродукция этого пептида ассоциирована с угнетением рецепторов ACE2, являющихся мишенью для SARS-CoV-2. Основным рецептором ангиотензина II является АТ1R, который в эндотелии активирует сложный сигналинг, включающий МАР киназный каскад (mitogen-activatedprotein(MAP)kinases), протеинкиназу С, а также транскрипционный фактор NF-kB (nuclear factor kappa B), что ведет к активации NADPH-оксидазы из семейства ферментов NOX2 (NicotinamideAdenineDinucleotidePhosphate oxidase 2) [24]. В эндотелии NOX2 служит основным источником АФК. Также встречаются доводы о гематотоксичности коронавирусной инфекции, приводящей к внутрисосудистому гемолизу, деструкции гемоглобина и выделении в кровоток свободного двухвалентного иона железа, также имеющего потенциал к вступлению в реакции свободнорадикального окисления [25]. По такому механизму протекает реакция Фентона: Fe2+ + H2O2 → Fe3+ + OH. + OH-
Роль острофазных железосвязывающих белков в течении COVID-19 и развитии нейровоспаления Важнейшим клиническим маркером тяжелого течения коронавирусной инфекции является гиперферритинемия. Гиперферритинемия может быть подтверждена только при содержании ферритина > 400 мкг/л [26]. Однако эти цифры нередко могут доходить и до 1000 мкг/л. Такое содержание ферритина наряду с повышением трансферрина плазмы является плохим прогностическим критерием течения болезни, и связано это с одновременным увеличением активности свободнорадикальных реакций наряду с уменьшением собственных антиоксидантных (например, глутатионовой) систем организма [27]. Выделяют несколько основных теорий и гипотез повышения уровня ферритина в плазме крови: причем некоторые авторы склонны считать, что это не является следствием нарушением метаболизма самого железа в ходе коронавирусной инфекции [28]. Раньше основной причиной гиперферритинемии считалось увеличение его концентрации в плазме как белка острой фазы, синтезируемого в ответ на воспаление. Однако современные представления о многообразии ролей ферритина доказывают: гиперферритинемия может возникать вследствие старения и истощения редокс-систем организма, ферроптоза и иммунного гемохроматоза. Более того, ферритин сам может служить провоспалительным медиатором, а также повышаться в связи с развитием гемофагоцитарного синдрома, как это было показано в работе Кокиной М.Ю. с соавторами [29]. Отдельного внимания заслуживает гематотоксичность SARS-CoV-2, индуцирующая внутрисосудистый гемолиз, выход свободного железа, обладающего значительным редокс-потенциалом в плазму на фоне активации каскадов коагуляции [25; 30]. Существуют теории о гемоглобинопатическом действии вируса при его прямом воздействии на рецепторы эритроцитов, а также гепцидин-мимикрическом действии SARS-CoV-2 [31; 32]. Вирус может как вызывать гемолиз эритроцитов, так и препятствовать синтезу функционального гемоглобина. При этом синтезируются аномальные формы, не способные к переносу кислорода и усугубляющие гипоксию [30]. Организм, находясь в состоянии окислительного стресса, вызванного цитокиновым штормом и гиперпродукцией активных форм кислорода, пытается минимизировать процессы перекисного окисления липидов (ПОЛ) и высвобождает трехвалентный ион железа из молекул гемоглобина. Таким образом, у пациентов на фоне системного воспаления может возникать ферремия, сводящаяся к секвестрации железа макрофагами и клетками нейроглии [32-34]. Важно, что скорость и эффективность данной системы замедляется с возрастом, что в совокупности с разной скоростью перфузии сосудов головного мозга приводит к избирательному накоплению железа в участках серого и белого вещества [30; 33]. Физиологическое накопление железа в организме состоит в его отложении при старении в связи со снижением активности антиоксидантных систем организма (ферроптоз) [32]. Но данные о нейротропности SARS-CoV-2 и, следовательно, вызываемого им нейровоспаления, служат прогностическим признаком патологического отложения железа в центральной нервной системе.
Роли железа в нервной системе разнообразны: оно играет роль в нейропередаче, миелинизации нервных волокон, делении нервных клеток. Его концентрация тщательно регулируется, избытки запасаются в виде ферритина и нейромеланина [35]. Реакции поступления эндогенного железа при воспалении, вызванном COVID-19, могут и не претерпевать особых изменений, в то время как регуляция его концентрации нарушена гепцидин-мимикрирующим действием SARS-CoV-2 [31; 32]. Гепцидин - белок острой фазы, экспрессируемый в печени. Его функция заключена в ингибировании ферропортина, который является единственным белком-экспортером железа за пределы клеток, тем самым способствуя проникновению железа в клетки. Избыток гепцидина может вызвать ферроптоз. Возможно, вирус SARS-CoV-2 имитирует действия гепцидина, тем самым увеличивает циркулирующий и тканевой ферритин, влияя на печень, селезенку, костный мозг и мышцы [31; 36].
Теперь можно проследить логическую цепочку, возникающую между нарушениями в метаболизме железа, в особенности влияния на него продукции активных форм кислорода и гепцидин-подобного действия SARS-CoV-2, и патогенезом когнитивных расстройств в контексте постковидного синдрома. Политропность вируса ко многим системам органов, в частности к нервной, ассоциирована с первично возникающими сосудистыми реакциями в связи с дисрегуляцией ренин-ангиотенин-альдостероновой системы, вазоконстрикцией и гипоксией. Последняя является ключевым фактором в развитии воспаления и нарушении работы многих систем.
Нейротропность SARS-CoV-2. Теории патогенеза «мозгового тумана» («Brain fog»)
О том, что вирус имеет аффинитет к нервным клеткам, стало понятно не сразу. Только после участившихся жалоб на быструю утомляемость, головную боль, одышку, выпадение волос и снижение внимания был подробнее описан механизм его нейропатического действия. Выделяют два основных пути распространения: гематогенный и транснейрональный. То, что вирус вызывает нейровоспаление, связано с активной экспрессией рецепторов АПФ-2 и TMPRSS2 в головном мозге, а также с его гематогенным распространением из очагов первичного поражения при условии несостоятельности гематоэнцефалического барьера ввиду его повреждения АФК и действия провоспалительных медиаторов. Транснейрональный путь интересен открытием у SARS-CoV-2 возможности к аксоаксональному транспорту в головном мозге, антеро- и ретроградному движению в ЦНС. Проникновение вируса в ЦНС возможно через обонятельный нерв. Достигая решетчатой пластинки, он достигает и своих мишеней: клеток обонятельной слизистой оболочки человека, высоко экспрессирующих оба белковых рецептора: АПФ-2 и TMPRSS2 [34; 37].
Помимо двух рассмотренных механизмов COVID-19-опосредованного повреждения нейроцитов, интересно отметить его косвенное действие, затрагивающее трофику головного мозга. В норме в микроглии происходит экспрессия особого протеина – BDNF (brain-derived neurotrophic factor – мозговой нейротрофический фактор). Физиологические влияния BDNF основаны на связывании с рецепторами нервных окончаний, что приводит к активации дальнейших многоступенчатых сигнальных каскадов, отвечающих за репарацию и нейропротекцию [38]. В исследовании, проведенном зарубежными коллегами, явно продемонстрирована корреляция между симптомокомплексом «мозгового тумана» и повышением концентрации нейрорегенеративного фактора BDNF [39]. Термин «brain fog» («мозговой туман»), был впервые описан в зарубежной литературе в 2020 году [40]. Даже после полного клинического выздоровления у пациентов отмечаются жалобы на расстройства астенического спектра. Причем инструментальными методами было доказано ухудшение трофики гипоталамических структур и всего мозгового вещества в целом [41]. Данное влияние опосредуется прямым действием SARS-CoV-2 также на функции рецепторов АПФ-2. Дело в том, что известный гептапептид ангиотензин 1-7, являющийся результатом расщепления его предшественника посредством АПФ-2, участвует в повышении уровня мозгового нейротрофического фактора, опосредуемого через MAS-рецепторы ангиотензина. Снижение экспрессии ACE2 рецепторов при их блокаде вирусом понижает уровень BDNF, оказывает гипотрофическое влияние и, следовательно, ведет к нейродегенерации и развитию «мозгового тумана» [42; 43].
Заключение
Эволюционно в человеческом организме сформировались метаболические пути, ограничивающие поступление и предотвращающие накопление свободных ионов железа, обладающих высокой редокс-активностью. Но вирус SARS-CoV-2 дестабилизирует большинство из них, усугубляя и без того реакцию гипервоспаления, носящую мультисистемный характер в связи с вовлечением сосудистого эндотелия, выступающего крупнейшей иммунной матрицей воспаления. Наиболее серьезные последствия в этом случае отмечаются именно в центральной нервной системе, где избытки железа накапливаются в больших количествах, особенно у лиц пожилого возраста, у которых накопление железа в глии и нейронах головного мозга носит физиологический характер. Нейровоспаление, индуцированное плейотропным действием вируса SARS-CoV-2 на сосудистый эндотелий, даже после клинического выздоровления заставляет пациентов чувствовать эмоциональный и психический дискомфорт в связи со спутанностью сознания, цефалгиями. Ухудшение трофики на клеточном уровне в головном мозге является современной патогенетической основой длительных когнитивных нарушений в контексте перенесенного COVID-19. А замкнутый круг эндотелиопатии, возникающий в связи с глобальной дисрегуляцией ренин-ангиотензин-альдостероновой системы у пациентов с признаками имеющейся васкулопатии, может формировать предпосылки для возникновения гипертонической болезни. В связи с необходимостью протекции нервной, сердечно-сосудистых систем в контексте постинфекционного мультисистемного повреждения множества клеточных и тканевых структур SARS-CoV-2, целесообразно вести учет сывороточных маркеров метаболизма железа, нейрорегенеративных факторов, острофазных белков воспалительного ответа. Указанные патогенетические механизмы лежат в основе формирования постинфекционного когнитивного дефицита, так называемого мозгового тумана, вызванного как прямым, так и косвенным действием вируса на трофику нейроцитов и метаболизм эндогенного железа и формирующегося вследствие функционирования патогенетической оси «окислительный стресс – ферремия – эндотелит – нейровоспаление».
Конфликт интересов
Библиографическая ссылка
Моренко М.П., Андриуца Н.С., Цымбал А.А. АКТУАЛЬНЫЕ АСПЕКТЫ ПАТОГЕНЕЗА РАЗВИТИЯ КОГНИТИВНЫХ НАРУШЕНИЙ ПОСЛЕ ПЕРЕНЕСЕННОГО COVID-19. РОЛЬ ЭНДОТЕЛИОПАТИИ, ГЕПЦИДИНА, ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ. «МОЗГОВОЙ ТУМАН» (BRAIN FOG). // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34121 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34121



