Введение. Липопротеиды (ЛП) плазмы крови, в силу их тесного взаимодействия с эндотелиальными клетками и высокой восприимчивости к окислительной модификации, являются идеальными биологическими «сенсорами» окислительного стресса в артериальной стенке [1-3]. Липопротеиды низкой плотности (ЛПНП) как основные переносчики холестерина (ХС) в крови, содержащие соответствующее количество полиненасыщенных жирных кислот (ПНЖК) - основного субстрата для перекисного окисления липидов, являются одной из молекулярных мишеней окислительного стресса, развивающегося в том числе при уремии [4; 5].
Окисленные ЛПНП (окЛПНП) способствуют развитию эндотелиальной дисфункции, образованию, прогрессированию и нестабильности атеросклеротических бляшек [6-8].
Основными механизмами реализации влияния окЛПНП на сосудистую стенку являются: хемотаксическое привлечение и активация моноцитов/макрофагов в артериальной стенке посредством индукции экспрессии молекулы межклеточной адгезии-1 (ICAM-1) и молекулы адгезии сосудистых клеток-1 (VCAM-1), быстрое поглощение окЛПНП макрофагами с последующим образованием пенистых клеток, стимуляция миграции и пролиферации гладкомышечных клеток (ГМК) в интиме сосуда, цитотоксичность в отношении эндотелиальных клеток, стимуляция адгезии и агрегации тромбоцитов путем снижения эндотелиальной продукции оксида азота [9; 10].
На терминальных стадиях хронической болезни почек (ХБП) активация оксидативного стресса в разы повышает интенсивность образования окЛПНП, причем повышенный уровень окЛПНП является фактором риска развития атеросклероза у больных на перитонеальном диализе, с почечным трансплантатом или гемодиализе, то есть сохраняет свою роль независимо от метода заместительной почечной терапии [11-13].
Целью данного исследования являются оценка факториального окружения окисленных липопротеидов низкой плотности у больных, находящихся на лечении гемодиафильтрацией, а также выявление взаимосвязи окисленных липопротеидов низкой плотности в крови с признаками метаболических и гемодинамических расстройств, поражением сосудистой стенки и развитием сердечно-сосудистых заболеваний.
Материал и методы исследования. Исследование было одномоментным, когортным, с ретроспективным анализом сердечно-сосудистых осложнений. Все проведенные исследования соответствовали стандартам этического комитета СОГМА по экспериментам на человеке и Хельсинкской декларации 1975 г. и ее пересмотренного варианта 2000 г. Пациенты подписали добровольное информированное согласие на участие в исследовании.
Критериям включения соответствовали пациенты с ХБП различного генеза 5Д стадии, находящиеся на лечении хронической гемодиафильтрацией (ГДФ), у которых проводилось исследование липидного профиля крови до старта заместительной почечной терапии (ЗПТ) и в процессе диализного лечения на фоне приема статинов или без их назначения.
Формирование внутригрупповых страт и подходы к рандомизации групп – свободный сплошной набор пациентов. В исследование не включались пациенты детского возраста с иными вторичными формами дислипидемии, кроме ХБП (патология щитовидной железы, нефротический синдром, болезни печени), пациенты с наследственными дислипидемиями.
В исследование было включено 103 пациента в возрасте 61,9±12,9 года (лиц мужского пола было 65, женского – 38). У всех пациентов была ХБП 5Д стадии и проводилась терапия ГДФ на протяжении от 2 лет до 21 года (в среднем 7,9±3,3 года). Продолжительность ХБП составила в среднем 17,4±3,3 года (от 6 до 33 лет). Артериальная гипертензия (АГ) регистрировалась у 77 пациентов, сахарный диабет (СД) – у 51 пациента.
Фиксировались сердечно-сосудистые осложнения, которые уже развились за период получения пациентами лечения ГДФ. Ряд осложнений анализировался самостоятельно либо в составе комбинированных точек. Учитывались следующие осложнения: хроническая сердечная недостаточность (ХСН) 2 или более ФК со сниженной или умеренно сниженной систолической функцией (15 событий: 7 – 2ФК, 8 – 3ФК); инфаркт миокарда (ИМ) (14 событий); хроническая ишемическая болезнь сердца (ХИБС) со стабильной стенокардией (3 события); мозговой инсульт (МИ, 5 событий); чрескожное коронарное вмешательство в виде ангиопластики со стентированием (ЧКВ/стентирование) (9 событий); признаки периферического атеросклероза (10 событий: 4 – стеноз почечных артерий, 6 – атеросклероз бедренных артерий).
В качестве комбинированных точек анализировались следующие: периферический атеросклероз + МИ (13 событий); ХИБС / стенокардия + ЧКВ / стентирование + ИМ (17 событий); ИМ + МИ + ХСН (17 событий).
Причины развития ХБП: диабетическая нефропатия – у 51 пациента, тубулоинтерстициальные нефриты и гломерулонефриты – у 36, гипертоническая нефропатия – у 13, поликистозная болезнь почек – у 3 больных. Только 45 пациентов получали статины: 41 – аторвастатин, 4 – розувастатин.
Наиболее распространенной формой дислипидемии был IIa тип по Фридриксену (82%), IIb тип наблюдался у 14% пациентов, III тип – у 2%, IV тип – у 2% больных.
Всем пациентам проводилось общеклиническое обследование, включавшее общий анализ крови, биохимический анализ крови (креатинин, мочевина до и после ГДФ, мочевая кислота, параметры электролитного обмена, % снижения уровня мочевины во время ГДФ, фосфор, фибриноген, С-реактивный белок (СРБ), кальций общий). Исследовали параметры липидограммы, выполненные как до старта ЗПТ, так и в ходе проведения исследования иммуноферментным методом: общий холестерин (ОХС), ХС-ЛПНП, ХС липопротеидов высокой плотности (ХС-ЛПВП), ХС-неЛПВП (холестерин, не связанный с ЛПВП), триацилглицериды (ТАГ, триглицериды). Определяли в крови содержание ЛП(а) – комплекса липопротеина низкой плотности и белка аполипопротеина – латексным турбидиметрическим методом, а окЛПНП – твердофазным иммуноферментным анализом. Рассчитывали индекс атерогенности ХС-неЛПВП/ХС-ЛПВП и предложенный нами индекс (ХС-неЛПВП/ХС-ЛПВП)*ЛП(а). Также в ходе исследования определяли концентрацию моноцитарного хемоаттрактантного протеина-1 (МСР-1) в крови.
В ходе эхокардиографического исследования оценивали выраженность кальцификации клапанов сердца по полуколичественной шкале оценки степени кальциноза для структур сердца согласно Национальным рекомендациям. Диагностику кальцификации брюшного отдела аорты осуществляли с помощью боковой обзорной рентгенографии брюшной полости. Степень кальцификации определяли с использованием шкалы Kauppilla, позволяющей оценивать степень тяжести кальцификации на уровне каждого отдельного сегмента.
Оценку нутритивного статуса проводили, определяя индекс массы тела (ИМТ) (по формуле – масса тела пациента (кг)/рост пациента (метр2)), окружность плеча (ОП, см), окружность талии (ОТ, см), толщину кожно-жировой складки над трицепсом (ТКЖСТ, см), объем мышц плеча (ОМП, см), уровень трансферрина крови, сывороточного альбумина и абсолютное содержание лимфоцитов в крови. Выраженность нутритивных расстройств с оценкой степени белково-энергетической недостаточности (БЭН) определяли по методу Bilbrey G.L., Cohen T.L. [14]. Скорость распространения каротидно-феморальной пульсовой волны (СРПВ, м/с) оценивали с помощью сфигмографии.
Размер выборки определялся по методу К.А. Отдельновой [15]. Статистический анализ проводили с помощью компьютерной программы Statistica 10.0 (StatSoftInc., США). Характер распределения количественных признаков в исследованной группе пациентов на ГДФ определялcя методом Колмогорова-Смирнова с поправкой Лиллиефорса. Использовались методы описательной статистики, а также корреляционный и логит-регрессионный виды анализа. Нулевую гипотезу отвергали при величине критерия значимости p≤0,05.
Результаты исследования и их обсуждение. Концентрация окЛПНП в обследованной когорте составила 116±42,7 МЕ/л и колебалась от 88 до 154 МЕ/л; при том, что нормальные значения окЛПНП в крови не превышают 120 МЕ/л. Практически половина пациентов имела повышенные значения данного показателя. Был проведен корреляционный анализ, позволивший выявить взаимосвязи окЛПНП с целым рядом изученных параметров (табл. 1).
Таблица 1
Корреляционные взаимосвязи окЛПНП с параметрами липидного и других видов обмена, а также гемодинамическими факторами
|
Показатель |
r (Spearmen) |
Показатель |
r (Spearmen) |
|
Возраст |
0,17 |
ТАГ до ЗПТ, ммоль/л |
-0,12 |
|
Длительность ХБП |
-0,03 |
Креатинин, мкмоль/л |
-0,06 |
|
Длительность ГДФ |
0,13 |
Мочевая кислота |
0,15 |
|
ОХС, ммоль/л |
0,62* |
% ↓ мочевины, ммоль/л |
0,15 |
|
ХС-ЛПНП, ммоль/л |
0,71* |
Общий белок, г/л |
0,13 |
|
ХС-ЛПВП, ммоль/л |
0,04 |
Ферритин, мкг/л |
0,01 |
|
ХС-неЛПВП, ммоль/л |
0,56* |
Гемоглобин, г/л |
-0,03 |
|
ХС-ЛПОНП, ммоль/л |
-0,25* |
Паратгормон, пг/мл |
-0,03 |
|
ТАГ, ммоль/л |
-0,21* |
Фосфор, ммоль/л |
-0,06 |
|
ЛП(а), ммоль/л |
0,69* |
СД |
0,08 |
|
Степень кальцификации клапанов |
0,21* |
Осмотичность плазмы |
0,06 |
|
Число случаев кальцификации клапанов |
0,22* |
ГГТП, нмоль/с*л |
-0,18 |
|
Степень кальцификации аорты |
0,20* |
СРБ, мг/л |
0,02 |
|
Число случаев кальцификации аорты |
0,21* |
HbA1c, % |
0,08 |
|
Кальцификация |
0,29* |
ИМТ, кг/м² |
0,22* |
|
ХС-неЛПВП/ХС-ЛПВП, ммоль/л |
0,45* |
Альбумин, г/л |
-0,01 |
|
(ХС-неЛПВП/ХС-ЛПВП)*ЛП(а) |
0,68* |
Трансферрин, г/л |
-0,15 |
|
ОХС до ЗПТ, ммоль/л |
0,05 |
ОТ*1,175(ПК), см |
0,26* |
|
ХС-ЛПНП до ЗПТ, ммоль/л |
0,07 |
ТКЖСТ, см |
0,18 |
|
ХС-ЛПВП до ЗПТ, ммоль/л |
-0,03 |
ОП, см |
0,20* |
|
ХС-ЛПОНП до ЗПТ, ммоль/л |
-0,19* |
ОМП, см |
0,20* |
|
ХС-неЛПВП до ЗПТ, ммоль/л |
0,02 |
БЭН, % |
-0,03 |
Примечания: * - р<0,05; ОХС – общий холестерин, ЛПНП - липопротеиды низкой плотности, ЛПВП - липопротеиды высокой плотности, ХС-неЛПВП - холестерин, не связанный с ЛПВП, ЛПОНП – липопротеиды очень низкой плотности, ТАГ – триацилглицериды, ЛП(а) – комплекс липопротеина низкой плотности и белка аполипопротеина, ЗПТ - заместительная почечная терапия, СД – сахарный диабет, ГГТП СРБ - С-реактивный белок, HbA1c – гликированный гемоглобин, ИМТ - индекс массы тела, ОТ*1,175(ПК) ТКЖСТ - толщина кожно-жировой складки над трицепсом, ОП - окружность плеча, ОМП - объем мышц плеча, БЭН - белково-энергетическая недостаточность.
Источник: составлено авторами по результатам данного исследования.
Было показано, что уровень окЛПНП ассоциировался с уровнем ХС-ЛПНП, что вполне закономерно, поскольку ХС-ЛПНП является основой для окислительной модификации с образованием окисленных форм. Отрицательная корреляционная связь с уровнями ХС-ЛПОНП и ТАГ объясняется тем, что уровень окЛПНП повышался преимущественно при IIа типе дислипидемии, при котором отмечается рост ХС-ЛПНП и сохранение нормальных значений ХС-ЛПОНП и ТАГ. Было также показано содружественное повышение уровней окЛПНП с ЛП(а).
Важной находкой являлось обнаружение связи уровня окЛПНП с сосудистой и клапанной кальцификацией, что отражает возможную роль окЛПНП в развитии кальцификации наравне с известными факторами у больных с уремической интоксикацией (гиперфосфатемией, гиперпаратиреозом, увеличением уровня в крови фактора роста фибробластов 23 (FGF-23 – fibroblast growth factor-23), эндотелиальной дисфункцией и др.). Также повышенный уровень окЛПНП в крови коррелировал с ожирением и абдоминальным отложением жира.
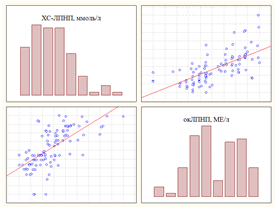
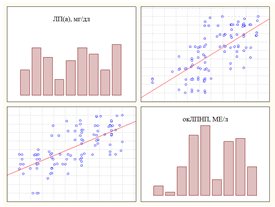
На рисунке 1 представлены примеры графического изображения взаимосвязи окЛПНП и ЛП(а), а также ХС-ЛПНП.
а) б)
Рис. 1. Графическое изображение: а) корреляционная взаимосвязь окЛПНП и ЛП(а); б) корреляционная взаимосвязь окЛПНП и ЛПНП
Источник: составлено авторами.
В ходе проведения логит-регрессионного анализа оценивали влияние повышенной концентрации окЛПНП в крови на вероятность выявления сердечно-сосудистых заболеваний и осложнений (табл. 2). Обращает на себя внимание тот факт, что уровень окЛПНП у больных на ГДФ оказался статистически связанным практически со всеми изученными событиями.
Таблица 2
Вероятность выявления комбинированной точки в зависимости от уровня окЛПНП
|
Комбинированная точка |
Const B |
Estimate (оценка) |
OR (range) |
χ2 |
р |
|
Кальцификация |
-2,32 |
0,01 |
11,22 |
61,9 |
0,009 |
|
Периферический атеросклероз+МИ |
-4,46 |
0,02 |
34,4 |
35,8 |
0,01 |
|
ЧКВ/стентирование |
-7,47 |
0,04 |
766,9 |
24,5 |
0,0005 |
|
ИМ |
-5,99 |
0,03 |
262,5 |
33,9 |
0,0002 |
|
МИ |
-6,99 |
0,03 |
197,6 |
17,5 |
0,02 |
|
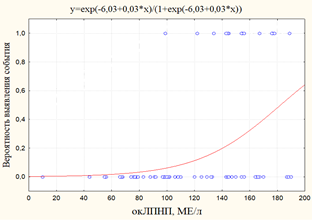
ХИБС+ЧКВ/стентирование+ИМ |
-6,03 |
0,03 |
383,3 |
37,0 |
<0,001 |
|
ИМ+МИ+ХСН |
-4,73 |
0,03 |
157,9 |
47,4 |
<0,001 |
Примечания: МИ - мозговой инсульт, ЧКВ - чрескожное коронарное вмешательство, ИМ - инфаркт миокарда, ХИБС - хроническая ишемическая болезнь сердца, ХСН - хроническая сердечная недостаточность.
Источник: составлено авторами по результатам данного исследования.
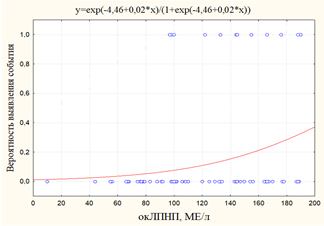
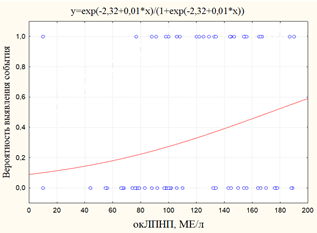
По мере роста концентрации окЛПНП возрастал риск выявления кальцификации аорты и клапанов сердца, периферического (рис. 2) и коронарного атеросклероза и его исходов (рис. 3), комбинированной точки в виде ИМ+МИ+ХСН (рис. 4).
а) б)
Рис. 2. Графики вероятности события: а) вероятность выявления кальцификации аорты и/или клапанов сердца в зависимости от уровня окЛПНП; б) вероятность выявления периферического атеросклероза+МИ в зависимости от уровня окЛПНП
Источник: составлено авторами.
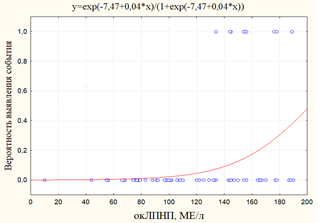
 а) б)
а) б)
Рис. 3. Графики вероятности события: а) вероятность выявления ЧКВ/стентирования в зависимости от уровня окЛПНП; б) вероятность выявления ХИБС+ЧКВ/стенокардия+ОИМ в зависимости от уровня окЛПНП
Источник: составлено авторами.
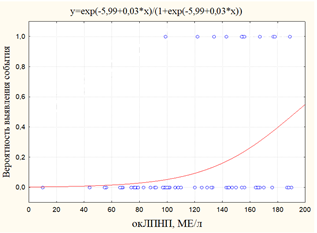
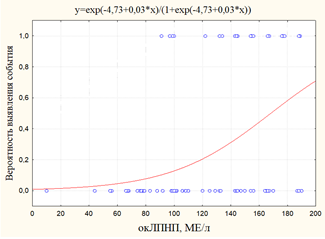
а) б)
Рис. 4. Графики вероятности события: а) вероятность выявления ИМ+МИ+ХСН в зависимости от уровня окЛПНП; б)вероятность выявления ИМ в зависимости от уровня окЛПН
Источник: составлено авторами.
Следует заметить, что отмечалось статистически значимое влияние уровня окЛПНП на вероятность выявления ИМ вне связи с другими событиями (рис. 4). Это, в свою очередь, указывает на необходимость учета повышенного уровня окЛПНП у больных на ГДФ в качестве возможного фактора риска развития ИМ.
Вероятным выводом из данного факта является то, что окЛПНП обладает статистически значимым негативным влиянием на функционирование сосудистой стенки, как в виде ее атеросклеротического поражения, так и кальцификации у больных на ГДФ. Значимый рост вероятности ИМ происходил при значениях окЛПНП более 150МЕ/л.
Также было показано статистически значимое влияние высокого уровня окЛПНП на вероятность выявления МИ вне ассоциации с другими исходами. Как и в случае с ИМ и комбинированными точками, риск выявления МИ возрастал при уровне окЛПНП более 150МЕ/л.
Для использования полученных данных в реальной клинической практике были разработаны номограммы, позволяющие прогнозировать вероятность сердечно-сосудистых событий в зависимости от уровня окЛПНП в крови (табл. 3).
Таблица 3
Номограммы прогнозирования вероятности выявления сердечно-сосудистых событий в зависимости от уровня окЛПНП в крови
|
Сердечно-сосудистое событие |
окЛПНП, МЕ/л |
|||||||
|
20 |
60 |
100 |
120 |
150 |
160 |
170 |
180 |
|
|
Риск кальцификации аорты и/или клапанов, % |
12 |
18 |
29 |
36 |
44 |
47 |
50 |
53 |
|
Риск атеросклероза+МИ, % |
3 |
7 |
9 |
12 |
16 |
19 |
23 |
29 |
|
Риск ЧКВ/стентирования, % |
1 |
3 |
5 |
7 |
16 |
18 |
23 |
30 |
|
Риск ХИБС+ЧКВ/стенокардия+ОИМ, % |
1 |
3 |
7 |
10 |
26 |
32 |
40 |
48 |
|
Риск ИМ+МИ+ХСН, % |
3 |
8 |
12 |
21 |
36 |
44 |
50 |
58 |
|
Риск ИМ, % |
1 |
2 |
6 |
9 |
20 |
27 |
33 |
40 |
|
Риск МИ, % |
1 |
2 |
4 |
6 |
8 |
9 |
12 |
18 |
Примечания: МИ - мозговой инсульт, ЧКВ - чрескожное коронарное вмешательство, ХИБС - хроническая ишемическая болезнь сердца, ОИМ - острый инфаркт миокарда, ИМ - инфаркт миокарда, ХСН - хроническая сердечная недостаточность.
Источник: составлено авторами по результатам данного исследования.
Как видно из таблицы 3, при значении окЛПНП 60 МЕ/л риск выявления, например, кальцификации аорты и/или клапанов сердца составляет 18%, тогда как при значении окЛПНП 180 МЕ/л – возрастает существенно до 53%.
Следует заметить, что окЛПНП играют важную роль в формировании атеросклероза. Проведенное исследование не только подтвердило это у больных на ГДФ, но и подчеркнуло важность оценки данного параметра в связи с рядом обстоятельств, способствующих окислению ЛПНП. В частности, при уремической интоксикации явления окислительного стресса значимо усиливаются. Важным является факт взаимосвязи повышенного уровня окЛПНП в крови с вероятностью выявления целого ряда признаков сосудистого поражения, как атеросклеротического генеза, так и вследствие кальцифицирующих процессов в сосудистой стенке на фоне уремии. Значения окЛПНП выше 150 МЕ/л следует рассматривать в качестве фактора риска сердечно-сосудистых осложнений у больных на ГДФ.
Заключение. Полученные данные свидетельствуют о том, что высокий уровень окЛПНП в крови обладает наиболее негативным влиянием на функционирование сосудистой стенки, как в качестве ее атеросклеротического поражения, так и кальцификации у больных на ГДФ. Повышение концентрации окЛПНП происходит у больных в содружестве с расстройствами липидного обмена и формированием дислипидемии IIа типа, ожирением и абдоминальным жироотложением. Уровень окЛПНП можно рассматривать в качестве фактора риска развития сердечно-сосудистых осложнений у больных с ХБП 5Д стадии, находящихся на лечении ГДФ.
Библиографическая ссылка
Газзаева С.А., Ремизов О.В., Астахова З.Т., Авсарагова А.З. ВЗАИМОСВЯЗЬ УРОВНЯ ОКИСЛЕННЫХ ЛИПОПРОТЕИДОВ НИЗКОЙ ПЛОТНОСТИ С ФАКТОРАМИ РИСКА И СЕРДЕЧНО-СОСУДИСТЫМИ ОСЛОЖНЕНИЯМИ У БОЛЬНЫХ С ДИСЛИПИДЕМИЕЙ И ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК 5 СТАДИИ, ПОЛУЧАЮЩИХ ЗАМЕСТИТЕЛЬНУЮ ПОЧЕЧНУЮ ТЕРАПИЮ МЕТОДОМ ГЕМОДИАФИЛЬТРАЦИИ // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34098 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34098



