Введение. Остеонекроз представляет собой группу патологических состояний неясной этиологии, исходом которых является нарушение метаболизма костной, хрящевой ткани и микроциркуляции в очаге возникновения с развитием вторичного остеоартрита прилежащего сустава. Наиболее часто данный патологический процесс поражает головку и мыщелки бедра, надмыщелки большеберцовой кости, головку плеча и таранной кости. Остеонекроз детского и подросткового возраста выделен в группу так называемых остеохондропатий, среди которых ведущее место занимает болезнь Легга-Кальве-Пертеса с частотой встречаемости 0,4-20,9:100000 [1-3].
Среди этиопатогенетических причин развития остеохондропатии выделяют идиопатический (возможно, гормонально-перегрузочный) спазм гладкомышечных клеток стенок артериол микроциркуляторного русла с переходом в ишемический стаз и локальный инфаркт губчатого вещества эпифиза и тканей костномозговых пространств на фоне избытка ионов кальция вследствие нарушений минерального гомеостаза. Увеличивается клеточная гипоксия, в том числе вследствие нарушений реологических свойств крови (локальная гиперкоагуляция), когда происходит увеличение необратимо измененных эритроцитов, что приводит вследствие гемолиза последних к высвобождению в системный кровоток прокоагулянтных факторов, еще более усиливающих их агрегацию. Это и способствует нарушению процессов транскапиллярного обмена и нарушениям венозного оттока из проксимального метаэпифиза бедра в условиях снижения способности мезенхимальных стволовых клеток костного мозга к дифференцировке, уменьшения экспрессии костного морфогенетического белка и усиления апоптоза остеобластов и остеоцитов. В результате проникновения в утолщенную головку соединительнотканных и хрящевых элементов с вновь образованными сосудами нарушается непрерывность субхондральной пластинки и эпифизарного хряща – наступает его фрагментация [4; 5].
Изменения клеточного метаболизма являются предметом поиска специфических молекулярных биомаркеров для диагностики ранних стадий остеохондропатии головки бедренной кости, верифицирующих развитие воспалительной реакции в ответ на некротический процесс. Значительный интерес представляют оценка исходной активности резорбтивных процессов, а также динамика молекулярных биомаркеров, в том числе в процессе локальной внутрисуставной терапии, особенно на ранних стадиях заболевания. Целевыми молекулярными биомаркерами-кандидатами являются описанные в литературе показатели костной резорбции – дезоксипиридинолин, С-концевые сшивающие телопептиды коллагена I и II типов, кальций-связывающего белка, которые могут использоваться как для диагностики, так и для оценки эффективности проводимой локальной внутрисуставной терапии остеохондропатии головки бедренной кости [6; 7].
Цель исследования. Определение информативных биомаркеров-кандидатов, позволяющих диагностировать и оценивать эффективность локальной внутрисуставной терапии ранних стадий остеохондропатии головки бедренной кости.
Материал и методы исследования
Эксперименты над животными проводились в соответствии: с Директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации», а также с учетом рекомендаций этического комитета СГМУ (протокол № 7 от 01.02.2022 г.).
Объект исследования: 61 особь обоего пола молодняка кроликов (возраст 3,5±0,5 месяца) мясо-шкуркового направления селекции – серый или бельгийский великан (фландр) с высокой физической активностью и массой тела 2,5±0,4 кг. При внешнем осмотре все кролики были активны, без признаков заболеваний (чистые склеры, нормальный цвет десен, языка и состояние зубов, без дефектов шкурки и анатомии). Распределение по группам происходило следующим образом: 16 животных были включены в группу «до эксперимента» (группа контроля); 26 – в группу «после эксперимента»; 19 – в группу «после лечения». Все кролики располагались в удобных клетках, получали полноценные корм (специальный комбикорм, овощи, травянистые растения, ветки деревьев и лозы винограда) и родниковую воду.
Моделирование остеохондропатии головки бедренной кости, осуществляемое по методике Слизовского Г.В. и соавт. (2017) [8], соответствовало I стадии костного дефекта согласно классификации Catterall (1971) без потери формы головки бедра. Всем животным до начала эксперимента (контрольная точка 1 – 1-е сутки эксперимента, до начала параартикулярного введения адреналина) осуществляли взятие крови из ушной вены. Через 30 дней (контрольная точка 2 – 30-е сутки эксперимента, окончание введения адреналина) всем кроликам выполняли повторное взятие крови, часть кроликов была выведена из эксперимента для визуальной макроскопической оценки стадии костного дефекта. Оставшимся кроликам проведено лечение в виде внутрисуставной инъекции обогащённой плазмы (platelet-rich plasma /PRP). Для этого из ушной вены изымали 5 мл крови в пробирку, в которую добавляли 1 мл цитрата натрия 3,8% (антикоагулянт) для стабилизации компонентов крови, осторожно смешивали его с кровью. Для получения PRP использовали центрифугу лабораторную LISTON C2204 PRP (ООО «Листон», Россия) на двух режимах: 1000 об./5 мин., затем 2000 об./3 мин. Данная методика двойной отработки плазмы на низких частотах была продиктована повышенной вязкостью крови у кроликов и большой шириной осмотической резистентности по сравнению с человеческой. Через 38 дней (контрольная точка 3 – 68-е сутки эксперимента) осуществляли финальное взятие крови, оставшаяся часть кроликов была выведена из эксперимента для визуальной макроскопической оценки стадии костного дефекта. Животных выводили из эксперимента путем гуманной эвтаназии физическими методами: с помощью метода оглушительного удара по голове или цервикальной дислокации.
Для иммуноферментного анализа использовали наборы реагентов в соответствии с инструкциями для определения коллагена I типа кролика (ELISA Kit for Collagen Type I (COL1)) 96 опр (SEA571Rb) (Cloud-Clone Corp., Китай); основного фактора роста фибробластов (ФРФ) 2 кролика (ELISA Kit for Fibroblast Growth Factor 2, Basic (FGF2)) 96 опр (SEA551Rb) (Cloud-Clone Corp., Китай); костной щелочной фосфатазы (КЩФ) «Enzyme-linked Immunosorbent Assay kit fore Alkaline phosphatase (ALPL)», (Cloud-Clone Corp., Китай). Определение оптической плотности осуществляли при длине волны 450 нм полуавтоматическим планшетным фотометром (лабораторный медицинский – «Stat Fax4200» Awareness Technology, США). Хранение образцов сыворотки крови животных осуществляли не более чем 6 месяцев при температуре -80°С в морозильной камере.
Статистическую обработку полученных данных осуществляли при помощи пакета программ Statistica 13.3. С целью выявить наличие статистически значимого различия между группами были выполнены сравнения в парах «до эксперимента» и «после эксперимента», «после лечения» и «до эксперимента», а также «после эксперимента» и «после лечения». Выборки представляли собой независимые группы (разные животные в разное время) и не составляли пару коррелирующих значений; распределение признаков в каждой выборке соответствовало нормальному распределению; дисперсии признаков в выборках были равны. Гипотезу для проверки нормальности распределений проверяли с помощью критерия Колмогорова, а дисперсии признаков с помощью F-критерия. На этом основании использовался t-критерий Стьюдента для независимых выборок (р<0,05).
Результаты исследования и их обсуждение. Сводные данные о значимости отличий групп «до эксперимента» / «после эксперимента» / «после лечения» представлены в таблице.
Примечательна динамика показателей ФРФ и коллагена I типа, которые демонстрировали минимальную разницу в группах «до и после эксперимента», но подтвердили статистически значимое отличие в группе «после лечения». В данном случае показатели «после лечения» стремились к показателям группы контроля, т.е. к экспериментальной норме.
Единственным показателем, показавшим статистически значимую разницу во всех группах исследования, является костная щелочная фосфатаза (КЩФ). Было зафиксировано значимое достижение уровня КЩФ до нормальных величин.
Описательные характеристики и результаты тестирования на различие средних в экспериментальных группах
|
Группы
Показатели |
До эксперимента n=16 |
После эксперимента n=26 |
После лечения n=19 |
|
Среднее, ДИ |
Среднее, ДИ |
Среднее, ДИ |
|
|
ФРФ, пг/мл |
40,09 (33,31-46,86) |
42,03 (37,16-46,90) p=0,622
|
30,73 (26,65-34,82) p=0,047 p*=0.011 |
|
Коллаген I типа, пг/мл |
96,32 (83,35-109,30) |
91,63 (85,24-98,03) p=0,453
|
73,85 (62,59-85,11) p=0,019 p*=0,006 |
|
КЩФ, пг/мл |
20,98 (18,04-23,91) |
17,01 (15,43-18,58) p=0,009
|
20,87 (17,71-24,02) p=0,959 p*=0,017 |
Примечания: p – значимость отличий группы от группы контроля (pre-experiment); p* – статистическая значимость отличий групп «после» друг от друга; при p<0,05 различие средних считается статистически значимым.
Источник: составлено авторами на основании собственных данных исследования.
Проверка гипотез о различии средних показала, что группы «после эксперимента» и «до эксперимента» статистически значимо различаются только по показателю КЩФ (p=0,009) (рис. 1).
С учетом современных исследований [9-11] предполагается, что первичные изменения в метаболизме костной ткани играют важную роль на ранних стадиях некроза головки бедренной кости, однако причинно-следственная связь остаётся неясной.
Признанные показатели метаболизма костной ткани обычно делятся на три категории: маркеры костного обмена, гормоны, регулирующие метаболизм костной ткани, и общие биохимические маркеры [12]. Эти показатели дают представление о динамическом состоянии скелетной системы, отражая текущие метаболические процессы.
Щелочная фосфатаза сыворотки крови в основном вырабатывается костями и печенью и широко используется в клинической диагностике различных заболеваний. КЩФ играет важнейшую роль в биоминерализации и считается биологическим маркером формирования костной ткани.
КЩФ, присутствующая в остеобластах, поставляет фосфат для отложения гидроксиапатита и может снижать уровень пирофосфата, тем самым способствуя росту костной ткани [13; 14]. Следовательно, при нормальной работе печени КЩФ может отражать активность остеобластов. В ретроспективном исследовании с участием 401 пациента с ОНФБ и 81 здорового человека у пациентов с остеонекрозом головки бедренной кости уровень щелочной фосфатазы в сыворотке крови был выше, чем у здоровых людей [15]. Схожие данные были получены во многих работах [16; 17]. К сожалению, причинно-следственные связи установить не удается, что подтверждается и другими авторами [10; 11].
В целом, настоящее исследование подтверждает значимую динамику КЩФ как маркера костного обмена при моделировании болезни Легга-Кальве-Пертеса. В то же время значимых колебаний показателей коллагена I типа и ФРФ не фиксировали; возможно, это связано с главным ограничением в представляемой работе – количеством лабораторных животных.
Продукты распада коллагена I типа отражают интенсивность костной резорбции [10]. ФРФ играет важную роль в костном метаболизме и является ключевым координирующим фактором, влияющим на гомеостаз костной ткани [18; 19].
Ряд работ показал, что β-ФРФ, воздействуя на остеобласты в высоких концентрациях, не только эффективно стимулирует образование костной ткани посредством индукции циклооксигеназы-2 и выработки простагландинов, но и стимулирует резорбцию костной ткани, тогда как в низких концентрациях он воздействует непосредственно на зрелые остеокласты, вызывая резорбцию костной ткани [19; 20]. Кроме того, отмечали, что стимуляция β-ФРФ вызывает высокий уровень экспрессии Sprouty2, подавляет экспрессию маркеров дифференцировки остеобластов, а также минерализацию матрикса остеобластов [21].
Предыдущие исследования показали, что β-ФРФ способен вызывать дифференцировку мезенхимальных стволовых клеток костного мозга в липогенные клетки [22; 23]. Эта индукция приводит к отложению жира внутри кости, вызывая структурные изменения в кости, которые влияют на кровоснабжение и механические свойства, что в конечном итоге приводит к остеонекрозу [24; 25]. Эта многогранная роль делает β-ФРФ активным участником развития и прогнозирования остеонекроза, открывая потенциальные возможности для терапевтических вмешательств.
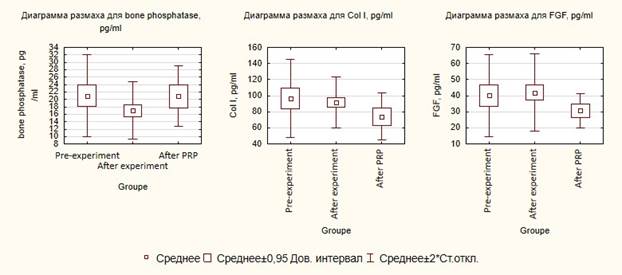
Диаграммы размаха для всех групп исследований по биомаркерам: 1 – до эксперимента (pre-experiment), 2 – после эксперимента (after experiment), 3 – после лечения (after PRP); bone phosphatase – костная фосфатаза, Col I – коллаген I типа, FGF – фактор роста фибробластов, pg/ml – пг/мл
Источник: составлено авторами на основании собственных данных исследования.
Таким образом, колебания коллагена I типа и ФРФ все-таки отмечались на каждом этапе: «до эксперимента», «после эксперимента» и «после лечения». Важным моментом является снижение уровней этих маркеров резорбции костной ткани после применения обогащённой плазмы. Неяркая динамика колебания КЩФ, возможно, обусловлена необходимостью более длительного наблюдения и большего масштаба лабораторного эксперимента.
К сожалению, авторы не нашли статистически значимых подтвержденных исследований, которые бы отслеживали динамику костных маркеров резорбции после лечения обогащённой плазмой.
Заключение. В настоящий момент потребность в малоинвазивном внутрисуставном лечении остеохондропатии головки бедра велика и востребована, и не только в детском возрасте. Представленное исследование стало одним из шагов к подбору метода оценки подобной терапии. Эффективным, на взгляд авторов, является мониторинг результатов с помощью специфических биомаркеров. Перспективными показателями на эту роль являются: маркер остеобластической функции – костная щелочная фосфатаза; маркер костной резорбции – коллаген I типа и цитокин, отражающий гомеостаз костного ремоделирования – ФРФ. В настоящей работе эти биомаркеры-кандидаты продемонстрировали значимые динамические изменения после лечения, что позволяет использовать их для мониторинга.
Конфликт интересов
Финансирование
Библиографическая ссылка
Сертакова А.В., Ульянов В.Ю., Садчиков Д.Д. ДИАГНОСТИКА И ОЦЕНКА ЭФФЕКТИВНОСТИ ЛОКАЛЬНОЙ ВНУТРИСУСТАВНОЙ ТЕРАПИИ РАННИХ СТАДИЙ ОСТЕОХОНДРОПАТИИ ГОЛОВКИ БЕДРЕННОЙ КОСТИ: ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34093 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34093



