Введение. По оценкам Всемирной организации здравоохранения, во всем мире сердечно-сосудистые заболевания (ССЗ) заняли ведущие места в этиологической структуре смертности населения, от них зарегистрировано более 17 млн ежегодных летальных исходов [1; 2]. В развитии этих заболеваний к одним из основных факторов риска отнесена артериальная гипертензия (АГ), которая в Российской Федерации выявлена более чем у 40% населения [3; 4]. Важно отметить, что осложнения от ССЗ унесли немало жизней людей молодого возраста, что стало большой социально-экономической проблемой [5]. Со времени начала изучения пато- и морфогенеза АГ миновало не одно столетие, однако до сегодняшнего дня и клиницисты, и ученые не прекратили исследовать тонкие триггерные механизмы ее формирования, а также, что более важно и актуально, последовательность процессов развития осложнений АГ в виде инфаркта миокарда, острых нарушений коронарного кровоснабжения, ишемической болезни [6; 7]. С точки зрения авторов, приведенные аргументы – свидетельства необходимости выработки современных подходов и дальнейшего определения всего разнообразия форм возникновения артериальной гипертензии и её тяжелых последствий.
К механизмам развития АГ и её осложнений в представленной работе авторы отнесли в первую очередь те, которые формируются на уровне клеток, составляющих мощный морфофункциональный взаимосогласованный ансамбль в сердце. Таковыми функционально значимыми и взаимосвязанными структурными элементами являются сократительные кардиомиоциты (КМЦ), эндотелиоциты сосудов, кардиальные тучные клетки (ТК) и полиморфноядерные лейкоциты крови (ПЯЛ), вырабатывающие множество различных биологически активных веществ. Авторы предположили, что между ними существуют межклеточные взаимодействия, которые обеспечивают поддержание постоянства структуры и функционирования тканей сердца, а рассогласование таких межклеточных коммуникаций может последовательно приводить к нарушениям информационных потоков и метаболических процессов, что ведет к разрушению внутриклеточных структур и гибели клеток. В связи с этим заслуживает внимания проблема изучения модулирующего влияния межклеточных взаимодействий в виде выделяемых различными видами клеток экстрацеллюлярных микровезикул на развитие повреждений тканей и органов, и в первую очередь КМЦ сердца при АГ.
Анализ литературных данных, а также материалы более ранних работ авторов показали, что в реализации механизмов гуморальной регуляции и компенсаторных реакций при действии различных патогенных факторов значительную роль играют лейкоциты крови. По существу, ни один из сдвигов гомеостаза организма не остается без участия нейтрофилов как преобладающего вида лейкоцитов. В то же время имеющиеся сведения о характере взаимодействия между ПЯЛ и клетками сердца (кардиальными эндотелиоцитами, КМЦ и периваскулярными ТК) на фоне АГ носят единичный характер [8; 9]. В тандеме межклеточных взаимодействий «эндотелиоциты-лейкоциты» сами эндотелиальные клетки, обладая крайне высокой метаболической и секреторной активностью, могут быть охарактеризованы как «сердечно-сосудистый эндокринный орган», осуществляющий связь в критических ситуациях между кровью и тканями [10]. «Катастрофы» в тканях сердца зачастую начинаются с развития дисфункции эндотелия капилляров и последующего изменения морфофункционального состояния сосудов микроциркуляторного русла (МЦР). При повышении функциональной активности лейкоциты могут провоцировать формирование эндотелиальной дисфункции, что приводит впоследствии к нарушению проницаемости сосудов и повреждению окружающих тканей за счет выделения активных форм кислорода. В связи с указанным фактом, по мнению авторов, одним из актуальных аспектов дальнейшего изучения патогенеза АГ явилось установление взаимосвязи изменений метаболического профиля ПЯЛ и развивающейся эндотелиальной дисфункции. Перемещаясь по соединительной ткани, активированные лейкоциты и ТК могут обмениваться информацией и индуцировать появление патологических реакций в миокарде, сопровождающихся повышением АД. В этом случае определенное значение могут иметь экстрацеллюлярные микровезикулы, выделяющиеся клетками в окружающую среду и служащие транспортировщиками сигналов межклеточной коммуникации. Способность везикул переносить различные сигнальные молекулы, включая белки, липиды и нуклеиновые кислоты, позволяет им модулировать клеточные функции и участвовать в ответах на патогенные воздействия и стрессы [11].
Таким образом, обобщая имеющиеся данные, авторы предположили, что в тканях сердца формируются специфические межклеточные взаимоотношения между ПЯЛ, КМЦ, ТК и эндотелиальными клетками – важнейшими структурными элементами, которые обеспечивают многочисленные функции сердца не только в норме, но и при возникновении повреждений. Понимание характера этих межклеточных взаимодействий, а также нарушения их согласованности помогут расширить сведения о патогенезе АГ, что делает актуальной тему данной работы.
Целью исследования явилось изучение морфофункциональных изменений, которые происходят в ансамбле важнейших взаимосвязанных клеток сердца: сократительных КМЦ, эндотелиоцитов сосудов, кардиальных ТК и ПЯЛ крови, в ответ на стрессорное воздействие при гипертонической болезни.
Материал и методы исследования. В представляемой работе использованы животные линии НИСАГ (с наследственной индуцированной стрессом артериальной гипертензией), которые в настоящее время признаны одной из адекватных моделей изучения АГ у человека [12]. Опыты выполнены на 40 взрослых крысах-самцах массой 230-280 г. Интактные гипертензивные крысы этой же линии (15 шт.) служили контрольной группой. Эксперименты над животными проводились в соответствии с Директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации», а также с учетом рекомендаций этического комитета СГМУ. Экспериментальные животные подвергались комбинированному воздействию стрессорных факторов (иммобилизация и акустический раздражитель) в течение двух часов по предложенному авторами способу [13]. До и после эксперимента у неанестезированных животных проводили измерение уровня систолического АД в хвостовой артерии автоматическим плетизмографическим методом электросфигмоманометром Natsum КН-209 (Япония). Из эксперимента животных выводили декапитацией.
Характер и степень морфологических нарушений в миокарде авторы анализировали после проведения общепринятых и специальных гистологических методик. С целью выявления метаболических изменений применяли окрашивание срезов сердца по J.T.Liе (гематоксилин-основной фуксин-пикриновая кислота), а также по Маллори и по Гейденгайну. Контрактурные изменения в рабочих КМЦ определяли при помощи поляризационной микроскопии. После окраски поперечных срезов сердца толуидиновым синим оценивали морфофункциональное состояние тучных клеток (по Крамеру и Виндруму). В полиморфноядерных лейкоцитах периферической крови гистохимическими методами выявляли содержание гликогена (ШИК-реакция по McManus) и липидов (суданом черным по Sheehan), активность АТФ-азы (по Wachstein - Meisel), сукцинатдегидрогеназы (СДГ по Mahlas в модификации Р.П. Нарциссова) и миелопероксидазы (МП по Graham - Knoll). Определение лизосомальных катионных белков (ЛКБ) проводили с использованием метода Пигаревского. Об изменении состояния функциональной активности лейкоцитов судили по НСТ-тесту. Показатели среднего цитохимического коэффициента (СЦК) высчитывали по Astaldi и Verga. Статистическую обработку результатов проводили с помощью программы MS Excel. Для подтверждения нормальности распределения использовался критерий Шапиро – Уилка. При описании результатов статистической обработки использовали среднее значение величины и его стандартное отклонение M±m. Существенность отличий между двумя независимыми группами (опытной и контрольной) определяли с помощью t-критерия Стьюдента с уровнем значимости р<0,001, р<0,01.
Результаты исследования и их обсуждение. В ходе экспериментов авторами было установлено, что комбинированное прерывистое воздействие иммобилизации и акустического раздражителя на гипертензивных крыс в течение двух часов провоцировало увеличение высоты артериального давления со 160,2±8,6 до 198,4±6,4 мм рт. ст. (р<0,001). После стресса в средней оболочке сердца и папиллярных мышцах выявлялись очаги резкого локального полнокровия, более выраженные в миокарде левого желудочка. Полнокровие сосудов МЦР было вызвано как достоверным расширением просвета самых мелких сосудов - капилляров с 3,98±0,5 до 6,67±0,3 мкм на единицу площади среза (р<0,001), так и увеличением почти в 2 раза числа капилляров, содержащих эритроциты, т.е. функционирующих (с 9,2±0,5, до 17,4±1,2, р<0,001). В некоторых сосудах наблюдались локальные расширения просвета сосудов, чередующиеся с сужением их диаметра, что указывало на выраженные проявления дистонии стенки, возникающие при стресс-индуцированных колебаниях уровня АД. Результатом нарушения вазомоторной функции сосудов явилась гипоксия КМЦ, определяемая специальными гистологическими методами. В частности, метод поляризационной микроскопии позволил выявить нарушения механизмов сокращения и расслабления миофибрилл сократительных КМЦ. Об этом свидетельствовали локальные контрактурные повреждения сердечной мышечной ткани различной степени (от фрагментарной контрактуры отдельных КМЦ до необратимых повреждений мышечных волокон), которые обнаруживались в глубоких слоях миокарда. Вокруг мелких спазмированных артерий, а также около микрососудов с признаками эритростаза, располагались отдельно лежащие поврежденные КМЦ, или группы из них. О нарушении обменных процессов между кровью и функционально значимыми структурными элементами сердца свидетельствовало плазмопропитывание, характеризующееся появлением фрагментов стенки артериол, окрашивающихся в черный цвет (по Гейденгайну) или оранжевый (по Маллори). В мелких венах также наблюдались изменения в виде локального отека стенки с нечеткими контурами. Кроме того, в эндотелиальной выстилке микрососудов обнаруживались участки с повышенной активностью АТФ-азы. Проявления дисфункции эндотелия выражались в появлении в просвете некоторых сосудов микроциркуляторного русла множества округлых увеличенных в размерах десквамированных эндотелиоцитов.
На основании ранее проведенного авторами исследования состояния метаболического профиля лейкоцитов у интактных нормо- и гипертензивных крыс было установлено, что генетически детерминированная АГ сопровождалась выраженными изменениями внутриклеточных метаболических процессов в лейкоцитах: содержание гликогена было снижено на 23% (р<0,001). При этом была достоверно снижена активность АТФ-азы и МП при незначительной активации СДГ [8].
После воздействия стрессорных раздражителей на гипертензивных крыс содержание гликогена в нейтрофилах крови снизилось на 25% (р<0,001) по сравнению с исходными показателями контрольной группой животных с АГ (рис.). Повышение активности АТФ-азы в лейкоцитах крови на 26% (р<0,001) свидетельствовало об интенсификации энергопотребляющих процессов. В то же время уменьшалась активность МП ‑ на 27% (р<0,001) и СДГ ‑ на 18% (р<0,001). Выраженного влияния стресса на количество липидов и уровня лизосомальных катионных белков (ЛКБ) в лейкоцитах не выявлено. Важно подчеркнуть, что необратимые повреждения КМЦ могли быть спровоцированы достоверным увеличением ПЯЛ с положительной реакцией на НСТ-тест, при которой активируется их цитотоксической потенциал, что может способствовать нарушению проницаемости мембран не только КМЦ, но и эндотелиоцитов, и тучных клеток.
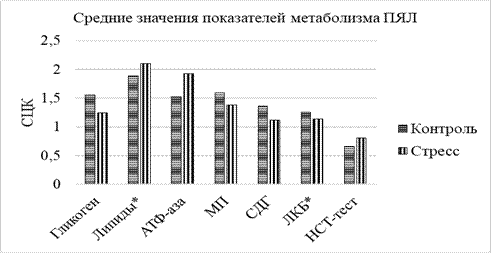
Изменение метаболизма ПЯЛ у гипертензивных крыс при стрессе с использованием среднего цитохимического коэффициента
Примечание: знаком* отмечены показатели, не имеющие достоверных отличий от контроля.
Изучение морфофункционального состояния тучно-клеточной популяции сердца у интактных гипертензивных животных показало, что общее число лаброцитов на поперечных срезах сердца равнялось 25,8±1,7; из них: недегранулирующие клетки составили 30,5±2,6%, умеренно дегранулирующие– 54,2±3,7% и с максимальной степенью дегрануляции – 16,8±1,5%. После стрессорного воздействия общее количество ТК в миокарде гипертензивных крыс достигало 35,5±1,7(р<0,001), доля клеток без признаков дегрануляции – 38,4±2,2% (р<0,02), и почти в два раза увеличился процент активно дегранулирующих лаброцитов – 30,4±1,9% (р<0,001). Примечательно, что процентное содержание умеренно дегранулирующих ТК в популяции уменьшилось почти в два раза и составило 32,5±1,7% (р<0,001).
Таким образом, авторами работы установлено, что при комбинированном 2-часовом стрессе в миокарде гипертензивных крыс изменялось морфофункциональное состояние одних из быстрореагирующих клеток – лаброцитов. Важно отметить, что число дегранулирующих тучных клеток при этом увеличилось почти в 2 раза. Следствием нарушения регуляторных механизмов указанного звена (локальное повышение проницаемости сосудистой стенки и изменение вязкости крови) явилось прогрессирование геморрагических и ишемических процессов в сердце.
При проведении сравнительного анализа в более ранних исследованиях авторами был сделан вывод, что у гипертензивных крыс под влиянием стресса, по сравнению с опытными нормотензивными животными, формировались более значительные кардиоваскулярные повреждения. Важно отметить, что при наличии артериальной гипертензии в сердце экспериментальных животных обнаружены крупноочаговые кровоизлияния с изменениями морфофункциональных показателей проницаемости стенки сосудов миокарда, сопровождавшиеся плазмопропитыванием и дисфункцией эндотелия [14].
Результаты, полученные авторами в текущей работе, позволили также констатировать, что в формировании реакции на альтернативное воздействие, в которой принимают непосредственное участие кардиомиоциты и эндотелиальные клетки сосудов миокарда, значительную роль играют и форменные элементы крови –ПЯЛ, а также тучные клетки. Такая связь может быть обусловлена гистогенетическим и функциональным родством этих клеточных элементов и их взаимными модулирующими воздействиями. Лейкоциты, эндотелиоциты и ТК являются активными продуцентами и проводниками ряда биологически активных веществ и гормонов, что особенно важно и необходимо для выработки адекватной ответной реакции тканей и систем при воздействии патогенных факторов. Эти клетки синтезируют ряд соединений, обладающих сосудосуживающими и сосудорасширяющими, антибактериальными, иммуномодулирующими свойствами, а также выделяют цитокины, хемокины, кислородзависимые и кислороднезависимые биоцидные факторы. Следует учитывать, что степень повреждения стенки сосудов во многом зависит и от баланса окислительно-метаболической функции нейтрофилов. В то же время изменения структурной организации сосудистых оболочек и процессов синтеза в них биологически активных медиаторов, безусловно, оказывали влияние на проявление функциональной активности лейкоцитов при посредстве компонентов метаболизма арахидоновой кислоты и простагландинов, выделяющихся эндотелиоцитами. Стресс-индуцированное повышение активности лейкоцитов могло интенсифицировать процессы, при которых из них выделяются биологически активные метаболиты, приводящие к альтерации эндотелиального слоя сосудов. При этом нарушается проницаемость сосудистой стенки, в результате в миокарде образовывались геморрагические очаги разных размеров. Развитию эндотелиальной дисфункции могло также способствовать и обнаруженное у животных экспериментальной группы достоверное уменьшение в лейкоцитах активности МП, которая, по сути, является антиоксидантом. Можно полагать, что изменённые при стрессе цитохимические межклеточные взаимодействия явились причиной обнаруженных тяжелых кардиоваскулярных нарушений в сердце при гипертонии.
Другим значимым фактором в контексте рассматриваемой проблемы, по мнению авторов, могли явиться и наследственно обусловленные предшествующие изменения важнейших морфофункциональных и метаболических показателей в изучаемых клетках сердца и крови на фоне артериальной гипертензии.
Заключение. На основании проведенных исследований авторы констатировали, что стресс-индуцированные изменения баланса активности в ансамбле функционально значимых клеточных элементов сердца при генетически обусловленной артериальной гипертензии могут являться триггерным механизмом, провоцирующим развитие тяжелых осложнений в виде ишемии, инфаркта миокарда, острых нарушений кровообращения сердца и других заболеваний. Очевидно, что дальнейшее изучение взаимосвязи изменений метаболического профиля лейкоцитов, степени эндотелиальной дисфункции, функциональной активности кардиальных тучных клеток и сократительных КМЦ на фоне артериальной гипертензии и при различных формах её осложнений является перспективным и целесообразным направлением для проведения многосторонних клинико-диагностических изысканий.
Библиографическая ссылка
Романова Т.П., Бугаева И.О., Перевозникова Т.В., Уварова И.А., Шаповал О.Г. МЕХАНИЗМЫ ФОРМИРОВАНИЯ СТРЕССОРНОГО ОТКЛИКА ОСНОВНЫХ ВИДОВ КЛЕТОЧНЫХ ЭЛЕМЕНТОВ СЕРДЦА ПРИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ) // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34085 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34085



