Введение
Современные методы диагностики и лечения патологий женской репродуктивной системы основаны на достижениях фундаментальных наук, связанных с исследованием молекулярно-генетических механизмов, которые оказывают влияние на овариальный резерв [1–3].
Этот показатель играет ключевую роль в женской фертильности, а его преждевременное снижение может стать причиной трудностей с зачатием и раннего наступления менопаузы [4]. Репродуктивные нарушения обусловлены генетическими, аутоиммунными и эпигенетическими факторами, включая неслучайную инактивацию Х-хромосомы [5].
Инактивация Х-хромосомы представляет собой эпигенетический процесс, при котором у женщин одна из двух Х-хромосом становится неактивной. Это необходимо для дозовой компенсации генов, отвечающих за синтез половых гормонов, и предотвращения их избыточной экспрессии. В нормальных условиях инактивация происходит случайным образом в каждой клетке, но в некоторых случаях наблюдается неслучайная инактивация, когда преимущественно инактивируется одна и та же Х-хромосома [6, 7].
Неслучайная инактивация может приводить к нарушению синтеза половых гормонов, включая прогестерон, эстрогены, пролактин и андрогены, что связано с различными нарушениями в работе женской репродуктивной системы, такими как преждевременная недостаточность яичников, синдром поликистозных яичников, привычное невынашивание беременности, бедный ответ на стимуляцию овуляции, бесплодие [8]. Соотношение инактивации Х-хромосом в диапазоне от 50:50 до 79:21 считается случайным, тогда как значения от 80:20 до 100:0 указывают на смещенную (или неслучайную) инактивацию. Причинами последней могут быть генетические изменения в структуре Х-хромосомы или патогенные варианты гена XIST [6]. Некоторые исследователи выделяют диапазон умеренного сдвига инактивации, определяя его как 65–80%. Однако в литературе описано недостаточно исследований, изучающих влияние промежуточных изменений инактивации Х-хромосом на гормональный профиль пациентов [9].
Х-хромосома содержит важные гены, играющие ключевую роль в регуляции функции яичников, включая FMR1, BMP15, FOXL2 и FIGLA. В последнее время активно изучается влияние гена FMR1 (Fragile X Messenger Ribonucleoprotein 1) на фолликулогенез, что открывает новые перспективы для понимания механизмов, регулирующих репродуктивную функцию у женщин [10]. Ген ломкой Х-хромосомы (FMR1) расположен в дистальной части длинного плеча Х-хромосомы человека и содержит повторяющиеся триплеты CGG в своем 5’-нетранслируемом участке [11].Согласно критериям, установленным ACMG (American College of Medical Genetics’ Standards and Guidelines), количество повторов CGG может быть классифицировано как нормальное (от 5 до 44), промежуточное (от 45 до 54), премутация (от 55 до 199) и полная мутация (более 200) [12]. Полная мутация гена FMR1 приводит к инактивации гена и отсутствию синтеза белка FMRP (РНК-связывающего белка), который участвует в регуляции трансляции, транспортировке мРНК, что приводит к нарушениям в работе синапсов и развитию синдрома ломкой Х-хромосомы [13]. Премутация FMR1 встречается чаще и связана с синдромом тремор/атаксии у мужчин, а также с преждевременной недостаточностью яичников (FXPOI – первичная овариальная недостаточность, ассоциированная с синдромом ломкой Х-хромосомы) и снижением овариального резерва (FXDOR – снижение овариального резерва, ассоциированное с синдромом ломкой Х-хромосомы) [12].
Патогенез FXPOI и FXDOR остается неясным. Предполагается, что избыточные транскрипты FMR1обладают мРНК-токсичностью, а длинные повторы CGG инициируют RAN (Repeat associated non-AUG)-трансляцию (при которой трансляция начинается без стандартного старт-кодона AUG), приводящую к образованию токсичных FMRP [14, 15].
Кроме того, у носительниц премутации повышена чувствительность клеток яичников к оксидативному стрессу, что ускоряет гибель этих клеток [16]. Клетки гранулезы могут иметь сниженное количество рецепторов фолликулостимулирующего гормона (ФСГ), что ухудшает их реакцию на ФСГ и приводит к его повышению [13].
Исследование влияния неслучайной инактивации Х-хромосомы и предэкспансии гена FMR1 на женскую репродуктивную систему является крайне актуальным в свете возрастающей распространенности репродуктивных расстройств и генетических заболеваний. Понимание механизмов, стоящих за этими генетическими изменениями, может раскрыть их роль в патогенезе заболеваний, связанных с нарушением фертильности, а также повлиять на возможность ранней диагностики и разработки индивидуализированных подходов к лечению. Помимо прочего, работа в данном направлении может способствовать улучшению методов планирования семьи и профилактики генетических заболеваний, что является важной задачей современного общества.
Цель исследования - определить уровень инактивации Х-хромосомы и количество тринуклеотидных повторов в гене FMR1 у женщин с различными метаболическими и гормональными показателями.
Материалы и методы исследования
Дизайн исследования: одноцентровое одномоментное сравнительное исследование.
В исследование были включены 47 женщин в возрасте от 21 до 44 лет, наблюдавшихся в клинике ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России. Критерии включения: женщины репродуктивного возраста, подписавшие информированное согласие. Критерии исключения: наличие новообразований любой локализации, беременность, лактация, ранняя/хирургическая менопауза, синдром поликистозных яичников, любые хронические заболевания в стадии декомпенсации, оперативные вмешательства на органах малого таза, химио- или лучевая терапия в анамнезе, прием комбинированных оральных контрацептивов в течение последних 6 месяцев. Выборка формировалась случайным способом на основании медицинского осмотра, включавшего сбор анамнеза, определение антропометрических и лабораторных показателей в соответствии с заданными критериями.
Всем участникам было проведено исследование сыворотки крови на следующие показатели: антимюллеров гормон (АМГ) на 3–5-й день менструального цикла, фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), эстрадиол, пролактин – методом иммунохемилюминесцентного анализа (Beckman Сoulter, США); лептин – методом иммуноферментного анализа (Diagnostics Biochem Canada), адипонектин – методом иммуноферментного анализа (RayBio США), андростендион – методом иммунохемилюминесцентного анализа (Elisa Kit, Китай). За референсные показатели были приняты следующие значения: АМГ – 0,07–3,39 нг/мл, ФСГ – 3,5–12,5 мМЕ/мл, ЛГ – 2,4–12,6 мМЕ/мл, эстрадиол – 68–1269 пмоль/л, лептин – 1,1–27,6 нг/мл, адипонектин – 18–39 мкг/мл, пролактин – 126,0–574,5 мЕд/л, андростендион – 1,06–12,0 нмоль/л. Снижение овариального резерва определялось по следующим критериям: общее количество антральных фолликулов <10, концентрация АМГ <1,2 нг/мл, концентрация ФСГ >10 мМЕ/мл, концентрация эстрадиола ≥294 пмоль/л [17,18].
Всем пациентам проводили определение неслучайной инактивации Х-хромосомы и определение количества тринуклеотидных повторов в гене FMR1. Исследование количества CGG-повторов в гене FMR1 выполняли с использованием фрагментного анализа на генетическом анализаторе НАНОФОР («Синтол», Россия) в соответствии с инструкцией производителя прибора. Перед проведением фрагментного анализа регион с вариабельным числом CGG-повторов был амплифицирован с использованием фланкирующих праймеров, меченных флюоресцентной меткой, и химерных праймеров, позволяющих идентифицировать протяженные предэкспансии и экспансии. Расчет количества CGG-повторов производили с учетом размера праймеров и регионов, прилегающих к CGG-повторам. Праймеры и условия реакции могут быть высланы по запросу.
Оценку уровня инактивации Х-хромосомы проводили с помощью метода метилчувствительной количественной флуоресцентной ПЦР генов AR и RP1 с использованием фермента Hpa II и последующего фрагментного анализа. Расчет полученных результатов проводили в соответствии с работой Allen и соавторов, 1992 [19].
Статистический анализ проводили с использованием программы StatTech v. 4.8.0 (разработчик – ООО «Статтех», Россия). Количественные признаки были представлены в виде среднего арифметического значения ± стандартное отклонение (при нормальном распределении значений признака) или в виде медианы (25-й; 75-й перцентили) при распределении, отличающемся от нормального. Межгрупповое сравнение значений количественных признаков проводили с применениемt-критерия Стьюдента иU-теста Манна–Уитни соответственно. Сравнение частотных показателей в независимых выборках выполнено с помощью критерия Пирсонаχ², а при числе наблюдений в одной из ячеек четырехпольной таблицы <5 – с помощью точного критерия Фишера. Корреляционные связи и различия сравниваемых показателей считали статистически значимыми прир<0,05.
Результаты исследования и их обсуждение
Обследованы 47 женщин репродуктивного возраста. Средний возраст пациентов составил 31,15±5,82 года.
Среди исследуемых у 6 пациентов была обнаружена неслучайная инактивация Х-хромосомы, у 14 – умеренный сдвиг инактивации и у 27 процент инактивации соответствовал нормальным значениям. По результатам исследования пациенты были разделены на три группы: со случайной инактивацией Х-хромосомы, с умеренным сдвигом (более 65%) и группа пациентов с неслучайной инактивацией (более 80%). Значимых различий по возрасту и индексу массы тела в группах пациентов зафиксировано не было. Средний возраст в группе со случайной инактивацией составил 30,7±6,24 года, в группе с умеренным сдвигом – 32,8±4,88 года, в группе с неслучайной инактивацией – 28,67±5,05 года. В ходе проведения статистического анализа не было обнаружено корреляционной связи между концентрацией АМГ и ФСГ с уровнем инактивации Х-хромосомы. Однако были зафиксированы значимые различия по уровню пролактина в группах с различным уровнем инактивации Х-хромосомы. Результаты анализа представлены в таблице 1.
Таблица 1
Гормональные показатели женщин с различным уровнем инактивации Х-хромосомы
|
Показатели |
Группы по инактивации |
p |
||
|
Группа 1 (случайная инактивация) |
Группа 2 (умеренный сдвиг) |
Группа 3 (неслучайная инактивация) |
||
|
Пролактин, мЕд/л, Me [IQR] |
250,50 [220,50; 309,36] |
212,50 [170,00; 230,82] |
323,16 [269,00; 450,00] |
0,013 |
|
Эстрадиол, пмоль/л, Me [IQR] |
136,00 [94,00; 187,50] |
156,00 [103,50; 204,50] |
115,00 [107,25; 125,75] |
0,618 |
|
АМГ, нг/мл Me [IQR] |
1,41 [0,90; 2,50] |
2,73 [0,86; 4,05] |
1,66 [1,60; 1,70] |
0,560 |
|
ФСГ, мМЕ/мл, Me [IQR] |
6,90 [5,45; 7,65] |
6,35 [5,50; 7,22] |
5,50 [5,00; 5,90] |
0,429 |
|
Андростендион, нмоль/л, Me [IQR] |
6,70 [5,79; 8,20] |
6,90 [4,82; 8,29] |
6,66 [5,43; 8,64] |
0,882 |
Примечание: составлено авторами.
Женщинам со сниженным овариальным резервом (АМГ<1,2 нг/мл) проводили оценку количества тринуклеотидных повторов в гене FMR1, для расчета брали аллель с максимальным числом повторов. Случаев предэкспансии гена FMR1 выявлено не было. Однако в ходе оценки корреляционных взаимосвязей была подтверждена отрицательная корреляционная связь между количеством тринуклеотидных CGG повторов в гене FMR1 и уровнем андростендиона (r= –0,391; p=0,03) (рис. 1). Данный анализ подтверждает гипотезу о том, что при увеличении предэкспансии на 1 единицу следует ожидать уменьшения концентрации андростендиона на 0,22 нмоль/л.

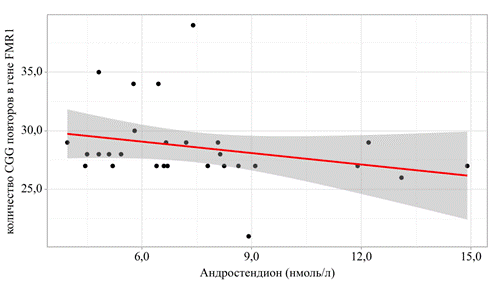
Рис. 1. График регрессионной функции, характеризующий зависимость уровня андростендиона от количества CGG повторов в гене FMR1 (составлено авторами)
Часть пациентов имели избыточную массу тела и ожирение – 45,7% (n=21). Пациенты были распределены на три группы в зависимости от индекса массы тела: группу «а» составили женщины с нормальной массой тела, группу «б» – с избыточной массой тела, группу «в» – пациенты с ожирением. Распределение показателей адипоцитокинов – лептина и адипонектина – и количества тринуклеотидных повторов в гене FMR1 у пациентов с различным индексом массы тела представлено в таблице 2. Значимых различий по количеству CGG повторов в группах обследованных женщин зафиксировано не было, однако результаты анализа показали наличие отрицательной корреляционной связи между количеством тринуклеотидных CGG повторов в гене FMR1 и уровнем адипонектина (r= –0,450; p=0,01) (рис. 2).
Таблица 2
Адипоцитокины и количество CGG повторов в гене FMR1 в группах с различным индексом массы тела
|
Показатели |
Группа «а» |
Группа «б» |
Группа «в» |
р |
|
Группа по ИМТ |
Нормальная масса тела |
Избыточная масса тела |
Ожирение |
|
|
количество CGG повторов в гене FMR1, Me [IQR] |
28,50 [27,00; 29,00] |
29,00 [27,00; 30,00] |
28,00 [27,00; 29,00] |
0,647 |
|
Лептин, Me [IQR] |
10,21 [6,88; 15,65] |
38,71 [31,50; 51,70] |
60,64 [34,82; 99,60] |
<0,001* |
|
Адипонектин (пг/мл), Me [IQR] |
1591,21 [1469,58; 2418,85] |
1348,76 [826,44; 1476,68] |
798,97 [429,36; 841,88] |
0,010* |
Примечание: составлено авторами.
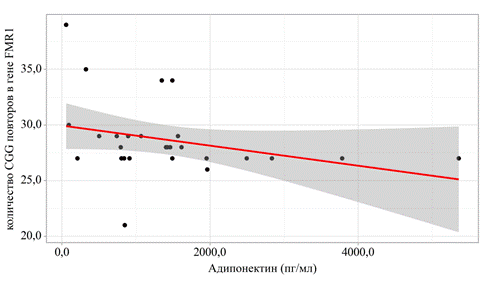
Рис. 2. График регрессионной функции, характеризующий зависимость уровня адипонектина от предэкспансии гена FMR1 (составлено авторами)
В данном исследовании женщины не имели диагноза синдрома ломкой Х-хромосомы, однако выявлена корреляция между числом повторов CGG в FMR1и уровнем адипонектина. Таким образом, результаты, полученные в ходе данного исследования, могут доказывать ассоциацию увеличения количества тринуклеотидных повторов, находящихся даже в пределах референсного диапазона, со снижением уровня протективного адипоцитокина – адипонектина. Вероятно, подобные результаты в будущем позволят расширить наши представления о формировании различных нарушений метаболического профиля. Патогенетически возможные механизмы могут включать митохондриальную дисфункцию, окислительный стресс и расстройства сигнальных путей инсулинового ответа, обусловленные аномальной экспрессией FMRP [Ошибка! Источник ссылки не найден.].
В научной литературе были описаны результаты исследования уровня адипоцитокинов у мужчин с синдромом ломкой Х-хромосомы. В соответствии с ними было показано, что у данной группы пациентов уровень адипонектина был ниже по сравнению с группой здоровых лиц [Ошибка! Источник ссылки не найден.]. Стоит отметить, что подобные исследования с участием женщин не проводились. Эти данные подчеркивают важность дальнейших исследований, направленных на изучение роли FMR1в регуляции метаболизма и возможных терапевтических стратегий для носителей премутации.
В отношении влияния предэкспансии на гормональный профиль, в частности на андрогены, также имеются некоторые данные. В настоящем исследовании была выявлена обратная связь между количеством CGG повторов и уровнем андростендиона, что может быть обусловлено снижением текальной активности и уменьшением его синтеза, а также гиперметилированием промотора гена FMR1 и снижением экспрессии FMRP, ответственного за стероидогенез. Исследования показывают, что у женщин с предэкспансией FMR1 часто повышены уровни андростендиона и тестостерона [Ошибка! Источник ссылки не найден., Ошибка! Источник ссылки не найден.].
С увеличением интереса к исследованию репродуктивного здоровья возрастает внимание к факторам, которые могут влиять на его состояние. Однако истинные причины патофизиологических изменений до сих пор недостаточно исследованы, а текущие методы диагностики часто оказываются не вполне эффективными. Молекулярно-генетические особенности обследуемых могут стать надежными индикаторами прогноза фертильности, позволяя более детально выявлять причины бесплодия.
Встречаемость неслучайной инактивации в популяции составляет 1,5–7% [Ошибка! Источник ссылки не найден.]. Известно, что неслучайная инактивация Х-хромосомы выявляется у каждой второй пациентки с фенотипом гиперандрогении, избыточная экспрессия андрогенов оказывает влияние на функцию яичников и приводит к различным нарушениям репродуктивной функции [8]. В данной работе обнаружена связь между неслучайной инактивацией X-хромосомы и уровнем пролактина, однако корреляция с андрогенами не была выявлена. Это может указывать на поэтапное развитие гиперандрогении, поскольку известно, что гиперпролактинемия способна повышать уровень мужских половых гормонов у женщин [Ошибка! Источник ссылки не найден.].
На сегодняшний день остается недостаточно изученным вопрос о том, каким образом смещение инактивации Х-хромосомы от случайной к неслучайной влияет на гормональные показатели у женщин без явной патологии. Неравномерная инактивация генов, регулирующих уровень пролактина, которые находятся на Х-хромосоме, вероятно, является основным механизмом, влияющим на уровень этого гормона и других гормональных нарушений. Будущие исследования помогут определить, является ли неслучайная инактивация фактором риска гиперпролактинемии, приводящей к гормональному дисбалансу и развитию снижения репродуктивной функции.
Современными и актуальными темами исследований являются ген FMR1, а также механизмы и процессы, ассоциированные с его активностью. Ген FMR1 экспрессируется во многих тканях, включая ооциты и клетки гранулезы [Ошибка! Источник ссылки не найден.]. Важно отметить, что женщины с премутацией FMR1 имеют повышенный риск метаболических нарушений, включая ожирение, оксидативный стресс, нарушение энергетического обмена, гормональный дисбаланс [Ошибка! Источник ссылки не найден.]. Кроме того, премутация связана с повышенным риском преждевременной недостаточности яичников и снижением овариального резерва, что подтверждается исследованиями, показывающими повышение уровня ФСГ у женщин с премутацией [Ошибка! Источник ссылки не найден.].
Таким образом, можно предполагать стадийность развития гиперандрогении, формирование которой обусловлено сочетанием генетических и эпигенетических факторов. Это вполне может объяснять полученные в данном исследовании результаты изолированного влияния количества CGG повторов на концентрацию андростендиона.
Заключение
Формирование и поддержание репродуктивной функции основывается на широком спектре процессов, происходящих в организме женщины. Помимо аутоиммунных, гинекологических и системных заболеваний, ятрогенных вмешательств (операций), химиотерапии и воздействия окружающей среды, значительную роль в снижении фертильности играют молекулярно-генетические факторы. Современные исследования в области эпигенетики и клеточной терапии в перспективе могут предложить новые методы сохранения фертильности у женщин с неслучайной инактивацией Х-хромосомы.
Библиографическая ссылка
Азизова К.В., Волкова А.Р., Халимов Ю.Ш., Дора С.В., Ермолинская Т.С., Назаров В.Д., Банина Д.Ю., Лапин С.В., Мазинг А.В., Блинова Т.В. ГЕНЕТИЧЕСКИЕ И ЭПИГЕНЕТИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ГОРМОНАЛЬНЫЙ И МЕТАБОЛИЧЕСКИЙ ПРОФИЛЬ ЖЕНЩИН РЕПРОДУКТИВНОГО ВОЗРАСТА: РОЛЬ ИНАКТИВАЦИИ Х-ХРОМОСОМЫ И CGG ПОВТОРОВ В ГЕНЕ FMR1 // Современные проблемы науки и образования. 2025. № 3. ;URL: https://science-education.ru/ru/article/view?id=34078 (дата обращения: 27.01.2026).
DOI: https://doi.org/10.17513/spno.34078



