Введение
В настоящее время использование липосомальных форм лекарственных средств успешно реализуется в различных областях медицинской практики – кардиологии, онкологии, дерматологии, неврологии и в то же время остается открытой темой для продолжения изучения и совершенствования таргетной терапии различных заболеваний [1, 2]. Основными преимуществами липосомальных форм лекарственных средств являются увеличение их биодоступности, биодеградируемость и иммунологическая нейтральность, а также целевой транспорт лекарств и достижение эффективной концентрации препарата в клетке-мишени при различных патологических состояниях [3, 4]. Сами липосомальные частицы рассматриваются как самостоятельные факторы коррекции патологических процессов за счет модификации фосфолипидного окружения ионных каналов, мембранных рецепторов и ферментов [5]. Учитывая, что простые липосомальные формы лекарств быстро удаляются из кровотока системой мононуклеарных фагоцитов с преимущественным накоплением в печени [6, 7], использование липосомальных форм цитостатиков может усиливать их гепатотоксичность [8]. Учитывая, что важную роль в реализации токсических свойств противоопухолевой терапии, в том числе гепатотоксичности, играет усиление свободнорадикальных процессов [9] и подавление пролиферативной активности «здоровых» клеток, актуальным представляется использование в качестве гепатопротектора ксимедона, обладающего антирадикальной активностью и способностью усиливать репаративные процессы [10, 11], а внедрение его в липосомы может усилить целевую доставку и защиту печеночных клеток от повреждения по сравнению с водораствормой формой этого лекарственного средства.
Цель работы – сопоставить воздействие ксимедона внутри липосом и его водного раствора на функциональное состояние печени (активность аланиновой и аспарагиновой трансаминаз, гаммаглутамилтранспептидазы, лактатдегидрогеназы, уровень альбуминов, мочевины и общего билирубина в сыворотке крови) при введении липосомной «доксорубицин-циклофосфамид» комбинации крысам с карциномой Уокер-256.
Материалы и методы исследования
В работе использовали 91 крысу Вистар (самки, которые весили от 160 до 250 г.), содержащихся в стандартных условиях вивария «МГУ им. Н.П. Огарёва». С животными работали по правилам «Руководства по уходу и использованию лабораторных животных» (Guide for the care and use of laboratory animals) [12]. Взвесь опухолевых клеток Уокер-256 (106 клеток) инъецировали подкожно в проксимальную часть хвоста (№1 – группа контроля У-256). Использовали концентрат антрациклинового антибиотика доксорубицина («Ebewe Pharma», Австрия), предназначенный для внутрисосудистого введения, который разводили на физрастворе до концентрации 0,04% и осуществляли внутривенную инъекцию (4 мг/кг массы животного в боковая хвостовую вену) однократно на 11 день после моделирования неоплазии в сочетании с алкилирующим цитостатическим средством циклофосфамидом («Baxter oncology», Германия) в виде порошка, растворенного в физрастворе до концентрации 0,45% и вводимого (45 мг/кг) вслед за доксорубицином через катетер (№2 – группа c получением водного раствора доксорубицина и циклофосфамида – В «Д-Ц»). Липосомы, в которые совместно заключали цитостатические средства доксорубицин и циклофосфамид в аналогичных дозах (№3 – группа с получением доксорубицина с циклофосфамидом, заключенных в липосомальные наночастицы, – Л «Д-Ц»), готовили из лецитина и холестерина с последующей пассивной загрузкой цитостатиков (использовали роторный испаритель Heidolph (Германия) и экструдер LIPEX (Канада) и вводили так же, как водорастворимую комбинацию цитостатических средств. Оценку липосомных наночастиц проводили на спектрофотометре Shimadzu (Япония).
Ксимедон (субстанция, «Кристалл», Россия) использовали после растворения в физрастворе до концентрации 10% и инъецировали ежедневно в вену (50 либо 100 мг/кг) сразу после введения Л «Д-Ц» комбинации в течение 5 суток (№4 и 5 – группы с водным раствором ксимедона – ВРК 50/100 мг/кг соответственно).
Ксимедон внутри липосом с концентрацией 50 либо 100 мг/мл вводили в вену сразу после введения Л «Д-Ц» комбинации в тех же дозах, как его водный раствор, в течение 5 суток (№6 и 7 – группы с липосомной формой ксимедона – ЛФК 50/100 мг/кг соответственно). Таким образом, в эксперименте участвовало 7 групп животных (n=12), отдельную группу составили интактные крысы (И, n=7).
После введения противоопухолевой комбинации на 3 и 7 сутки 6 особей животных из каждой группы подвергали эвтаназии под общей анестезией золетилом и рометаром. Использовали сыворотку крови, в которой оценивали активность аланиновой и аспарагиновой трансаминаз (АЛТ и АСТ), гамма-глутамилтранспептидазы (ГГТП), лактатдегидрогеназы (ЛДГ), концентрацию альбуминов и мочевины, уровень общего белка и билирубина на автоматическом биохимическом анализаторе BS-480 Mindray (КНР). Статобработку проводили с расчетом средних арифметических значений (М) и их ошибок (m). Достоверность различий рассчитывали с использованием U-критерия Манна-Уитни. Различия считали статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
В 3 группе через 3 дня после введения Л «Д-Ц» активность АЛТ снижалась на 53,5% (р<0,05) относительно интактных крыс и на 56% (р<0,05) – относительно В «Д-Ц» (2 группы), а спустя 7 дней была на 32,5% ниже интактного уровня (р<0,05, рис. 1, А). Активность АСТ при этом не изменялась во всех группах с животными (рис. 1, Б).
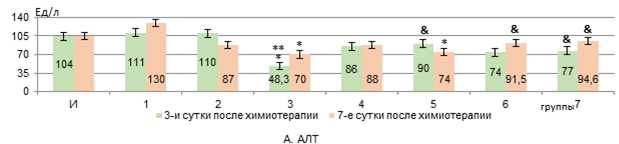
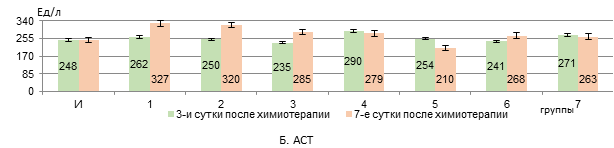
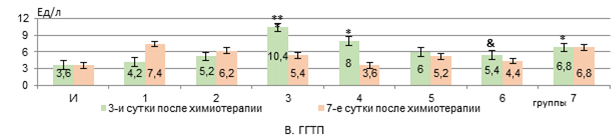
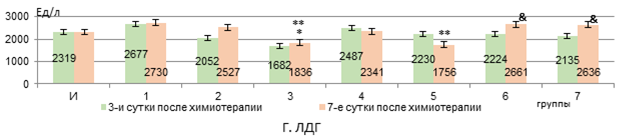
Рис. 1. Изменения активности сывороточных АЛТ, АСТ, ГГТП и ЛДГ у животных с У-256 после введения ксимедона (водного, липосомного) и доксорубицина с циклофосфамидом, заключенных в липосомальные наночастицы (А-Г)
Примечание: здесь и далее представлены средние значения показателей и стандартная погрешность, *- статистически значимо к интактным крысам, **- статистически значимо к группе 2; &- статистически значимо к группе 3 (р<0,05). И – интактные крысы; 1 – У-256; 2 – В «Д-Ц»; 3 – Л «Д-Ц»; 4 – ВРК 50 мг/кг; 5 – ВРК 100 мг/кг; 6 – ЛФК 50 мг/кг; 7 – ЛФК 100 мг/кг. Составлен авторами на основе собственных данных.
ВРК (100 мг/кг) у крыс из 5 группы через 3 дня от начала введения после инъекции Л «Д-Ц» препятствовал снижению активности АЛТ (прирост на 86% к 3 группе, р<0,05), однако, через 7 дней активность АЛТ все же снижалась на 29% к интактной уровню.
ЛФК в дозе 50 мг/кг только через 7 дней после введения Л «Д-Ц» восстанавливал активность АЛТ (прирост на 31% к 3 группе, р<0,05), а в дозе 100 мг/кг – препятствовал снижению активности АЛТ уже на 3 день после инъекции Л «Д-Ц» (прирост на 58% при сравнении с 3 группой, р<0,05, рис. 1, А).
В 3 группе через 3 дня после введения Л «Д-Ц» активность ГГТП повышалась в 2,8 раза (р<0,01) относительно интактных крыс и в 2 раза (р<0,05) – относительно В «Д-Ц» (2 группы), а через 7 дней не отличалась от интактного уровня (рис. 1, В).
ВРК только в дозе 100 мг/кг сохранял активность ГГТП на уровне показателя параметра в обеих временных точках оценивания.
ЛФК 50 мг/кг уже на 3 сутки после введения Л «Д-Ц» снижал активность ГГТП на 48% (р<0,05) и в дальнейшем, на 7 сутки, она сохранялась на первоначальном уровне. Доза 100 мг/кг ЛФК не препятствовала росту активности ГГТП на 3 день после введения Л «Д-Ц» – активность была выше на 89% (р<0,05) при сравнении с интактными крысами, и сохранялась такой же к 7 суткам (рис. 1, В).
Активность ЛДГ снижалась в 3 группе через 3 дня после введения Л «Д-Ц» на 27,4% в сравнительном аспекте с интактными животными, а к 7 дню была еще и ниже показателя у 2 группы на 27% (р<0,01, рис. 1, Г).
Обе вводимых дозы ЛФК к 7 суткам после применения Л «Д-Ц» восстанавливали активность ЛДГ до интактного уровня (рис. 1, Г).
Через 3 дня после введения Л «Д-Ц» уровень альбуминов снижался на 34% к интактным крысам, через 7 дней – на 21% (р<0,05, рис. 2, А).
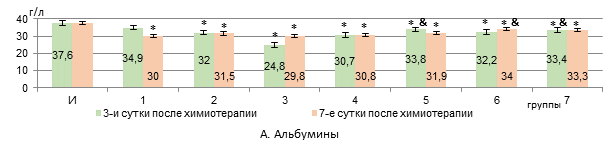
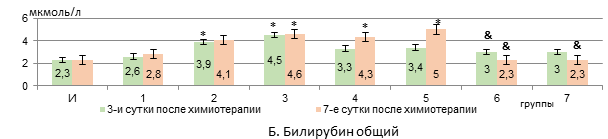
Рис. 2. Изменения в уровне сывороточных альбуминов, билирубина общего и мочевины у животных с У-256 после введения ксимедона (водного, липосомного) и доксорубицина с циклофосфамидом, заключенных в липосомальные наночастицы (А-В).
Составлен авторами на основе собственных данных
ВРК и ЛФК в дозе 100 мг/кг через 3 дня от начала введения после инфузии Л «Д-Ц» одинаково наращивали уровень альбуминов по сравнению с 3 группой (прирост на 35-36%, р<0,05), однако, к 7 суткам уровень альбуминов в сыворотке крови статистически значимо нарастал к показателю 3 группы на 14% только в 6 группе крыс на фоне ЛФК (50 мг/кг) (рис. 2, А).
Общий билирубин нарастал после введения Л «Д-Ц» через 3 и 7 дней на 96% и 99% соответственно относительно интактных крыс (р<0,05). ЛФК, в отличие от ВРК, в обеих дозах снижал уровень билирубина общего и через 7 дней он возвращался к исходному (был в 2 раза меньше, чем в 3 группе, рис. 2, Б).
Концентрация мочевины через 3 дня после введения Л «Д-Ц» была ниже в 2,5 раза (р<0,001) относительно интактных крыс и в 2 раза (р<0,01) – относительно В «Д-Ц», а через 7 дней – на 35% ниже относительно интактных крыс (р<0,05, рис. 2, В). ВРК и ЛФК в обеих исследуемых дозах одинаково эффективно корригировали уровень мочевины на 3 (прирост на 63-69% на фоне водного раствора и на 86-90% на фоне липосомной формы) и 7 сутки после введения цитостатических средств в липосомной форме.
Следовательно, доксорубицин и циклофосфамид, инкапсулированные в липосомальные частицы, оказывают более выраженное токсическое действие на печень, чем введение их водного раствора, и это находит свое отражение в подавлении синтетической функции печени (нарушения в метаболизме белков и свободных аминокислот и их синтеза, а также синтеза мочевины), проявляясь не только в виде уменьшения уровня альбуминов и мочевины, но и снижения активности АЛТ и ЛДГ, а также росте маркеров холестаза – активности ГГТП и общего билирубина. Отсутствие роста активности аминотрансфераз и ЛДГ в крови, по нашему мнению, может объясняться не только угнетением биосинтетической функции клеток печени, но и вероятной сохранностью мембран гепатоцитов, поскольку доксорубицин и циклофосфамид вызывают повреждение гепатоцитов в основном через индукцию перекисного окисления липидов и апоптоза, а не некроза [13, 14]. Снижение активности аминотрансфераз на фоне токсического поражения печени соединениями с противоопухолевой активностью отмечалось и в работе Додоховой М.А. и соавт. [15].
Ксимедон в обеих вводимых формах в дозе 50 мг/кг препятствует снижению активности АЛТ и ЛДГ через 3 дня после использования цитостатических средств в липосомах (статистически значимая нормализация их активности к 7 суткам – при использовании формы липосом). Ксимедон, инкапсулированный внутри липосом, в отличие от его водного раствора, в дозе 100 мг/кг дольше препятствует снижению активности АЛТ и ЛДГ, а в дозе из расчета 50 мг/кг – статистически значимо повышает на 7 сутки уровень альбуминов в крови. Содержание мочевины в крови корригируется обеими используемыми формами ксимедона. Активность ГГТП снижается на 3 сутки только при использовании липосом, содержащих 50 мг/кг ксимедона. Его водный раствор оказывает временный эффект по сдерживанию роста уровня общего билирубина в крови – только на 3 сутки, а в виде липосом – в обеих дозах снижает его уровень дольше (в дозе 50 мг/кг – быстрее – на 3 сутки). Все это говорит о более выраженном гепатопротекторном эффекте инкапсулированного в липосомальные частицы ксимедона, и наиболее сбалансированный корригирующий эффект отмечается на дозе 50 мг/кг. Вероятно, липосомная форма оптимизирует реализацию гепатопротекторного действия ксимедона, что более эффективно позволяет корригировать биосинтетическую функцию печени и проявления холестаза в меньшей дозе. Возможно, целенаправленная доставка с помощью липосом позволяет ксимедону накапливаться в высоких концентрациях в клетках печени и митохондриях, эффективнее защищая их от повреждения [16].
Заключение. Таким образом, разбалансировка активности АЛТ, ЛДГ (их снижение) и ГГТП (повышение) в сочетании со снижением концентрации альбуминов, мочевины и ростом уровня общего билирубина в сыворотке крови после введения в вену антрациклинового антибиотика доксорубицина и алкилирующего цитостатика циклофосфамида, инкапсулированных совместно в липосомальные частицы, отражает усиление дисфункции печени и отчетливо проявляется уже к 3 суткам после их введения.
Коррекция наибольшего числа измененных показателей функционального состояния печени (АЛТ, ГГТП, ЛДГ, альбумины, мочевина, общий билирубин) отмечается при внутривенном введении ксимедона, инкапсулированного в липосомальные частицы, в дозе 50 мг/кг. В этой указанной форме и дозе он обладает наибольшим потенциалом гепатопротекторного воздействия относительно его водорастворимой формы. Доза 100 мг/кг инкапсулированного в липосомальные частицы ксимедона не обладает превосходством над дозой 50 мг/кг в коррекции функционального состояния печени при использовании комбинации цитостатических средств в липосомах.
Библиографическая ссылка
Шиндяйкина В.С., Сипров А.В., Вашуркина И.М., Зимина М.Ю., Романова Э.В. СРАВНЕНИЕ ВЛИЯНИЯ ЛИПОСОМНОЙ ФОРМЫ И ВОДНОГО РАСТВОРА КСИМЕДОНА НА ФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ПЕЧЕНИ ПРИ ВВЕДЕНИИ ЛИПОСОМНОЙ АНТРАЦИКЛИН-АЛКИЛИРУЮЩЕЙ КОМБИНАЦИИ КРЫСАМ С ЭКСПЕРИМЕНТАЛЬНОЙ НЕОПЛАЗИЕЙ // Современные проблемы науки и образования. 2025. № 2. ;URL: https://science-education.ru/ru/article/view?id=34045 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/spno.34045




