Введение
Артроскопия коленного сустава представляет собой одну из наиболее распространенных и эффективных хирургических методик, применяемых для лечения различных внутрисуставных патологий. Разрывы менисков, как причина оперативного вмешательства, составляют до 60%. По данным международной литературы, ежегодно в мире выполняется более 2 миллионов артроскопий по поводу разрыва мениска, что подтверждается данными Европейского регистра [1; 2], при этом частичная резекция мениска рассматривается как «золотой стандарт» хирургического лечения разрывов мениска в течение многих лет [3]. Артроскопия коленного сустава, обладая высокой эффективностью, имеет минимальные риски, поскольку осложнения при артроскопической резекции встречаются редко и не превышают, по данным литературы, 4,7% [4-6].
Одним из наименее ожидаемых осложнений после артроскопической резекции мениска является развитие постартроскопического синдрома, характеризующегося болевым синдромом, отеком мягких тканей, синовитом коленного сустава и отеком субхондральной кости мыщелков бедренной или большеберцовой костей, что может быть обнаружено по данным МРТ в период от нескольких недель до нескольких месяцев после операции [7; 8].
В литературе обсуждаются различные факторы, способствующие развитию постартроскопического синдрома. К числу наиболее значимых относят предшествующие дегенеративные изменения гиалинового хряща, нарушение оси конечности, ятрогенные травмы сустава и чрезмерная резекция мениска, приводящая к увеличению нагрузки на суставную поверхность. Также важную роль уделяют возрасту, массе тела и наличию хронических заболеваний у пациента. Опасность данного состояния заключается в риске прогрессирования с развитием остеонекроза мыщелков бедренной или большеберцовой костей и необходимостью в последующем эндопротезирования коленного сустава [9-11].
Этиология и патогенез постартроскопического синдрома до сих пор до конца не изучены, что создает определенные трудности в прогнозировании его течения и оценке эффективности терапевтических методов лечения. В связи с этим возникла необходимость в исследовании факторов риска, способствующих развитию данного синдрома, а также в разработке мер по его профилактике у пациентов, которые готовятся к оперативному вмешательству по поводу разрыва мениска. Понимание этих аспектов имеет ключевое значение для улучшения исходов лечения и повышения качества жизни пациентов.
Цель исследования: провести анализ встречаемости постартроскопического синдрома у пациентов после частичной резекции мениска и выявить факторы, способствующие его развитию и прогрессированию.
Материалы и методы исследования
В период с 2021 по 2024 год исследование включало проспективный и ретроспективный анализ данных пациентов с повреждением менисков. В проспективную группу включен 61 пациент (средний возраст 61,4±13,8 года) с разрывом мениска коленного сустава. 40,9% повреждений были вызваны травмами, 59,1% - дегенеративными процессами. Оперативное вмешательство выполнялось одной опытной хирургической бригадой для исключения ятрогении и влияния опыта хирурга на результат. Через 2 месяца после операции всем пациентам выполнялось контрольное МРТ-исследование, по данным которого 55 пациентов (90,2%) не имели реакции субхондральной кости (группа 1), у 6 пациентов (9,8%) отмечался отек субхондральной кости мыщелков (группа 2), рис. 1.
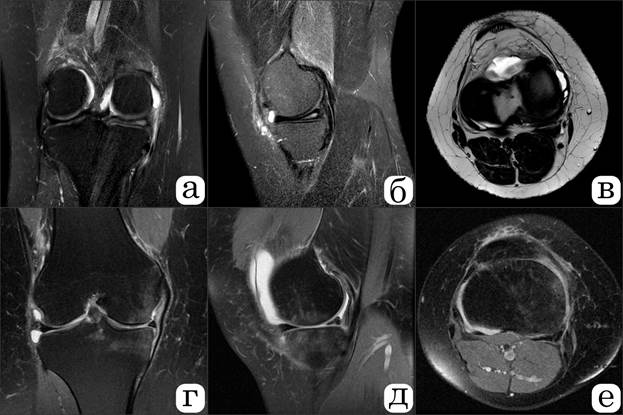
Рис. 1. МР-томограммы правого коленного сустава пациентки В. с разрывом медиального мениска в режиме PD с подавлением сигнала от жировой ткани: а, б, в – корональная, сагиттальная и аксиальная проекции до оперативного вмешательства; г, д, е – корональная, сагиттальная и аксиальная проекции через 2 месяца после выполнения резекции внутреннего мениска, с развитием постартроскопического синдрома и отека субхондральной кости внутреннего мыщелка бедренной и большеберцовой костей
Ретроспективная группа (группа 3) включала 23 пациента (2 мужчин (9%) и 21 женщина (91%), средний возраст в группе составил 70,2±12,8 года) с постартроскопическим остеонекрозом мыщелков бедренной и большеберцовой костей. В этой группе 17,6% разрывов произошли в результате травмы, 82,4% - на фоне дегенеративных изменений. Пациенты проходили лечение в НМИЦ травматологии и ортопедии имени Н.Н. Приорова (рис. 2).
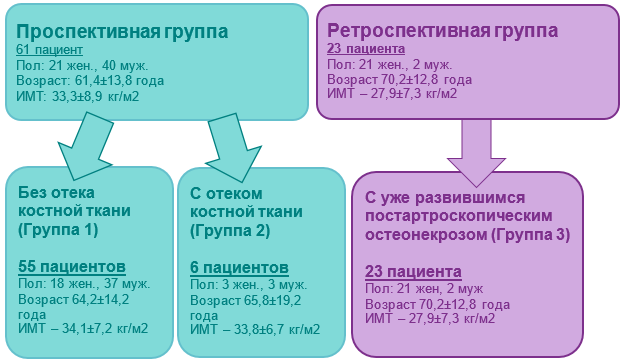
Рис. 2. Дизайн исследования. Распределение пациентов по группам
Всем пациентам проспективной группы в предоперационном периоде проводили лабораторное исследование крови и мочи с целью определения уровня основных маркеров костного ремоделирования. Пациентам ретроспективной группы лабораторное исследование крови и мочи выполнялось в послеоперационном периоде после выявления отека костной ткани на магнитно-резонансной томографии коленного сустава.
Анализировали следующие показатели - маркеры резорбции костной ткани: дезоксипиридинолин в моче (ДПИД) является перекрестной пиридиновой связью, в зрелом коллагене костной ткани и не подвергающейся дальнейшим метаболическим превращениям. Выход ДПИД в сосудистое русло из кости происходит в результате ее разрушения (резорбции) остеокластами - разрушение коллагена. ДПИД выводится с мочой в свободной форме (около 40%) и в связанном с пептидами виде (60%). ДПИД в настоящее время считается одним из самых надежных маркеров резорбции кости, так как он является специфическим продуктом распада коллагена, что делает его хорошим индикатором процесса резорбции в костной ткани, позволяет отслеживать динамику заболевания и эффективность лечения, а также позволяет оценить ответ на терапию при использовании препаратов, направленных на снижение резорбции костной ткани [12]. B-cross laps в крови – это продукт деградации коллагена 1-го типа, который составляет более 90% органического матрикса кости. Является маркером резорбции костной ткани. Маркеры костеобразования: остеокальцин в крови - это зависимый неколлагеновый белок костного матрикса, связывающий кальций и гидроксиапатиты, является показателем метаболизма костной ткани и используется для диагностики метаболических нарушений в ней. Он синтезируется остеобластами костной ткани. Основная часть синтезированного белка входит в состав внеклеточного матрикса костной ткани, который затем минерализуется с образованием новой кости, а оставшаяся часть попадает в кровоток. Является одним из основных маркеров костеобразования [13]. P1NP в крови - представляет собой один из маркеров, отражающих активность формирования костной ткани (маркер костеобразования). Органический матрикс кости представлен преимущественно коллагеном 1-го типа (90% коллагена 1-го типа содержится в костной ткани), который образуется из проколлагена 1-го типа, синтезируемого фибробластами и остеобластами. N-концевой пропептид проколлагена 1-го типа высвобождается в межклеточное пространство и кровоток в процессе образования коллагена 1-го типа и его встраивания в матрикс кости [14]. 25-OH витамин D - основной метаболит витамина D, присутствующий в крови. Паратиреоидный гормон - это полипептид, который вырабатывается в паращитовидных железах и обеспечивает поддержание нормальной концентрации ионов кальция в крови. Продукция и секреция паратгормона зависят от концентрации Ca2+ в плазме крови, а также от уровня активной формы витамина D – 1,25(ОН)2D3, фосфора и магния в крови [15].
Результаты исследования и их обсуждение
При анализе распределения пациентов по полу было установлено, что в первой группе мужчин значительно больше, чем женщин. В группах с отеком костной ткани (группы 2 и 3) статистически значимо преобладали женщины (р<0,001). Различий по возрасту между группами не выявлено (р=0,29), все пациенты были старше 50 лет. Значения индекса массы тела (ИМТ) различались между группами (р=0,019); в третьей группе ИМТ был значительно ниже, но все же указывал на избыточный вес. Наиболее частым диагнозом был разрыв медиального мениска, без различий между группами. Причины разрыва не повлияли на формирование отека костной ткани (р=0,19). Наличие синовита и продолжительность операции также не оказали влияния на отек (р=0,71 и р=0,31 соответственно). Таким образом, женский пол, возраст старше 50 лет и повышенный ИМТ стали факторами риска формирования отека субхондральной кости в послеоперационном периоде.
В исследовании не выявлено статистически значимых различий в уровнях паратгормона, витамина D и P1NP между группами (р>0,05). У всех пациентов уровень витамина D был недостаточным и в значениях от 20 до 30 нг/мл. Однако уровень остеокальцина (маркера костеобразования) во второй группе был ниже, чем в первой и третьей (р<0,019), что может свидетельствовать о замедлении ремоделирования костной ткани (табл. 1).
При этом уровень ДПИД утренней мочи повышался в третьей группе, где пациентам был поставлен диагноз «постартроскопический остеонекроз мыщелков бедренной и большеберцовой костей».
Таблица 1
Концентрация маркеров костного ремоделирования
|
Параметр |
1-я группа (п=55) |
2-я группа (п=6) |
3-я группа (п=23) |
р |
Референсные значения |
|
Паратгормон, пг/мл (М±m) |
27,2±5,7 |
35,2±6,4 |
26,9±3,2 |
0,27 (Н-критерий Краскела-Уоллиса) |
15-65 пг/мл |
|
Остеокальцин, нг/мл (М±m) |
20,1±7,5 |
12,3±7,6 |
25,4±13,4 |
<0,019* (критерий Тьюки) |
Ж 11-43 нг/мл М 14-42 нг/мл |
|
β-CrossLaps, нг/мл (М±m) |
0,48±0,2 |
0,44±0,2 |
0,75±0,3 |
<0,05* (критерий Данна) |
Ж <0,573 нг/мл М <0,584 нг/мл |
|
ДПИД, нмоль/ммоль креатинина (М±m) |
4,7±1,4 |
4,9±1,8 |
7,8±1,9 |
<0,001* (критерий Тьюки) |
Ж 3,0-7,4 нмоль/ммоль креатинина М 2,3-5,4 нмоль/ммоль креатинина |
|
D 25-OH витамин D, нг/мл (М±m) |
29,1 ±15,6 |
24,1 ±8,7 |
25,5±14,6 |
0,32 (Н-критерий Краскела-Уоллиса) |
30-100 нг/мл адекватный уровень
|
|
P1NP, нг/мл (М±m) |
53,1±9,8 |
48,9±7,9 |
32,9±8,4 |
0,13 (Н-критерий Краскела-Уоллиса) |
Ж 7,8-79,8 нг/мл М 22,4-118,9 нг/мл |
В предоперационном периоде у пациентов первой и второй групп не было значительных различий по шкале Western Ontario and McMaster University Osteoarthritis Index (WOMAC) (61,9±15,3 и 72,3±23,5; р=0,21). Все показатели, кроме тугоподвижности, статистически значимо улучшились после операции (р<0,05), при этом тугоподвижность осталась высокой (р=0,3). В послеоперационном периоде в третьей группе общая оценка по шкале WOMAC была значительно ниже (41,25±9,2) по сравнению с первой (23,4±8,7; р<0,01) и второй (33,8±9,1; р<0,01) группами. Оценка первой группы соответствовала хорошему результату, второй – удовлетворительному, а третьей – неудовлетворительному. В послеоперационном периоде не было различий в болевом синдроме и тугоподвижности между группами (р=0,25 и р=0,17), но функция сустава в первой группе была значительно выше (19,6±5,8) по сравнению со второй (24,5±7,3) и третьей (29,4±13,2; р<0,05). Таким образом, пациенты без отека субхондральной кости (группа 1) имели лучшие функциональные результаты по шкале WOMAC в сравнении с пациентами с отеком кости (группа 2) или развившимся остеонекрозом костей (группа 3), таблица 2.
Таблица 2
Показатели по шкале WOMAC после оперативного лечения
|
Параметр |
1-я группа (п=55) |
2-я группа (п=6) |
3-я группа (п=23) |
р |
|
Общая оценка, баллы (М±m) |
23,4±8,7 |
33,8±9,1 |
41,25±9,2 |
<0,01* (критерий Данна) |
|
Болевой синдром, баллы (М±m) |
10,1±6,5 |
13,8±7,6 |
16,1±5,7 |
р=0,25 (критерий Тьюки)
|
|
Тугоподвижность сустава, баллы (М±m) |
2,8±0,4 |
3,7±1,3 |
3,8±2,8 |
р=0Д7 (критерий Данна) |
|
Функция сустава, баллы (М±m) |
19,6±5,8 |
24,5±7,3 |
29,4±13,2 |
<0,05* (критерий Данна) |
В предоперационном периоде у пациентов первой и второй групп не было значительных различий по шкале Knee Society Score (KSS) (76,3±19,3 и 75,0±15,1; р=0,35), обе группы показали удовлетворительные результаты. После операции показатели KSS значительно улучшились (р<0,05). В парных сравнениях третья группа (68,9±10,7) показала значительно худшие результаты по сравнению с первой (86,2±9,1) и второй группами (82,1±11,3; р<0,01). Функциональная оценка также была выше в первой группе (83,8±15,4) по сравнению со второй (72,1±9,7) и третьей (71,3±12,8; р<0,05). Таким образом, пациенты с отеком костной ткани после артроскопического вмешательства демонстрируют худшие функциональные результаты, что подтверждается данными по шкале KSS, таблица 3.
Таблица 3
Показатели по шкале KSS в послеоперационном периоде
|
Параметр |
1-я группа (п=55) |
2-я группа (п=6) |
3-я группа (п=23) |
р |
|
KSS клиническая оценка, баллы (М±m) |
86,2±9,1 |
82,1±11,3 |
68,9±10,7 |
<0,01* (критерий Данна) |
|
KSS функциональная оценка, баллы (М±m) |
83,8±15,4 |
72,1±9,7 |
71,3±12,8 |
<0,05* (критерий Данна) |
Анализ результатов по шкале IKDC 2000 (International Knee Documentation Committee) в послеоперационном периоде не показал значимых различий между группами (р=0,27): средние значения составили 69,1±15,5 (первая группа), 61,6±19,9 (вторая) и 61,3±11,1 (третья), все результаты были удовлетворительными.
Заключение
Авторами в ходе исследования выявлены статистически значимые корреляции между рядом демографических и лабораторных параметров пациентов и развитием постартроскопического синдрома. Женский пол, возраст старше 50 лет и показатель ИМТ, превышающий нормальные значения, являются факторами риска формирования отека субхондральной кости в послеоперационном периоде. Наличие у пациентов (мужчин моложе 50 лет и женщин до менопаузы) остеопении или остеопороза также является фактором риска развития постартроскопического синдрома после частичной резекции мениска. Пониженный уровень остеокальцина, выявленный у пациентов в группе с отеком костной ткани, мог свидетельствовать о замедлении процессов ремоделирования костной ткани (костных трабекул) и ее адаптации к повышенным нагрузкам, после частичной резекции мениска, что могло способствовать возникновению микропереломов субхондральной кости и отеку костной ткани. Увеличенные концентрации ДПИД и β-CrossLaps у пациентов ретроспективной группы с уже установленным диагнозом «постартроскопический остеонекроз» могут отражать усугубление патологических изменений в зоне отека костной ткани и формирование или прогрессирование остеонекроза.
Таким образом, при наличии факторов риска у пациентов, следует сохранять настороженность в отношении развития постартроскопического синдрома для избавления пациента от необходимости в последующем тотального эндопротезирования коленного сустава.
Библиографическая ссылка
Магомедгаджиев Р.М., Торгашин А.Н., Иванов К.С., Родионова С.С., Дзюба А.М. ПОСТАРТРОСКОПИЧЕСКИЙ СИНДРОМ ПОСЛЕ ЧАСТИЧНОЙ РЕЗЕКЦИИ МЕНИСКА. РЕЗУЛЬТАТЫ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ // Современные проблемы науки и образования. 2025. № 1. ;URL: https://science-education.ru/ru/article/view?id=33930 (дата обращения: 23.01.2026).
DOI: https://doi.org/10.17513/spno.33930



