Введение
Мелкоклеточный рак легкого (МРЛ) является одним из самых агрессивных злокачественных новообразований (ЗНО) с ранним развитием метастазов и занимает первое место по смертности от рака в России и мире [1]. В рамках стандартного лечения МРЛ первой линии применяют препараты платины в сочетании с этопозидом с последующей лучевой терапией. Хотя первоначальный ответ на химиотерапию является обычным явлением, приобретенная резистентность с высокой частотой рецидивов в течение одного года служит основной причиной неудач лечения МРЛ. Более точный подбор препаратов на основе тестирования индивидуальной чувствительности опухоли мог бы помочь достигнуть улучшения результатов терапии на первой и последующих линиях лечения. В случае с МРЛ создание индивидуальных тест-систем из опухолевой ткани ограничивается крайне редким проведением хирургического удаления опухоли, биопсии же имеют небольшой объем и часто содержат некротизированную ткань. Исследователи обходят данные ограничения, используя в качестве материала для тест-системы довольно многочисленные при данной патологии циркулирующие опухолевые клетки (ЦОК). Так, ЦОК применяют для создания экспериментальных тест-систем в целях проверки гипотез [2, 3]. Кроме того, данный материал предлагают использовать в персонифицированной терапии данного заболевания и для разработки новых лекарственных веществ [4, 5]. Другим источником клеток опухоли при МРЛ может быть злокачественный плевральный выпот (ЗПВ), однако подобных работ авторами не было обнаружено, вероятно, из-за относительно низкой частоты таких случаев. Известно, что ЗПВ наблюдается примерно у 11% пациентов с МРЛ [6]. С учетом общей частоты встречаемости этого диагноза среди заболеваний раком легкого около 15% [1] частота таких пациентов в клинической практике онкологов составляет всего около 1,6%. Тем не менее, авторы считают, что данный источник может быть не менее ценным, чем ЦОК, тем более что уже накоплен большой опыт подобных исследований для немелкоклеточного рака легкого (НМРЛ) [7–9]. Плевральные выпоты имеют преимущество в том, что они доступны до или одновременно с патологическим исследованием и обычно выделяются в большом количестве в ходе медицинской процедуры, направленной на устранение жизнеугрожающей симптоматики, вызванной ЗПВ.
Как ЦОК, так и ЗПВ в качестве общего недостатка имеют небольшое количество целевых клеток, что затрудняет их приживаемость и ограничивает информативность получаемой тест-системы. Кроме того, в обоих случаях требуется отделить клетки опухоли от других типов клеток, содержание которых может в десятки и сотни раз превосходить содержание клеток искомой популяции. Авторы предположили, что методом, позволяющим решить данные проблемы, может быть создание трехмерной культуры из клеток ЗПВ путем ускоренной агрегации клеток в висячих каплях на силиконовом покрытии, которое было протестировано для этих целей авторами ранее [10]. Похожий подход уже использовали при создании тест-систем из клеток ЗПВ НМРЛ, однако в этом случае применяли специальные планшеты [11].
Во-первых, агрегация клеток в висячих каплях реализуется в соответствии с их размерами и плотностью, в результате чего происходит естественная сепарация различных субпопуляций клеточной суспензии. Применение силиконового покрытия, кроме того, позволяет сократить требуемое количество клеток для создания плотного конгломерата до нескольких десятков, что дает возможность разработать тест-систему с достаточным количеством экспериментальных повторов даже из небольших образцов [10]. В составе сфероида-агрегата даже немногочисленные клетки опухоли обладают увеличенной жизнеспособностью из-за межклеточного взаимодействия, а присутствующие в капле элементы микроокружения также положительно влияют на выживаемость клеток опухоли в культуре. Наконец, сфероиды-агрегаты имеют преимущество перед сфероидами-клонами, которые ранее получали из ЦОК МРЛ [2–4], в скорости формирования и однородности (по составу, биологическим особенностям и размерам), что особенно важно для анализа индивидуальной чувствительности опухоли к химиопрепаратам, когда требуется получить быстрый и точный ответ.
Цель исследования. Создать персонализированную тест-систему для оценки химиочувствительности МРЛ из материала ЗПВ и оценить возможности ее применения.
Материал и методы исследования
Плевральный выпот был получен из отделения торакальной хирургии ФГБУ «НМИЦ онкологии» Минздрава РФ г. Ростова-на-Дону от пациента мужского пола возрастом 83 года, которому был диагностирован впервые выявленный МРЛ. Пациент ранее не получал специализированного лечения.
Весь образец центрифугировали при 300 g в течение 15 минут, после чего проводили лизис эритроцитов с Red Blood Cell Lysis Solution (Miltenyi, США) и двойную отмывку в среде ДМЕМ (Servicebio, Китай) без добавления сыворотки. Часть материала была передана в патолого-анатомическое отделение для определения содержания злокачественных клеток. Далее клетки считали и наносили на крышку чашки Петри, покрытую силиконовым эластомером СИЭЛ 159-330 (АО «ГНИИХТЭОС», г. Москва, Россия), по 2000 тыс. клеток в 20 мкл среды ДМЕМ (Servicebio, Китай) с добавлением 10% FBS (Hyclone, США), инсулина-трансферрина-селенита натрия («Биолот», Россия) и EGF (Miltenyi, США) в концентрации 10 нг/мл. Далее висячие капли инкубировали в течение 72 ч в CO2-инкубаторе при 370С и содержании CO2 5,0%.
Для проведения теста на чувствительность к химиотерапии и экспериментальным препаратам сформировавшиеся агрегаты переносили в лунки 96-луночного плоскодонного планшета по 3 шт. на лунку. Всего было заложено 9 вариантов опыта (по 8 технических повторов в каждом): 1) Контроль без добавления тестируемых веществ; 2) Цисплатин-РОНЦ® (РОНЦ им. Н.Н. Блохина РАМН, Россия) 5 мкг/мл и 20 мкг/мл; 3) Илсира® (МНН левилимаб, рекомбинантное моноклональное антитело к рецептору интерлейкина 6) («Биокад», Россия) 50 мкг/мл и 100 мкг/мл; 4) Цисплатин+ Илсира® (4 сочетания). Планшеты со сфероидами культивировали 72 ч, после чего в среду вносили смесь ядерных красителей Hoescht33342 (1 мкг/мл) (Abcam, США) и этидия бромида (10 мкг/мл) (AppliChem, Германия), выдерживали в CO2-инкубаторе 15 минут для равномерного окрашивания и проводили фотофиксацию полученных результатов на имиджере LionHeartFX (BioTek, США). Для каждого варианта опыта фотографировали по 10 сфероидов в каналах DAPI и RFP, каждый в серии изображений Z-стек (интервал 100 мкм, общая толщина 1100 мкм). Далее полученные изображения обрабатывали и анализировали с помощью ПО Fiji, и с использованием алгоритма 3D Object Counter подсчитывали общее количество клеток и долю мертвых клеток в сфероиде.
Исследование было одобрено Комитетом по биомедицинской этике при ФГБУ «НМИЦ онкологии» Минздрава России (выписка из протокола заседания № 7 от 08.08.2022г.). Пациент подписал информированное согласие на участие в исследовании.
Статистическую обработку результатов проводили с помощью ПО MS Excel. Проверку гипотез о наличии достоверных отличий между средними значениями проводили с помощью однофакторного дисперсионного анализа, поиск достоверных различий при попарном сравнении средних осуществляли с помощью критерия Тьюки.
Результаты исследования и их обсуждение
В полученной из плеврального выпота суспензии клеток, по данным патолого-анатомического исследования, содержались в основном клетки мезотелия (рис. 1А, м), которые легко отличить по светлым ядрам и отростчатой цитоплазме. Клетки опухоли имели более крупный размер, округлую форму, крупное темное ядро (рис. 1А, о). Иммунные клетки встречались редко. Соотношение клеток опухоли к остальным клеткам составило примерно 1 к 20. На третьи сутки культивирования в висячих каплях наблюдалось расслоение клеточной суспензии на два компонента. В самой нижней части капли образовалось рыхлое скопление из большого количества клеток, скорее всего, относящихся к клеткам мезотелия. Выше этого скопления располагался достаточно прочный конгломерат из немногочисленных крупных темных клеток (рис. 1Б). При переносе образовавшихся скоплений в лунки 96-луночного планшета конгломераты крупных клеток частично распались на отдельные фрагменты, клетки мезотелия же распались по всему объему среды в лунке в виде отдельных клеток. При окраске ядерными красителями эти отдельные клетки окрашивались этидия бромидом, причем не только в опыте, но и в контроле (рис. 1В), что говорит об их низкой жизнеспособности в условиях культивирования в висячих каплях.
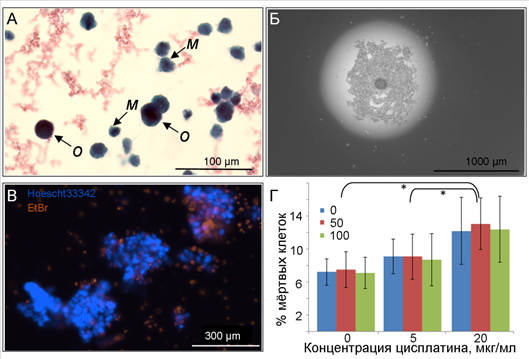
Рис. 1. Опыт получения индивидуальной тест-системы из плеврального выпота для тестирования терапии мелкоклеточного рака легкого:
А. Цитологический мазок суспензии клеток, полученной из плеврального выпота. Окрашивание азур-эозином. Примечание: м – клетка мезотелия, о – клетка опухоли.
Б. Конгломерат клеток, образовавшийся на третьи сутки культивирования в висячих каплях.
В. Окрашивание клеток смесью ядерных красителей Hoescht33342 и этидия бромидом после переноса в 96-луночные планшеты.
Г. Содержание мертвых клеток в различных вариантах опыта с добавлением цисплатина и Илсира® (примечание: цветом столбцов отмечена концентрация Илсира®: 0, 50 и 100 мкг/мл, где * – достоверные различия на уровне значимости α=0,05)
По результатам подсчета окрашенных ядер в сфероидах были получены данные по среднему количеству клеток в сфероиде и процентному содержанию мертвых клеток для каждого варианта опыта. Анализ полученных данных показал, что среднее количество клеток в сфероиде достоверно не различалось между вариантами опыта (F9,81= 0,23) и составило 50,12±19,9 (CV=39,7%) клеток.
Средний процент мертвых клеток в сфероидах для каждого варианта опыта приведен в таблице 1. Коэффициент вариации показателя лежал в пределах от 22,2% до 36,3%.
Таблица 1
Доля мертвых клеток в клеточных сфероидах (%, m±SD)
|
|
|
Цисплатин |
||
|
5 мкг/мл |
20 мкг/мл |
0 мкг/мл |
||
|
Илсира® |
50 мкг/мл |
9,07±2,71 |
13,05±3,14 * |
7,48±2,16 |
|
100 мкг/мл |
8,7±3,16 |
12,4±4,01 * |
7,1±1,91 |
|
|
0 мкг/мл |
9,1±2,12 |
12,2±3,07 * |
7,2±1,6 |
|
Примечание: * – статистически значимые отличия от контроля (цисплатин 0 мкг/мл), p<0,05.
По результатам дисперсионного анализа между средними значениями содержания мертвых клеток наблюдаются достоверные различия (F9,81= 7,3). Множественное сравнение с применением критерия Тьюки показало достоверное отличие от контроля всех вариантов опыта с добавлением 20 мкг/мл цисплатина (рис. 1Г). Добавление препарата Илсира в самостоятельном варианте не оказало значимого влияния на показатель содержания мертвых клеток в сфероиде. Кроме того, не было обнаружено достоверных отличий между средними значениями содержания мертвых клеток в вариантах опыта с добавлением препарата Илсира на фоне обеих концентраций цисплатина.
Авторы получили быструю и экономически выгодную тест-систему из клеток МРЛ, содержащихся в ЗПВ. Общая продолжительность работ – от забора материала до получения результатов теста – составляет не больше недели. По скорости получения результата данная тест-система сравнима с адгезионными [12] и трехмерными [11] первичными культурами, полученными из ЗПВ НМРЛ для тестирования индивидуальной чувствительности к химиотерапии. В то же время, для МРЛ трехмерные культуры получали из ЦОК после относительно более долгого (более 10 дней) культивирования в селективных условиях [4, 5]. Культура в висячих каплях с целью ускорения результата может быть легко адаптирована и для ЦОК, так как в крови пациентов с МРЛ количество злокачественных клеток на 1 мл может составлять >2300 клеток/7,5 мл [2], чего достаточно для протестированной авторами методики, требующей от нескольких сотен клеток для формирования единичного сфероида.
Кроме высокой скорости получения результатов, культура конгломератов клеток в висячих каплях на покрытии СИЭЛ 159-330 обладает и другими преимуществами. Во-первых, это низкие требования к количеству клеток, что значительно увеличивает возможности теста по сравнению с двумерными культурами [12]. Данная особенность позволяет применять эту технологию совместно с такими довольно расточительными с точки зрения целевых клеток методами предварительного обогащения суспензии клеток, как магнитная сепарация. Во-вторых, использование конгломератов клеток вместо сфероидов-клонов позволяет снизить вариативность ответа между сфероидами, так как каждый из них является равновероятной смесью из различных клеток, а значит, свойства таких сфероидов усреднены уже благодаря самой технологии их получения.
К ограничениям протестированной методики получения тест-системы можно отнести высокую вариативность при подсчете количества клеток в сфероидах. В настоящем исследовании коэффициент вариации в количестве клеток на сфероид по всем вариантам опыта составил почти 40%, при отсутствии достоверных различий средних значений между вариантами опыта. Высокая вариативность обусловлена особенностями методики – перенос сфероидов из капли в лунку планшета приводит к их частичному разрушению. В связи с этим недостатком данный метод нельзя применить для анализа цитостатического действия препаратов, поскольку нельзя сравнить между собой варианты опыта. Устранения данного недостатка можно достичь путем усовершенствования техники переноса сфероидов за счет новых конструктивных решений, подобных специализированным планшетам, например, применявшихся в одной из работ [11]. Показатель содержания мертвых клеток в сфероидах должен быть более устойчивым в условиях переноса сфероидов из капли в лунку планшета, однако и здесь значения коэффициента вариации оказались довольно значительными – от 22 до 33%. Таким образом, в дальнейшем требуется предусмотреть большее количество экспериментальных повторов для получения возможности измерять даже слабые эффекты. Также возможно адаптировать и другие измерения, в которых определяются относительные показатели, например определение доли клеток на разных стадиях апоптоза в тесте с аннексином V, определение активности каспаз или клинически значимых транспортеров, уровня свободнорадикальных продуктов, образование фагосом и т.п.
По сравнению с ЦОК ЗПВ предоставляет меньше возможностей для отслеживания ответа на лечение, так как случай плеврального выпота у пациента может не повториться, в то время как кровь пациента будет доступна с высокой вероятностью. Поэтому данную методику следует адаптировать в дальнейшем для работы с ЦОК.
На полученной авторами тест-системе была продемонстрирована чувствительность опухоли к цисплатину. Однако добавление блокатора интерлейкина 6 (ИЛ-6) не оказало дополнительного эффекта. Отсутствие активности препарата Илсира® можно объяснить тем фактом, что клетки опухоли данного пациента не зависят от сигнализации ИЛ-6, либо данный цитокин отсутствовал в среде культивирования. Авторами не было обнаружено в литературных источниках указаний на возможную связь МРЛ с сигнализацией ИЛ-6, однако для НМРЛ такие свидетельства имеются [13]. Возможно, больше информации дало бы включение дополнительного положительного контроля с содержанием ИЛ-6 в среде культивирования для различения неработоспособности антитела, блокирующего его рецептор, и присущей опухоли независимости от ИЛ-6.
В качестве тестируемых веществ для МРЛ также обосновано применить блокаторы тирозин-киназы, подавляющие абберантную активность рецептора EGFR и широко используемые при НМРЛ. Данный рецептор играет сложную роль в МРЛ, особенно в контексте механизмов резистентности и стратегий лечения. Хотя мутации EGFR редки при МРЛ и часто связаны со смешанной гистологией и/или гистологической трансформацией опухоли, их присутствие может существенно влиять на результаты лечения и прогрессирование заболевания. Мутации EGFR, такие как L858R, были выявлены в небольшом проценте случаев МРЛ, что указывает на потенциал для таргетной терапии [14].
Полученную авторами тест-систему также можно адаптировать для проведения функционального теста с собственными иммунными клетками пациентов и блокаторами контрольных точек иммунитета или с модифицированными Т-клетками (CAR-T). В ряде клинических исследований было показано, что применение антител анти-PD-1/PD-L1 с антителами анти-CTLA-4 или без них позволило добиться улучшения показателей общей выживаемости и выживаемости без прогрессирования у пациентов с МРЛ [15].
Заключение
Злокачественный плевральный выпот может быть источником клеток для создания персонифицированной тест-системы с целью оценки индивидуальной чувствительности к химиотерапии при МРЛ.
Исследование проведено без спонсорской поддержки. Авторы заявляют об отсутствии конфликта интересов.
Библиографическая ссылка
Филиппова С.Ю., Межевова И.В., Хомидов М.А., Новикова И.А., Златник Е.Ю., Харагезов Д.А. ОПЫТ ПОЛУЧЕНИЯ ИНДИВИДУАЛЬНОЙ ТЕСТ-СИСТЕМЫ ИЗ ПЛЕВРАЛЬНОГО ВЫПОТА ДЛЯ ОЦЕНКИ ХИМИОЧУВСТВИТЕЛЬНОСТИ МЕЛКОКЛЕТОЧНОГО РАКА ЛЁГКОГО // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33816 (дата обращения: 11.01.2026).
DOI: https://doi.org/10.17513/spno.33816



