Введение
На сегодняшний день к основным методам лечения злокачественных новообразований относятся в первую очередь лучевая терапия, хирургия и химиотерапия, реже – иммунотерапия, гормональная и генная терапия [1, c. 14]. Среди лучевой терапии особое место последние 10 лет занимает протонная терапия, которая позволяет более точно доставлять заданную дозу в целевую область, что существенно снижает лучевую нагрузку на окружающие здоровые ткани и уменьшает вероятность возникновения ранних и поздних лучевых осложнений, включая вторичные радиационно-индуцированные новообразования [2, 3]. Одним из перспективных направлений развития протонной терапии являются разработка и применение новых схем гипофракционированного облучения опухолей, при которых суммарная очаговая доза 60–80 Гр будет доставляться в опухоль за небольшое количество фракций, что существенно снизит время и стоимость лечения [4].
Поскольку, несмотря на развивающиеся технологии, при использовании протонной терапии отмечается ряд сопутствующих осложнений, в том числе возникновение радиационно-индуцированной кожной токсичности [5, 6] при лечении поверхностных или неглубокозалегающих опухолей, необходимо учитывать жизненно важные показатели, которые могут влиять на результаты эксперимента, в динамике после проведенного курса лучевой терапии [7].
Целью исследования является оценка физиологических показателей у мышей: динамики массы тела, общего анализа периферической крови, индекса массы лимфоидных органов (тимуса, селезенки) и выживаемости – при однократном локальном воздействии тонкого сканирующего пучка протонов в расширенном пике Брэгга с энергией 88 МэВ в дозах 30 и 40 Гр на кожу.
Материал и методы исследования
В экспериментах использовали самцов белых аутбредных мышей линии SHK (45 особей, 8–9 недель, 30–35 г). Экспериментальные группы животных были разделены на подгруппы в зависимости от дозы облучения: группа 0 Гр, группа 30 Гр и группа 40 Гр. Животных содержали в поликарбонатных клетках с подстилом из опилок по 5 особей в виварии ИТЭБ РАН (г. Пущино) при температуре 22±2°С. Режим освещенности – 12 ч / 12 ч. Животные имели свободный доступ к воде и полнорационному экструдированному корму для лабораторных животных (ООО «Провими», Россия). В экспериментах следовали этическим нормам при работе с лабораторными животными по протоколу, утвержденному Комиссией по биоэтике и биологической безопасности ИТЭБ РАН (№ 31/2024 от 18 марта 2024 г.). Все исследования с участием животных в ИТЭБ РАН осуществляются согласно Директиве 2010/63/EU Европейского парламента и совета европейского союза по охране животных, используемых в научных целях.
В качестве наркоза во время проведения облучения была использована комбинация препаратов «Золетил 100» (Virbac, Франция) и «Ксила» (Interchemie, Нидерланды) в соотношении 1:3 (40 мг/кг). Облучение недепилированных животных проводили в комплексе протонной терапии «Прометеус» ФТЦ ФИАН (г. Протвино) в дозах 30 и 40 Гр сканирующим пучком протонов в расширенном пике Брэгга с энергией 88 МэВ на платформе из термопластика, расположенной под углом 45°, с дорсальной стороны тела животного. Экспериментально проверку фактического положения пика и оценку поглощенной дозы осуществляли при помощи радиохромной пленки EBT3 8*10 (АО «Академлайн», Россия) и комплекса дозиметрического оборудования PTW (PTW-Freiburg, Германия): электрометр Unidose webline с ионизационными камерами PinPoint 3D Chamber TM31022 и BraggPeak Chamber TM34073. Для оцифровки радиохромной пленки EBT3 использовали планшетный фотопленочный сканер Epson® 10000XL (Seiko Epson Corporation, Япония). Ежедневно в течение 70 суток с момента облучения дополнительно проводили осмотр каждого животного с целью фиксации клинических проявлений радиационно-индуцированной кожной токсичности в соответствии со шкалой Radiation Therapy Oncology Group (RTOG) [8]. Фотофиксацию животных проводили с дорсальной стороны 1 раз в неделю с использованием зеркальной камеры Nikon D3400 (Япония). Была проведена оценка динамики массы тела, индекса массы лимфатических органов (тимуса, селезенки), результатов гематологического исследования периферической крови и времени дожития (30-суточной выживаемости) мышей после однократного локального воздействия сканирующего пучка протонов в дозе 30 и 40 Гр. Взвешивание животных проводили перед облучением, а затем на 7-е, 21-е сутки и непосредственно в день перед эвтаназией (70-е сутки). Для оценки массы внутренних органов (тимуса, селезенки) на 7-е, 21-е и 70-е сутки часть животных была выведена из эксперимента. Образцы крови отбирали посредством косого надреза кончика хвоста над просвечивающей веной перед облучением, а затем на 7-е и 21-е сутки после облучения и непосредственно в день перед эвтаназией (70-е сутки). Образцы крови были взяты для анализа на гематологическом анализаторе DH36 Вет (Dymind, China) для измерения следующих параметров: количества лейкоцитов, лимфоцитов, гранулоцитов и тромбоцитов. Оценивали время дожития животных в течение 30 суток после облучения.
Нормальное распределение вариационных рядов, подтвержденное критерием Шапиро–Уилка, позволило результаты исследования представить в виде среднего значения ± стандартное отклонение (M±SD). Однако с учетом малого количества животных статистическую значимость отличий значений в экспериментальных группах определяли с использованием U-критерия Манна–Уитни. Различия считали статистически значимыми при p≤0,05. Полученные данные обрабатывали с использованием программ GraphPad Prism 8.0.1, Microsoft Excel 2016 и ImageJ.
Результаты исследования и их обсуждение
На рисунке 1 показано формирование лучевых ожогов у животных в экспериментальных группах, подвергнутых воздействию 30 и 40 Гр протонов на кожу (100% животных с ожидаемыми проявлениями лучевого ожога 2–4-й степеней, согласно классификации RTOG).
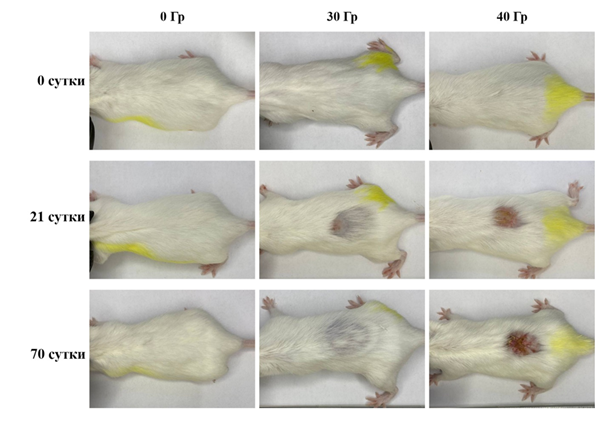
Рис.1. Динамика самопроизвольного заживления ран при однократном локальном облучении протонами в дозе 30 и 40 Гр
Была проведена оценка динамики гематологических (количества лейкоцитов, лимфоцитов, гранулоцитов и тромбоцитов) и физиологических (изменения массы тела и индекса внутренних органов (тимуса, селезенки) показателей, а также времени дожития мышей при локальном воздействии протонов в дозе 30 и 40 Гр.
Одним из основных физиологических показателей благополучия животных является масса тела. Уменьшение массы тела животных может происходить из-за стресса, вызванного транспортировкой, инъекцией и самим наркозом, а также манипуляций и последствий облучения, в том числе временного обездвиживания во время сеанса и наличия радиационно-индуцированных повреждений, что в конечном итоге может приводить к снижению количества потребляемого корма. На рисунке 2 представлено изменение массы тела экспериментальных животных на 7-е, 21-е и 70-е сутки после однократного локального воздействия протонного излучения в дозах 30 и 40 Гр по сравнению с исходной массой тела до воздействия (0 сутки).
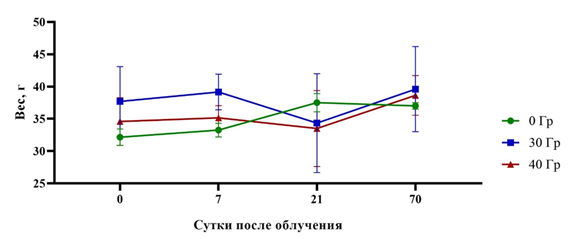
Рис. 2. Изменение массы тела самцов мышей SHK (г, М±SD) при однократном локальном облучении протонами в дозе 30 и 40 Гр (n=45)
Показано, что масса тела животных увеличивалась с течением времени, за исключением незначительного спада в группах облученных мышей на 21-е сутки после воздействия, что могло быть связано с разгаром деструктивной фазы лучевого ожога [9]. К концу эксперимента (70-е сутки) масса тела животных увеличивалась на 10±4% во всех экспериментальных группах, что может быть показателем благополучия животных.
Ионизирующее излучение повреждает гемопоэтические стволовые клетки костного мозга, изменяет способность стромальных элементов костного мозга поддерживать гемопоэз, а также приводит к гибели форменных элементов непосредственно в кровяном русле [10, 11]. Развитие лейкопении и тромбопении может быть качественным индикатором воздействия радиации на организм [12]. В данной работе было проведено исследование выборочных гематологических параметров крови (количества лейкоцитов, лимфоцитов, гранулоцитов и тромбоцитов) облученных животных на 7-е, 21-е и 70-е сутки по сравнению с интактным контролем (0 Гр) после воздействия однократного локального протонного излучения в дозах 30 и 40 Гр (таблица).
Влияние локального протонного излучения в дозе 30 и 40 Гр на морфологический состав периферической крови самцов белых мышей SHK (109/л, М±SD), n=45
|
Сутки после воздействия протонного излучения |
Экспериментальная группа |
||
|
0 Гр |
30 Гр |
40 Гр |
|
|
Количество лейкоцитов (WBC), 109/л |
|||
|
0-е сутки |
13,58±3,48 |
||
|
7-е сутки |
11,65±0,73 |
9,39±2,03 |
12,18±0,98 |
|
21-е сутки |
9,16±0,54 |
13,90±1,06 |
12,19±4,66 |
|
70-е сутки |
8,55±0,61 |
14,44±3,55 |
12,91±5,46 |
|
Количество лимфоцитов (Lym), 109/л |
|||
|
0-е сутки |
7,53±2,17 |
||
|
7-е сутки |
8,32±3,57 |
6,43±1,84 |
6,41±0,38 |
|
21-е сутки |
5,53±2,74 |
6,44±2,26 |
7,46±2,87 |
|
70-е сутки |
5,60±3,80 |
8,81±2,63 |
6,77±2,43 |
|
Количество гранулоцитов (Gran), 109/л |
|||
|
0-е сутки |
4,07±1,85 |
||
|
7-е сутки |
2,03±0,92 |
2,00±0,26 |
4,07±0,90 |
|
21-е сутки |
2,23±0,33 |
4,79±0,63 |
2,93±1,15 |
|
70-е сутки |
1,98±0,22 |
3,48±0,70 |
4,74±2,84 |
|
Количество тромбоцитов (PLT), 109/л |
|||
|
0-е сутки |
434±73 |
||
|
7-е сутки |
518±42 |
552±107 |
373±67 |
|
21-е сутки |
665±73 |
339±58 |
642±103 |
|
70-е сутки |
640±138 |
491±96 |
406±157 |
Как видно из данных, приведенных в таблице 1, на 7-е, 21-е и 70-е сутки после воздействия однократного локального протонного излучения в дозах 30 и 40 Гр не наблюдаются статистически значимые изменения количества форменных элементов крови во всех экспериментальных группах. Авторы отмечают, что, согласно проведенной дозиметрии, вся энергия при облучении протонами поглощалась непосредственно эпидермисом и дермой, не затрагивая красный костный мозг, поэтому влияние на состав форменных элементов крови можно было бы ожидать только при наличии «коммунального» (организменного «эффекта свидетеля»), опосредованно влияющего через воспалительные процессы в пораженном участке облученной кожи.
В исследованиях относительной биологической эффективности протонного излучения чаще всего применяют тотальное облучение в дозах примерно 0,5–2 Гр, что связано с разовой фракционной дозой при терапевтическом лечении опухолей, а также с суммарной дозой космического облучения во время долгосрочной миссии. Так, в одной из статей было продемонстрировано дозозависимое снижение количества лейкоцитов и лимфоцитов до 61% и 72% соответственно через 24 ч у мышей, облученных протонами с энергией 1 ГэВ или 51,24 МэВ в дозах до 2 Гр [13]. В работе A.L.Romero-Weaver и соавторов было показано, что однократное тотальное фотонное и так называемое SPE-like proton radiation (протонное излучение, возникающее во время вспышек на Солнце) в дозах 0,5–2 Гр (230 МэВ) вызывают значительное снижение количества всех типов клеток крови в разное время после облучения мышей [14]. Тотальное облучение самцов мышей C57BL/6J протонами (150 МэВ) в дозе 0,5 Гр как на 4-й, так и на 30-й день приводило к снижению количества лейкоцитов и лимфоцитов. Авторы не обнаружили в исследовании существенных различий в количестве тромбоцитов и эритроцитов между группами для обеих временных точек [15]. Исследование на самках мышей C57Bl/6, которых облучали тотально протонами (208 МэВ) в дозе 8,5 Гр, продемонстрировало серьезное снижение количества лейкоцитов к 2-му дню после облучения, а через 7–10 суток последовало снижение количества тромбоцитов, затем снижение количества эритроцитов примерно через 2 недели после облучения. Восстановление всех компонентов крови начиналось через 3 недели после облучения [16]. Авторами не было обнаружено локального действия высоких доз протонов на гематологический состав крови в столь отдаленные сроки после воздействия.
В настоящее время данные по изучению лимфоидных органов при различных патологических процессах, в частности при терапевтическом облучении, немногочисленны. Лимфоидные органы, а именно селезенка и тимус, обладают высокой радиочувствительностью и одними из первых реагируют на воздействия ионизирующего излучения. Структурные, морфологические, клеточные и функциональные изменения в селезенке и тимусе могут быть связаны с резкой интенсификацией клеточной деструкции, влекущей за собой потерю лимфоцитов, и с полным угнетением клеточной митотической активности и дифференцировки [17]. При действии высоких доз ионизирующего излучения при тотальном облучении в ближайшем периоде отмечается иммуносупрессия в различных звеньях иммунной системы [18]. Вместе с тем, представляет большой интерес изучение изменений периферических лимфоидных органов иммунной системы в отдаленном периоде после локального облучения. В частности, динамика массы и морфологии тимуса и селезенки могут быть использованы в качестве параметров оценки воздействия радиации, в том числе и протонного излучения, на общее состояние организма, кроветворную и иммунную системы. Известно, что на ранних стадиях стресс-реакции наблюдается снижение массы тимуса и селезенки, происходит заселение лимфоцитов в костный мозг и соединительную ткань, усиливается костномозговое кроветворение, увеличивается количество стволовых клеток в костном мозге, что позволяет в итоге повысить сопротивляемость организма. При повторяющемся стрессе, а также при облучении развивается острая или хроническая воспалительная реакция, которая на тимусе морфологически будет проявляться в виде акцидентальной инволюции. Данная реакция характеризуется прогрессирующим снижением его массы и изменением функциональной активности.
Результаты исследования изменения относительной массы тимуса и селезенки в % от веса экспериментальных животных на 7-е, 21-е и 70-е сутки после воздействия однократного локального протонного излучения в дозах 30 и 40 Гр относительно интактных животных графически представлены на рисунках 3 и 4.
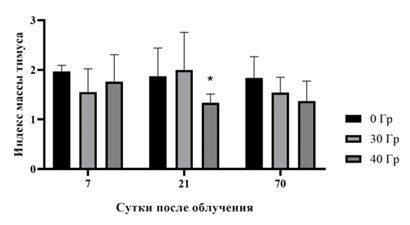
Рис. 3. Индекс массы тимуса самцов мышей SHK после однократного действия локального протонного излучения в дозах 30 и 40 Гр (n=45)
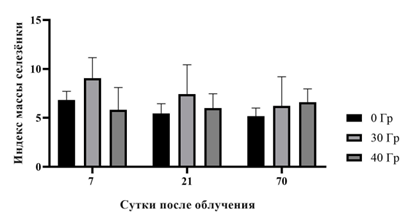
Рис. 4. Индекс массы селезенки самцов мышей SHK после однократного действия локального протонного излучения в дозах 30 и 40 Гр (n=45)
Показано, что на 7-е и 70-е сутки после воздействия статистически значимые различия между экспериментальными группами отсутствуют, при этом к 21-м суткам наблюдается снижение массы тимуса в группе мышей, облученных дозой 40 Гр, по сравнению с интактными животными (0 Гр) (рис. 3). На рисунке 4 показано, что на протяжении всего эксперимента индекс массы селезенки облученных мышей статистически значимо не отличается ни от аналогичного показателя контрольных животных, ни между экспериментальными группами.
В данном исследовании установлено, что локальное облучение протонами в дозах 30 и 40 Гр оказывает токсическое воздействие на кожу мышей, приводя к ожогам 2–3-й степени, при этом не вызывает системного ответа ни кровеносной системы, ни лимфоидных органов. Авторы отмечают, что в группе мышей, облученных в дозе 40 Гр, на 21-е сутки после воздействия наблюдалось значимое уменьшение относительной массы тимуса. Сравнение и интерпретация полученных результатов крайне затруднительны, поскольку работы по исследованию влияния протонов на лимфоидные органы очень малочисленны, а исследования по локальному действию частиц в отдаленные сроки наблюдения отсутствуют.
Тест на выживаемость животных в течение 30 суток (LD50/30) – это наиболее широко применяемый и хорошо охарактеризованный критерий для оценки острого и хронического радиационного повреждения [19]. В работе проведена оценка времени дожития животных после однократного локального воздействия протонного излучения в дозах 30 и 40 Гр. Установлено, что к 30-м суткам выживаемость животных во всех группах составила 100%, кроме того, все животные дожили до окончания эксперимента (70 суток). Полученные данные по выживаемости подтверждают, что доза была поглощена непосредственно кожей животных и не были затронуты жизненно важные органы и системы. В вышеупомянутой работе [16] при тотальном облучении самок мышей C57Bl/6 протонами (208 МэВ) в дозе 8,5 Гр было показано, что в группе из 45 облученных животных наблюдалось 15 летальных исходов в течение 30 дней после облучения.
Заключение
Оценка ключевых гематологических и физиологических показателей у мышей после однократного локального облучения животного с дорсальной стороны тела пучком протонов в дозах 30 и 40 Гр в течение 70 суток после воздействия указывает на отсутствие влияния локального протонного излучения в исследуемых дозах на благополучие и общее состояние животных. Полученные результаты могут быть использованы для дальнейшего внедрения протонной лучевой терапии, в том числе по схеме гипофракционирования или флэш-терапии, в клиническую практику в России.
Библиографическая ссылка
Аникина В.А., Сорокина С.С., Замятина Е.А., Шемяков А.Е., Пухаева Н.Е., Громова Д.С., Попова Н.Р. ДИНАМИКА КЛЮЧЕВЫХ ГЕМАТОЛОГИЧЕСКИХ И ФИЗИОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ ПРИ ЛОКАЛЬНОМ ВОЗДЕЙСТВИИ ПРОТОНОВ НА КОЖУ У МЫШЕЙ // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33813 (дата обращения: 05.03.2026).
DOI: https://doi.org/10.17513/spno.33813



