Введение. Дисплазия тазобедренного сустава – заболевание, характеризующееся дисморфогенезом анатомических структур тазобедренного сустава. Основное место в данном патологическом процессе занимают дисконгруэнтность вертлужной впадины и децентрация головки бедренной кости. Выраженной степенью клинического проявления дисплазии тазобедренного сустава является врожденный вывих бедра. При отсутствии своевременной коррекции заболевание приводит к инвалидности и потере пациентом трудоспособности. Частота встречаемости дисплазии тазобедренного сустава составляет от 5–30:1000, врожденного вывиха бедра – 3–4:1000 [1]. Результаты изучения литературных данных об этиологии формирования дисплазии тазобедренного сустава (врожденного вывиха бедра) свидетельствуют об отсутствии единого мнения исследователей по этому вопросу [2]. Существующие теории этиологии и патогенеза, приводящие к развитию изучаемой патологии, никогда не подтверждались в эксперименте. На сегодняшний день не существует системы моделирования дисплазии тазобедренного сустава (врожденного вывиха бедра) на животной модели в раннем эмбриональном периоде [3, 4]. Создание экспериментальной модели врожденного вывиха бедра позволит понять патобиологические процессы изучаемой патологии.
Анализ литературных данных о роли клеток нервного гребня и индукторе их миграции – транскрипционного гена парного бокса 3 (PAX3) – в патогенезе ортопедической патологии нижних конечностей [5] дал основание для разработки экспериментальной модели дисплазии тазобедренного сустава (врожденного вывиха бедра). Развитие почек нижних конечностей происходит в морфогенетическом поле 26–32-й пары сомитов. Для создания модели индуцированного врожденного вывиха бедра проводили снижение экспрессии гена PAX3 путем введения липофильных малых интерферирующих рибонуклеиновых кислот (липофильные siРНК) при визуализации 26-й пары сомитов куриного эмбриона [6]. Липофильные siРНК – двухцепочная РНК длиной 21–25 нуклеотидов с ковалентно присоединенной молекулой холестерина, предназначенной для обеспечения доставки этих молекул в цитоплазму клетки. Такие siРНК действуют по природному механизму РНК интерференции: в цитоплазме клетки они входят в состав белкового комплекса RISC (RNA-induced silencing complex), который связывается с комплементарной РНК-мишенью выбранного гена и вызывает деградацию последней, в результате чего перестает синтезироваться белок. Малые интерферирующие siРНК в нано- и микромолярной концентрации вызывают направленное эффективное подавление экспрессии целевого гена [7].
Выбор вида экспериментального животного основывался на положениях закона зародышевого сходства ранних стадий развития позвоночных животных (закон Бэра). Бипедализм цыпленка полностью воспроизводит биофизические нагрузки человека; доступность проведения манипуляции на ранних стадиях эмбриогенеза определила выбор индуцирования врожденного вывиха бедра на курином эмбрионе.
Цель исследования: разработать модель дисплазии тазобедренного сустава (врожденного вывиха бедра) путем снижения экспрессии транскрипционного гена парного бокса 3 липофильными малыми интерферирующими рибонуклеиновыми кислотами на курином эмбрионе.
Материал и методы исследования. Положительное решение на проведение исследования – выписка 023/21 из протокола № 009/21 от 06.12.2021 г. Локального этического комитета ФГБУ «ННИИТО им. Я.Л.Цивьяна» Минздрава России. Работа с экспериментальными животными проводилась в соответствии с международными принципами Хельсинкской декларации о гуманном отношении к животным (2008).
Для достижения поставленной цели в эксперименте были применены липофильные siРНК, направленные на матричную РНК (мРНК) гена PAX3. Последовательность нуклеотидов мРНК гена PAX3 курицы брали из GenBank – Gallus gallus PAX3, вариант транскрипта 1, мРНК (эталонная последовательность NCBI: NM_204269.2). Методика подбора последовательности siРНК к гену PAX3 и метод синтеза представлены в ранее опубликованном материале [6].
Анти-PAX3 siРНК представляет собой 21-звенный дуплекс с 2 выступающими нуклеотидами на 3’-концах (19 в дуплексе, 2 выступают). Для обеспечения стабильности к действию рибонуклеаз в биологических тканях в состав siРНК введены 2’-O-метильные модификации в соответствии с паттерном, аналогичным описанному [8].
siРНК, направленная к мРНК гена PAX3 (анти-PAX3 siРНК) состояла из цепей следующего состава: смысловая цепь дуплекса: 5’-Chol- GCUmAGAUCmACmAUmGAAGAGUUU-3’; антисмысловая цепь дуплекса: 5’- ACUCUUCmAUmGUmGAUCUmAGCUU-3’; где Um, Cm – 2’O-метильные модификации уридина и цитидина.
Для определения специфичности действия синтезированной анти-PAX3 siРНК применяли контрольную siРНК (siScr), также состоящую из двух цепей – смысловая цепь 5’-Chol-CCmACUmACmAUmACGAGACUUGUU-3’, антисмысловая – 5’-CmAAGUCUCGUmAUmGUmAGUGGUU-3’. Контрольная siРНК (siScr) не имеет значимой гомологичной последовательностями с мРНК кур. Последовательности наиболее активной siРНК к гену PAX3 и контрольной siРНК были использованы для конструирования холестеринсодержащих конъюгатов (остаток холестерина присоединяли при помощи аминогексильного линкера для взаимодействия с LDL-частицами и клеточными мембранами, обеспечивающего проникновение в клетку) – конъюгат анти-PAX3 siРНК (Ch-siPAX) и конъюгат контрольной siScr (Ch-siScr) [9]. Биологическая активность синтезированных siРНК была подтверждена по способности подавлять экспрессию гена-мишени в культуре фибробластов куриного эмбриона [10]. Фактическое время действия siРНК в культуре составило 4 часа, затем к клеткам добавляли среду с сывороткой и инкубировали еще 68 часов. Синтезированные siРНК применяли в культуре клеток в рабочей концентрации 50 µМ. Буфер для siРНК: 30 mM HEPES-KOH (pH 7.4), 100 mM ацетат калия и 2 mM ацетат магния.
Эксперимент проводили на эмбрионах кур породы бройлер Ross 308 (Росс 308, кросс, мясные). Средняя масса одного оплодотворенного яйца составила 65–70 г. Для исключения неоплодотворенных яиц и дефектов скорлупы все яйца перед закладкой в инкубатор были проверены на портативном овоскопе ОН-10. Инкубирование всех яиц проводили в соответствии с руководством по эксплуатации бытового инкубатора БИ 2 «НЕСУШКА» на 77 яиц при выведении кур – температура 37,5–380С, влажность 50–55%.
40 оплодотворенных яиц были разделены на четыре группы. Группа наблюдения (интактные эмбрионы) – 5 яиц без экспериментальных манипуляций. В нервную трубку куриных эмбрионов экспериментальной группы (15 яиц) вводили 100 мкл Х 50 µМ анти-PAX3 siРНК (Ch-siPAX); контрольной группы (15 яиц) – контрольной siScr (Ch-siScr) соответственно. Для визуализации вводимых растворов использовали 3пановый синий (C34H24N6Na4O14S4). Группа сравнения (5 яиц) – в нервную трубку куриных эмбрионов проводили укол стерильным стеклянным капилляром без введения веществ. Экспериментальные манипуляции проводили в стерильном боксе стерильным инструментарием. Скорлупу куриного яйца обрабатывали 75%-ным спиртом, через прокол с острого конца яйца отбирали 0,3 мл белка. С горизонтальной стороны яйца формировали экспериментальное отверстие размером 0,8х1,0 см, удаляя скорлупу и подскорлуповую оболочку. Оценивали жизнеспособность эмбриона – сердцебиение. С учетом развития куриного эмбриона по классификации Гамбургер–Гамильтон (16-я стадия) введение липофильных siРНК проводили при визуализации сформированной 26-й пары сомитов. В нервную трубку куриного эмбриона (ув. х45) под визуальным контролем через конфокальный микроскоп фирмы (SteREO Discovery.V12, Carl Zeiss, Германия) при помощи инжекторного шприца фирмы (Narishige Scientific Instrument Lab., Япония) стеклянным капилляром вводили липофильную siРНК к мРНК гена PAX3 или siScr [6], контролируя анатомическую целостность тканей и диффузию веществ (рис. 1а, 1б).
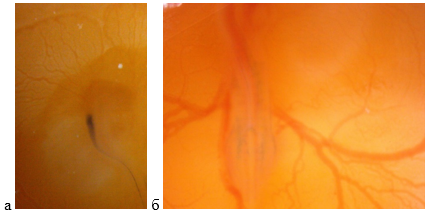
Рис. 1. Микрофотография куриного эмбриона после введения липофильной siРНК к мРНК гена PAX3 (Ch-siPAX), визуализация – трипановый синий: а) введенное Ch-siPAX в нервной трубке, ув. х40; б) диффузия в сегментированной мезодерме (сомиты), ув. х60
После выполнения экспериментальных манипуляций на сформированное отверстие накладывали крышечку из скорлупы яйца-донора вместе с подскорлуповой оболочкой и фиксировали яичным белком. Ротацию яиц совершали через 1 сутки в соответствии с физиологией эмбриогенеза куриного эмбриона [6]. Наблюдение проводили в течение всего периода инкубации яиц до выведения цыплят. Вылупившимся птенцам осуществляли содержание (плотность рассадки), уход и кормление по возрасту развития (сбалансированные витаминно-углеводно-белковые комбикорма) в соответствующих условиях для исключения развития ожирения и гиподинамии [11, с. 67–68]. В возрасте 1,5 месяца всем животным группы наблюдения, группы сравнения, контрольной и экспериментальной группы было проведено КТ-исследование. Компьютерную томографию проводили на томографе рентгеновском компьютерном (SOMATOM Go Top, Siemens Healthineers, Германия).
Результаты исследования и их обсуждение
Для достижения цели эксперимента биологическая активность анти-PAX3 siРНК (Ch-siPAX) по способности ингибировать экспрессию целевого гена PAX3 и контрольной siРНК (Ch-siScr) была проверена на фибробластах куриного эмбриона 10-дневного периода инкубации [10].
Экспрессия гена PAX3 в культуре эмбриональных куриных фибробластов (Control) была принята за 100%. После трех дней инкубации культуры фибробластов куриного эмбриона с анти-PAX3 siРНК (Ch-siPAX) показатель экспрессии гена PAX3 составил 50% по сравнению с результатами активности этого же гена в контроле (Control). Результаты экспрессии PAX3 гена в культуре фибробластов, обработанных контрольной siРНК (Ch-siScr), значимо не отличались от результатов, полученных в культуре интактных клеток (Control). Полученные авторами данные позволили применить синтезированные Ch-siPAX и Ch-siScr в эксперименте. Результаты экспрессии PAX3 гена в культуре фибробластов куриного эмбриона представлены на рисунке 2.
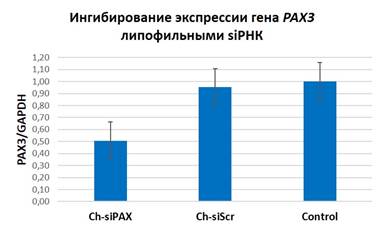
Рис. 2. Уровни экспрессии мРНК гена PAX3 в культуре фибробластов куриного эмбриона, Real-time RT-PCR – при действии анти-PAX3 siРНК (Ch-siPAX), при действии контрольной siРНК (Ch-siScr), интактные клетки (Control). В качестве внутреннего стандарта использовали уровень мРНК гена «домашнего хозяйства» GAPDH (Glyceraldehyde 3-phosphate dehydrogenase)
Выведение жизнеспособных птенцов во всех группах произошло в физиологический срок на 21-й день инкубации. За всеми животными в период роста и формирования опорно-двигательного аппарата (до 1,5 месяца) проводилось динамическое визуальное наблюдение. В группе наблюдения (интактные животные), группе сравнения (укол стерильным капилляром в нервную трубку) и контрольной группе (введение Ch-siScr в нервную трубку) не было выявлено визуальных изменений в двигательной активности птенцов: при ходьбе – равномерное свободное движение, длительное пребывание в вертикальном положении без вынужденного отдыха; в положении стоя – симметричная опора на две конечности. В экспериментальной группе (введение Ch-siPAX) у животных констатировали отсутствие возможности активного длительного движения, наблюдались ограничение подвижности (хромота), вынужденный отдых (птенцы часто ложились) при незначительном нахождении в вертикальном положении (положении стоя).
В возрасте 1,5 месяца всем животным было проведено КТ-исследование. При описании результатов лабораторно-инструментального исследования экспериментальных животных руководствовались общепринятой терминологией анатомии птиц. Структурные анатомические компоненты тазобедренного сустава человека и птиц идентичны, но имеют разные названия. У птенцов группы наблюдения, сравнения и контрольной группы результаты КТ-исследования соответствовали нормальному развитию анатомических структур нижних конечностей. Тазобедренный сустав – форма и соотношение головки бедренной кости и суставной ямки, сферичная суставная ямка, равномерная суставная щель тазобедренного сустава (рис. 3).
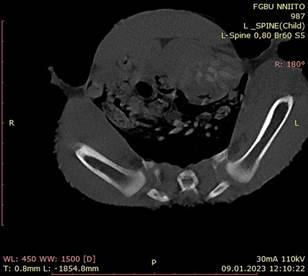
Рис. 3. КТ-исследование области тазобедренного сустава (нормальное развитие)
У цыплят экспериментальной группы были выявлены КТ-признаки дисплазии тазобедренного сустава – неравномерная, расширенная суставная щель, размеры головки бедренной кости и суставной ямки не симметричны таковым на противоположной стороне, покрытие головки суставной ямкой неполное.
КТ-признаков диспластических и структурных изменений нижележащих суставов выявлено не было. На рисунке 4 представлены результаты КТ-исследования и фотография животного с дисплазией тазобедренного сустава.
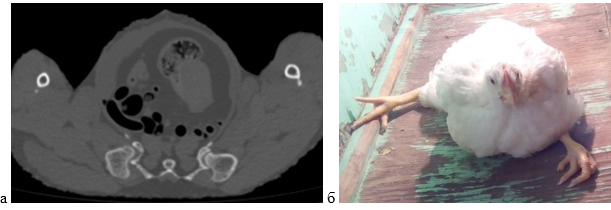
Рис. 4. Результаты КТ-исследования (а) и фотография цыпленка (б) с дисплазией тазобедренного сустава
Создание модели индуцированного врожденного вывиха бедра основано на участии клеток нервного гребня в формировании ортопедической патологии нижних конечностей.
Нервный гребень – это эмбриональная структура, которая формируется из нейральной эктодермы у эмбрионов позвоночных животных на стадии нейрулы. Клетки нервного гребня – это временная специфичная популяция мигрирующих мультипотентных стволовых клеток. Генерация клеток нервного гребня происходит в самой верхней части формирующейся нервной трубки эмбриона в период смыкания ее краевых отделов. Клетки нервного гребня образуются по всей осевой дорсальной части эмбриона, простираясь от головной части эмбриона до крестцовой области (рострокаудальная направленность) [12]. Определены четыре подтипа клеток нервного гребня в зависимости от области, в которой они образуются: краниальный нервный гребень, кардиальный и вагальный нервный гребень, туловищный нервный гребень и сакральный (крестцовый) нервный гребень [12]. Межклеточная сигнализация индукторов нервного гребня инициирует отслоение, эпителиально-мезенхимальную трансформацию и миграцию клеток нервного гребня. Отслоение клеток нервного гребня происходит в дорсальной части нервного гребня от нижележащего нейроэктодермы. Одним из ключевых эмбриональных генов, участвующих в регуляции миграционного процесса, является ген PAX3 [13, 14]. Миграция клеток нервного гребня происходит на большие расстояния вдоль оси тела эмбриона в виде временной мультипотентной эпителиально-мезенхимальной популяции, способной дифференцироваться в различные виды клеток и тканей. Существуют 3 основных пути миграции клеток нервного гребня – миграция в дорсолатеральном направлении (под эктодермой – по обе стороны от нервной трубки), вентролатеральный путь (вдоль латеральных краев сомитов, через тело самих сомитов, между сомитами), в вентрально-медиальном направлении (между сомитом и нервной трубкой – перпендикулярно оси нервной трубки, вниз) [12]. Эволюционным финишем миграционного пути клеток нервного гребня являются оседание и фенотипическая дифференцировка при участии межклеточной индукции окружающих тканей [15]. Деламинация и миграция клеток нервного гребня происходят последовательно после формирования и сегментации сомитов. Сомит – парные метамерные эмбриональные структуры сегментированной мезодермы (дорсальный отдел). Сомиты образуются вдоль продольной оси тела эмбриона и располагаются с двух сторон от нервной трубки и хорды. Каждая пара сомитов дифференцирована в дорсо-вентральном направлении на дерматом, миотом и склеротом, производными которого являются хрящевая и костная ткань у позвоночных. Клетки нервного гребня дистальнее 28-й пары сомитов (крестцовый нервный гребень) дифференцируются в энтеральные ганглии каудальной части кишечника, ганглии мочевого пузыря (позвоночные животные) [12]. Весь процесс миграции и фенотипической дифференцировки клеток нервного гребня регулируется межклеточными биохимическими процессами молекулярно-сигнальных взаимодействий окружающих тканей и самих клеток нервного гребня [12]. Сформированные 26–28-я пара сомитов и миграция клеток крестцового нервного гребня рассматриваются авторами как период, индуцирование нарушений в котором может привести к развитию дисморфогенеза анатомических компонентов тазобедренного сустава.
Последовательность патобиологических процессов может быть представлена следующим образом – изменение процесса миграции клеток нервного гребня в сформированных 26–28-й паре сомитов, вызванное ингибированием экспрессии гена PAX3 липофильными siРНК, приводит к нарушению движения клеток нервного гребня и их эктопическому оседанию. Зачатки нижних конечностей формируются в морфогенетическом поле конечности – область 26–32-й пары сомитов. Ингибирование экспрессии гена PAX3 – одного из основных эмбриональных генов миграционного процесса клеток нервного гребня – способствует их эктопической остановке в сегментированной мезодерме сомитов (склеротоме) почек нижних конечностей. Клетки крестцового нервного гребня не детерминированы к хондрогенной дифференцировке, что может приводить к нарушению формирования структурных компонентов тазобедренного сустава. Нарушения процесса формирования хрящевых структур в области эктопической локализации клеток нервного гребня (26–28-й паре сомитов) способствуют развитию нарушений формирования головки бедренной кости и вертлужной впадины.
Заключение. Создание экспериментальной модели дисплазии тазобедренного сустава основано на эктопическом оседании клеток крестцового нервного гребня в сформированных 26–28-й паре сомитов вследствие снижения экспрессии гена PAX3 липофильными siРНК. Дисморфогенез структурных компонентов тазобедренного сустава в период эмбриогенеза манифестируется развитием дисплазии тазобедренного сустава в постнатальном периоде. Клиническое проявление заболевания подтверждено КТ-исследованиями. Представленные результаты являются предварительными. Первые полученные лабораторно-клинические данные позволяют сделать подтвержденное заключение об этиологической роли гена PAX3 и клеток нервного гребня в развитии дисплазии тазобедренного сустава (врожденный вывих бедра). Дальнейшее изучение межклеточных взаимодействий на созданной экспериментальной модели дисплазии тазобедренного сустава на курином эмбрионе позволит понять ключевые звенья патогенеза данного заболевания.
Библиографическая ссылка
Пахомова Н.Ю., Строкова Е.Л., Черноловская Е.Л., Жуков Д.В., Кожевников В.В., Гутт А.А., Пахомова Д.А., Корыткин А.А. ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ДИСПЛАЗИИ ТАЗОБЕДРЕННОГО СУСТАВА (ВРОЖДЕННОГО ВЫВИХА БЕДРА) НА КУРИНОМ ЭМБРИОНЕ // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33797 (дата обращения: 11.01.2026).
DOI: https://doi.org/10.17513/spno.33797



