Введение
Препараты генно-инженерной биологической терапии (ГИБТ) внесены в ступенчатую терапию (5-я ступень) бронхиальной астмы (БА), зарегистрированы в Российской Федерации и во многих странах мира [1, 2]. При тяжелом течении астмы в клинической практике в нашей стране могут быть применены 6 препаратов: омализумаб, меполизумаб, реслизумаб, бенрализумаб, дупилумаб и тезепелумаб. Согласно данным Российского регистра пациентов с ТБА, биологические препараты получали 10,6% всех пациентов [3].
ГИБТ для лечения тяжелой БА (ТБА) уменьшают частоту обострений, улучшают контроль заболевания и качество жизни пациентов, улучшают показатели легочной функции. При гормонозависимой ТБА меполизумаб, бенрализумаб и дупилумаб снижают потребность в системных глюкокортикостероидах [1, 2]. В последние годы были обозначены предикторы наилучшей эффективности отдельных препаратов ГИБТ, основой для которых послужили результаты выполненных клинических исследований (КИ). Так, назначение омализумаба признается наиболее полезным при уровне эозинофилов периферической крови (ЭОЗ)>260 кл/мкл, оксиде азота выдыхаемого воздуха (FeNO)> 20ppb, имеющейся связи симптомов астмы с воздействием аллергенов и началом астмы в детском возрасте. ГИБТ против интерлейкина-5 и рецепторов к нему (меполизумаб, реслизумаб и бенрализумаб) наиболее эффективны при высоком уровне ЭОЗ и частоте обострений астмы, астме с поздним дебютом и наличии назального полипоза. Хороший ответ на дупилумаб ожидается при высоких уровнях ЭОЗ и FeNO [2].
Имеющаяся выраженная гетерогенность ТБА и наличие нескольких опций лечения таких пациентов, в том числе с использованием стандартной терапии и ГИБТ, обусловливают востребованность прогнозирования ответа на лечение у каждого конкретного больного, что позволило бы эффективно осуществить принцип прецизионной медицины [4-6]. Высокая стоимость лечения ГИБТ пациентов с тяжелой астмой требует активного поиска и уточнения предикторов их эффективности.
Цель исследования. Выявить предикторы эффективности ГИБТ у больных ТБА в условиях реальной клинической практики.
Материал и методы исследования
В проспективное одногодичное одноцентровое исследование были включены больные ТБА (n=200), распределенные в 2 группы (табл. 1). Больные первой группы (n=135) получали стандартную терапию: высокие дозы ИГКС / длительно действующие b2-адреноагонисты (ДДБА), у части больных применялись длительно действующие холинолитики, монтелукаст, системные глюкокортикоиды (СГКС). Во второй группе (65 пациентов) применялась аналогичная стандартная терапия и дополнительно к ней – таргетные иммунобиологические препараты: анти-IgE (омализумаб, n=9), анти-интерлейкин (ИЛ)-5 (меполизумаб, n=12), анти-ИЛ-5-рецептор (бенрализумаб, n=16) и анти-ИЛ-4,13 (дупилумаб, n=28). Протокол исследования получил одобрение локального Этического комитета СЗГМУ им. И.И. Мечникова. Пациенты включались в исследование после подписания информированного согласия. Визиты проводились каждые 3 месяца. Выполнялось стандартное клиническое обследование, функция легких исследовалась методом спирометрии (спирограф 2120 Vitalograph, Великобритания). При оценке аллергологического статуса пациентов наличие сенсибилизации подтверждалось наличием положительного теста уколом (размер волдыря ≥3 мм) либо при обнаружении повышенного специфического иммуноглобулина Е (IgE) (>0,35 КЕ/л) по меньшей мере на один ингаляционный аллерген. На автоматическом гемоанализаторе импедансным методом определялось количество ЭОЗ периферической крови, уровень FeNO оценивался на хемилюминесцентном газоанализаторе Logan-4100, Великобритания. Для поиска влияющих на исход лечения больных ТБА предикторов и оценки риска благоприятного исхода (достижения КРЗ по снижению числа ежегодных обострений астмы на ≥50%) применяли модель бинарной логистической регрессии. Исходные характеристики пациентов (демографические характеристики, данные анамнеза, клинико-функциональные показатели, данные об уровнях маркеров, проводимом лечении и др.) и динамические показатели отдельно были оценены с помощью ROC-анализа в качестве предикторов достижения КЗР. Для выявления наиболее значимых для целевой переменной предикторов использовался метод пошагового включения переменных в моделях при использовании множественной логистической регрессии. Методом ROC-анализа проводилась прогностическая оценка полученных моделей. Определяемое по площади под характеристической кривой качество распознавания модели при значениях 0,7–0,8 признавалось «хорошим», 0,8–0,9 – «очень хорошим» и при значениях 0,9–1,0 – «отличным» [7, с. 346–354]. Критическим значением ошибки первого рода при проверке статистических гипотез устанавливалось α=0,05.
Результаты исследования и их обсуждение
В таблице 1 представлена характеристика обследованных больных ТБА. Включенные пациенты переносили примерно 2 обострения тяжелой астмы за 12 предшествующих месяцев. Наиболее частыми фенотипами были атопический и с фиксированной обструкцией дыхательных путей. У пациентов с ТБА отмечались низкие показатели функции легких. У всех больных применялись высокие дозы ИГКС, и более 20% пациентов регулярно использовали пероральные СГКС. Получавшие дополнительную ГИБТ пациенты применяли более высокую ежедневную дозу ИГКС и чаще переносили обострения ТБА за предшествующие 12 месяцев по сравнению с получавшими только стандартную терапию больными.
Таблица 1
Характеристики пациентов с тяжелой бронхиальной астмой (n=200)
|
Показатель |
Группа 1 (n=135) |
Группа 2 (n=65) |
р1-2 |
|
Пол, мужчины/женщины, % |
40/60 |
35/65 |
0,532 |
|
Возраст, годы |
56 (46–61) |
53 (47–61) |
0,671 |
|
Индекс массы тела, кг/м2 |
27,7 (23,8–31,3) |
27,4 (24,1–32,0) |
0,968 |
|
Длительность астмы, годы |
18 (9–30) |
18 (14–33) |
0,218 |
|
Фенотипы БА: Атопическая, % Аспириновая, % Гормонозависимая, % С поздним дебютом (≥40 лет), % С ожирением (ИМТ≥30 кг/м2), % С фиксированной обструкцией, % В сочетании с ХОБЛ, % |
80 17 20 53 35 70 24 |
75 19 28 43 39 77 29 |
0,459 0,806 0,224 0,431 0,617 0,333 0,403 |
|
Контроль астмы ACQ-5, средний балл |
2,70 (2,14–3,14) |
2,71 (2,33–3,33) |
0,764 |
|
Качество жизни SGRQ, общий балл |
52 (43–60) |
50 (36–64) |
0,534 |
|
ОФВ1, % должного |
50 (41–60) |
53 (45–60) |
0,588 |
|
Число тяжелых обострений астмы в течение предшествующего года, n |
2,0 (1,0–2,0) |
2,0 (1,0–3,0) |
0,036 |
|
Курение в настоящее время, % |
18 |
18 |
0,787 |
|
Индекс курящего человека, пачко-годы |
19 (5–36) |
25 (10–40) |
0,157 |
|
Пассивное курение, % |
33 |
35 |
0,697 |
|
Вредные условия на производстве, % |
30 |
23 |
0,333 |
|
ИГКС, суточная доза, мкг* |
1086±44 |
1408±81 |
<0,001 |
|
СГКС, суточная доза, мг* |
9±1 |
12±2 |
0,315 |
|
ЭОЗ, кл/мкл |
236 (131–427) |
326 (170–526) |
0,127 |
|
FeNO, ppb |
18 (12–36) |
23 (12–54) |
0,511 |
Примечание: расшифровка использованных сокращений приведена в тексте.
Количественные данные представлены в виде Me (Q1-Q3), где Me-медиана, Q1 – 25-й перцентиль, Q3 – 75-й перцентиль. Качественные переменные представлены в виде относительных частот (проценты). *Дозы ИГКС представлены в микрограммах в пересчете на беклометазона дипропионат [1], СГКС – в пересчете на преднизолон (мг) и представлены в виде M±m
Наиболее важным результатом лечения больных ТБА считается снижение количества или полное отсутствие обострений астмы [7]. Данный параметр являлся первичной конечной точкой в большинстве клинических исследований, посвященных лечению ТБА, на него ориентируются в реальной клинической практике, и этот показатель заложен в основу активно разрабатываемых в настоящее время концепций клинической и полной ремиссии астмы [8-10]. Достижение или недостижение КЗР по снижению числа обострений ТБА на 50% и более через 12 месяцев терапии было использовано в данной работе в качестве результата лечения при построении прогностических моделей.
В таблице 2 представлены выявленные методом ROC-анализа предикторы достижения КЗР по снижению числа обострений ТБА на 50% и более независимо от метода лечения.
Таблица 2
Значимые предикторы для достижения/недостижения КЗР по снижению числа обострений у больных ТБА через 12 месяцев при использовании любых методов лечения
|
Предикторы достижения КЗР |
р |
Предикторы недостижения КЗР |
р |
|
Использование ГИБТ |
<0,001 |
Суточная потребность в КДБА через 3 месяца лечения, n |
<0,001 |
|
Обострений за предшествующий год, n |
<0,001 |
FeNO, ppb – через 3 месяца |
<0,001 |
|
Длительность аллергического ринита, годы |
0,002 |
Контроль астмы (средний балл ACQ-5) через 3 месяца |
0,005 |
|
ИГКС – суточная доза в пересчете на БДП, мкг |
0,006 |
FeNO≥20 ppb через 3 месяца |
0,012 |
Для оценки вероятности достижения КЗР по снижению числа обострений ТБА для каждого пациента на основании исходных характеристик и ряда динамичных показателей через 3 месяца лечения был проведен пошаговый регрессионный анализ (метод с включением), завершившийся на 5-м шаге. На 1-м шаге была включена переменная использования ГИБТ, на 2-м шаге – наличие атопического дерматита, экземы в детстве, на 3-м – уровень FeNO через 3 месяца, на 4-м – количество обострений за предшествующий год (n), на 5-м шаге – суточная потребность в препаратах скорой помощи (кол-во ингаляций) через 3 месяца, и была получена формула для оценки вероятности достижения КЗР (снижение числа обострений ТБА на ≥50%). Методом ROC-анализа была проведена прогностическая оценка полученной модели логистической регрессии (рис. 1). Площадь под ROC-кривой для модели составила 0,892 (0,841–0,944); качество распознавания признается «очень хорошим».
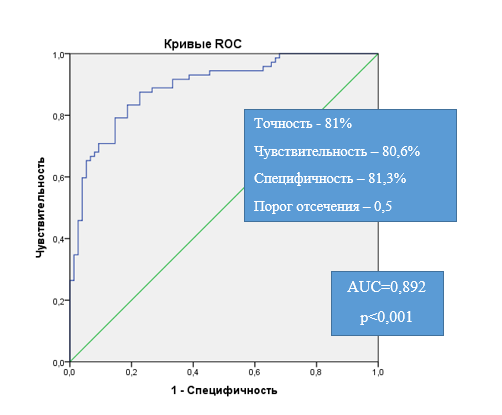
Рис. 1. ROC-кривая чувствительности и специфичности модели 1 благоприятного течения заболевания (с достижением КЗР по снижению числа обострений ТБА) при разных методах лечения
Примечание: AUC (area under ROC curve) – площадь под ROC-кривой. Р – уровень значимости.
В таблице 3 представлены выявленные предикторы снижения обострений ТБА на 50% и более при лечении пациентов с использованием биологической терапии.
Таблица 3
Предикторы достижения/недостижения КЗР по снижению числа обострений у больных ТБА через 12 месяцев терапии с использованием препаратов ГИБТ
|
Предикторы достижения КЗР |
р |
Предикторы недостижения КЗР |
р |
|
Обострений за предшествующий год, n |
<0,001 |
Атопический дерматит, экзема в детстве |
0,020 |
|
ЭОЗ, кл/мкл |
0,020 |
Наличие сопутствующей ХОБЛ |
0,040 |
|
МОС50, литры – через 3 месяца |
0,030 |
|
|
|
ОФВ1, % должного – через 3 месяца |
0,050 |
|
|
Для оценки вероятности достижения КЗР в группе больных ТБА, получавших стандартную и дополнительно биологическую терапию, на основании исходных характеристик и уровней динамичных переменных через 3 месяца лечения был применен пошаговый регрессионный анализ (метод с включением), завершившийся на 5-м шаге. На 1-м шаге была включена переменная «наличие атопического дерматита, экземы в детстве»; на 2-м – ОФВ1, %, должного через 3 месяца; на 3-м – количество обострений за предшествующий год (n); на 4-м – ЭОЗ ≥150 кл/мкл; на 5-м – КДБА (суточная потребность в КДБА через 3 месяца). Методом ROC-анализа была проведена прогностическая оценка полученной модели логистической регрессии (рис. 2). Для данной модели рассчитанная площадь под ROC-кривой была равна 0,940 (0,881–0,999); качество распознавания модели считается «отличным».
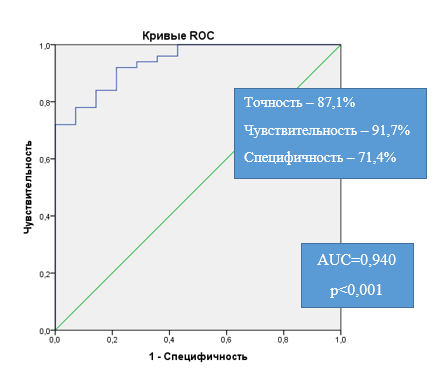
Рис. 2. ROC-кривая чувствительности и специфичности модели 2 течения заболевания с достижением КЗР по снижению числа обострений ТБА при использовании ГИБТ
С достижением КРЗ по снижению числа обострений ТБА на ≥50% были значимо связаны количество обострений астмы за предшествующий год (р=0,019) и уровень ЭОЗ ≥150 кл/мкл (р=0,022), наличие которых у пациента, после учета прочих предикторов, увеличивает риск благоприятного исхода в 31,5 раза. При прогнозировании эффекта лечения у применявших ГИБТ больных ТБА с использованием метода пошагового включения переменных в логистической регрессии было выявлено, что наиболее значимым параметром, ассоциированным с достижением КЗР, по снижению числа обострений ТБА через 12 месяцев было количество обострений в течение предшествующего года. Сходные результаты неоднократно были получены в рандомизированных КИ по изучению эффективности препаратов ГИБП и исследованиях повседневной клинической практики, где более выраженное действие на обострения отмечалось у пациентов, исходно имевших большее число обострений БА («чем хуже, тем лучше»). По результатам когортного исследования с использованием данных международного регистра тяжелой астмы было показано влияние сопутствующих Т2-заболеваний на эффективность биологической терапии; так, у больных ТБА с сопутствующим хроническим риносинуситом (с полипами или без таковых) отмечались более выраженное снижение числа обострений астмы и улучшение контроля заболевания по сравнению с не имевшими синусита и полипоза [11]. При анализе данных более 2 тысяч пациентов с ТБА из международного регистра доля достигших КЗР по снижению числа обострений ТБА на ≥50% была выше у получавших меньшую суточную дозу СГКС, у не применявших препараты теофиллина и не имевших остеопороза, а также при наличии в анамнезе атопического дерматита; при этом не было выявлено связи с исходно более высокими уровнями маркеров (ЭОЗ, FeNO и IgE общий) [10].
Авторами было получено, что для пациентов с ТБА дополнительное применение ГИБТ повышает риск благоприятного исхода (т.е. достижения КЗР по снижению числа обострений) в 7,6 раза по сравнению с получающими только стандартную терапию. Следовательно, практически каждый больной тяжелой астмой, у которого не удается достичь контроля на фоне применения оптимизированной стандартной терапии, должен быть оценен в качестве возможного кандидата для получения иммунобиологической терапии. Использование полученных через 3 месяца показателей (функции легких, уровень биомаркеров Т2-воспаления, суточная потребность в КДБА) дополнительно к исходным характеристикам существенно повышает точность прогнозирования эффективности лечения через год и позволяет принять решение о его модификации.
Заключение
Наиболее значимыми предикторами эффективности ГИБТ при ТБА являлись частота обострений в течение предшествующего года и уровень эозинофилов периферической крови ≥150 кл/мкл.
Библиографическая ссылка
Сергеева Г.Р., Емельянов А.В. ПРЕДИКТОРЫ ЭФФЕКТИВНОСТИ ИММУНОБИОЛОГИЧЕСКИХ ПРЕПАРАТОВ У БОЛЬНЫХ ТЯЖЕЛОЙ БРОНХИАЛЬНОЙ АСТМОЙ // Современные проблемы науки и образования. 2024. № 6. ;URL: https://science-education.ru/ru/article/view?id=33753 (дата обращения: 11.01.2026).
DOI: https://doi.org/10.17513/spno.33753



