Генетическими причинами канцерогенеза являются изменения в последовательности ДНК, ведущие к нарушению контроля клеточной пролиферации, механизмов репарации, апоптоза и сигнальной трансдукции. Генетическая нестабильность, вместе с неограниченной клеточной пролиферацией, способствует накоплению в клетках мутаций, необходимых для образования опухоли. Одной из таких предпосылок является ослабление функции чекпойнтов клеточного цикла, в результате которого клетка с поврежденной структурой ДНК и хромосомами продолжает делиться и умножает число своих аномальных потомков. В результате неограниченной клеточной пролиферации, нередко выходящей за пределы своей ткани и способности неопластического клона к росту, возникают злокачественные новообразования различной локализации.
Наиболее распространенным «женским» видом рака является рак молочной железы (РМЖ). По данным ВОЗ, в 2020 году зафиксировано более 2,26 миллиона случаев РМЖ, что составляет 11,7% от всех случаев злокачественных новообразований [1]. Общее число летальных случаев от РМЖ в 2020 году достигло 685,0 тысяч человек (6,9% всех случаев смерти от рака). Уровень смертности от РМЖ уступает только раку легких и злокачественным новообразованиям желудочно-кишечного тракта.
Согласно статистическим данным, ежегодно в России раком молочной железы заболевает около 46 тысяч женщин [2]. В Кабардино-Балкарии в структуре заболеваемости злокачественными новообразованиями рак молочной железы занимает лидирующее место. По данным Минздрава Кабардино-Балкарской Республики, по состоянию на 2021 год общее число больных РМЖ - 3381 человек [2].
Большинство видов опухолей человека развивается спорадически, однако на сегодняшний момент известно около 50 наследственных форм рака. Многие гены предрасположенности к раку наследуются согласно законам Менделя. Обычно мутации одного аллеля недостаточно для развития опухоли. Для направления клетки в сторону канцерогенеза нужна по меньшей мере еще и другая соматическая мутация во второй копии гена. Кроме того, для проявления ракового фенотипа клеток обычно требуются дополнительные мутации в других генах.
Мутации и нарушение экспрессии характерны в раковых клетках для двух категорий генов: протоонкогенов и генов-супрессоров опухолевого роста. Причиной возникновения наследственного рака молочной железы являются в том числе и мутации в генах-супрессорах, контролирующих клеточный цикл, процессы апоптоза и репарацию повреждений ДНК. В здоровых клетках гены-супрессоры должны задерживать прохождение клеточного цикла в ответ на повреждение ДНК или внешние сигналы остановки клеточного роста. В случае мутации или инактивации генов-супрессоров нормальное прохождение клеткой сверочных точек (чекпойнтов) нарушается или они теряют способность к апоптозу при значительных повреждениях клеточной ДНК. Это приводит к дальнейшему накоплению мутаций и к постоянному делению клеток без фазы покоя. При инактивации сразу двух аллелей гена-супрессора опухолей и других генетических нарушений, стимулирующих рост и деление клеток, они могут стать канцерогенными.
Определенные высокопенетрантные мутации в генах значительно увеличивают риск развития РМЖ, причем чаще всего здесь задействованы гены BRCA1, BRCA2, TP53, CHEK2, и т.д. На сегодняшний момент известно множество различных мутаций разной степени пенетрантности, которые связаны с риском развития РМЖ, в том числе и мутации в гене CHEK2 (ген чекпойнткиназы) [3].
Потеря контроля над клеточной пролиферацией – основное генетическое нарушение в опухолевых клетках. Рост и дифференцировка клеток находятся под строгим контролем, иначе целостность органов и тканей будет нарушена за счет аномальных типа и количества клеток, входящих в их состав. В регуляцию клеточного цикла, апоптоза и клеточного ответа на внешние сигналы вовлечено множество генных продуктов. В опухолевых клетках многие из контролирующих эти функции генов экспрессируются аномально, что приводит к неконтролируемой клеточной пролиферации.
В ответ на повреждение ДНК и блокировку репликации развитие клеточного цикла останавливается за счет контроля важных регуляторов клеточного цикла. Белок, кодируемый геном CHEK2, является регулятором контрольной точки клеточного цикла и супрессором опухоли. Он содержит домен взаимодействия белка, необходимый для активации в случае повреждения генетического материала, и быстро фосфорилируется в ответ на блоки репликации и повреждение ДНК. Известно, что при активации кодируемый белок ингибирует фосфатазу CDC25C, предотвращая вступление в митоз, и стабилизирует белок-супрессор опухоли p53, что приводит к остановке клеточного цикла в G1 фазе. Кроме того, этот белок взаимодействует с BRCA1 и фосфорилирует его, позволяя BRCA1 восстанавливать выживаемость после повреждения ДНК. Мутации в этом гене связаны с синдромом Ли-Фраумени, высокопенетрантным фенотипом семейного рака, обычно связанным с наследственными мутациями в TP53. Кроме того, считается, что мутации в этом гене обусловливают предрасположенность к саркомам, раку молочной железы и опухолям головного мозга. Этот ядерный белок является членом подсемейства CDS1 серин-треониновых протеинкиназ [3].
Впервые мутации в гене CHEK2 были обнаружены в работе Bell et al. [4], в которой указывалось на 3 мутационные точки у лиц с наследственным синдромом Ли-Фраумени - это 2 варианта 1100delC и вариант 470T>C (Ile157Thr). С этих исследований началось широкое изучение полиморфизма в этом гене и его связь с предрасположенностью к раку молочной железы.
Мутация в гене CHEK2 (Ile157Thr) чаще всего наблюдается у пациенток, имеющих высокий риск развития эстроген-позитивного рака молочной железы, особенно в раннем возрасте. Согласно литературным данным, частота встречаемости данной мутации в России – 2,7% от всех случаев данного вида онкопатологии [5]. Наличие мутаций в этом гене также связывают с другими типами злокачественных новообразований: рака желудка, саркомы, рака почки и предстательной железы.
Наиболее изученными мутациями гена CHEK2 в популяции российских пациентов являются следующие варианты: 1100delC, Ile157Thr, IVS2+1G>A, del5395. В Российской федерации эти вышеперечисленные мутации включены в диагностические панели, однако популяционных исследований, характеризующих систематическую оценку встречаемости этих мутаций, не проводилось. Популяция Кабардино-Балкарской Республики не изучена по данному вопросу полностью.
В связи с этим целью данной работы является изучить частоту встречаемости высокопенетрантных мутаций CHEK2 (1100delC, Ile157Thr) у больных раком молочной железы и здоровых жительниц Кабардино-Балкарии, а также выявить клинико-морфологические характеристики исследованных больных (возрастной состав, семейный анамнез, пик манифестации заболевания, менструально-овариальная функция, размер опухоли на момент постановки диагноза).
Материалы и методы исследования
Известно, что рак – это генетическое заболевание, вызванное накоплением мутаций, которые приводят к неконтролируемой клеточной пролиферации и метастазированию. Каждый этап канцерогенеза является результатом возникновения двух или более генетических нарушений, которые приводят к злокачественному росту опухоли. При накоплении генетических нарушений опухолевые клетки неограниченно пролиферируют, быстро распространяются и получают селективное преимущество перед другими клетками. В настоящее время постоянно проводятся попытки идентифицировать соматические мутации, которые связаны с появлением раковых клеток. Для этого необходимо сравнивать последовательности ДНК нормальных и опухолевых клеток, а также лиц, имеющих данное заболевание, и контрольную здоровую группу.
Для изучения встречаемости мутаций в гене CHEK2 в популяции Кабардино-Балкарии была использована ДНК жительниц республики, выделенная из лимфоцитов периферической крови, и сформированы группы контроля и опыта. Опытная группа насчитывала 70 образцов ДНК женщин, больных раком молочной железы. В контроле принимало участие 50 человек - это группа женщины, проживающих в республике, у которых данной онкопатологии не выявлено.
Для выявления клинико-морфологических особенностей развития ассоциированных опухолей были изучены истории болезней пациенток с морфологически верифицированным диагнозом РМЖ и исследуемой мутацией в данном гене. Клинические характеристики включали анализ возрастного состава опытной группы, пик манифестации заболевания, изучение семейного анамнеза и распределение больных по характеру менструально-овариальной функции, а также размер опухоли на момент постановки диагноза.
При генотипировании, в рамках исследований проводили анализ повторяющихся founder-мутаций в гене CHEK2 - двух вариантов: 1100delC и Ile157Thr.
Для выделения ДНК использовали набор реагентов QIAamp DNA Blood Mini Kit (производитель – фирма Qiagen, Германия). При проведении полимеразной цепной реакции (ПЦР) был использован набор реагентов для проведения аллель-специфичной (АС) полимеразной реакции (производитель – ООО НПФ «Литех»). Амплифицированные специфические фрагменты ДНК выявляли методом электрофореза в 2%-ном агарозном геле. Генотипирование проводили, также используя ПЦР в реальном времени (Real-Time PCR).
Статистическую обработку данных проводили, используя критерий хи-квадрат (χ2).
Результаты исследования и обсуждение
Поиск мутаций 1100delC и Ile157Thr в гене CHEK2 был проведен на образцах ДНК больных (n=70) и здоровых женщин (n=50) популяции КБР. Имеющаяся в распоряжении Медико-Биологического центра КБГУ коллекция образцов ДНК лимфоцитов периферической крови онкологических больных жителей Кабардино-Балкарии была собрана на базе Республиканского онкологического диспансера. Диагноз «рак молочной железы» был верифицирован морфологически. В ходе исследований проводилось анкетирование, где были собраны клинико-генетические и популяционные характеристики участников исследования.
Возраст участников эксперимента был от 32 до 86 лет. В наших исследованиях приняли участие женщины основных трех этнических групп, проживающие на территории республики: русские, кабардинцы и балкарцы. Этническая принадлежность была отмечена в связи с разным носительством мутаций и полиморфных вариантов в различных этнических группах.
При анализе возрастного состава участниц эксперимента были выявлены следующие возрастные диапазоны; опытная группа – возрастной диапазон 32-86 лет (средний возраст 75 лет). В контрольной группе возраст участниц эксперимента от 32 до 69 лет (средний возраст 41 год). Пик манифестации заболевания, развитие выраженных клинических проявлений болезни были отмечены в возрасте от 50 до 59 лет - 40% (рис.).
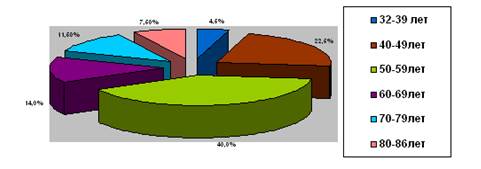
Возрастной состав опытной группы
Случаи онкопатологий в семье у исследуемой группы лиц
При проведении анкетирования нами было выявлены случаи заболевания онкологическими болезнями у родственников участниц эксперимента. У 5 пациенток (что составляет 7% от общей выборки) с диагнозом «рак молочной железы» в семьях были зафиксированы случаи заболевания раком разной локализации, в том числе были выявлены случаи носительства РМЖ.
Распределение больных раком молочной железы по характеру менструально-овариальной функции
Ранний возраст менархе и поздняя менопауза являются фактором повышенного риска возникновения рака молочной железы. Изменение гормональной функции яичников, повышенная выработка пролактина, изменение в работе щитовидной железы, гипофиза и гипоталамической системы должны рассматриваться как возможные сигналы к ранней диагностике и профилактическому осмотру у женщин [6].
Среди исследуемой опытной группы пациенток с РМЖ средний возраст менархе 13,6 года. Статистических различий по характеру менструально-овариальной функции среди контрольной и опытной группы не выявлено. Кроме того, учитывали вредное воздействие, которому подвергались люди в процессе работы на производстве, в результате которого злокачественные опухоли различной локализации могут возникать при длительном контакте со специфическими канцерогенами при выполнении профессиональных обязанностей. Среди анализируемой выборки 6 человек (8,5%) были подвержены такому воздействию.
Анализ частоты мутаций гена CHEK2 у больных раком молочной железы и здоровых доноров
В нашем исследовании проведено генотипирование образцов ДНК и изучена частота встречаемости мутаций в гене CHEK2 в контрольной и опытной группах.
Частота встречаемости мутаций в гене CHEK2 представлена в таблице.
Частота встречаемости мутаций в гене CHEK2
|
Мутация CHEK2 |
РМЖ (n=70) |
Контроль (n=50) |
||
|
Позитивные |
% |
Позитивные |
% |
|
|
1100delC |
0 |
0 |
0 |
0 |
|
Ile157Thr |
9 |
12,8 |
0 |
0 |
Мутации 1100delC в гене CHEK2 не были обнаружены в образцах, принадлежащих как контрольной, так и опытной группе. Данный акт является интересным, так как, согласно литературным данным, частота аллеля 1100delC в европейской популяции составляет 0,2-1,5% [7]. Ранее ученые из Финляндии и Нидерландов в своих работах выявили взаимосвязь между носительством мутации 1100delC в гене CHEK2 и развитием РМЖ [8; 9]. В результате этой мутации при считывании мРНК происходит сдвиг рамки считывания и образование стоп-кодона, что в свою очередь приводит к синтезу дефектного белка.
В исследовании среди анализируемой группы лиц больных РМЖ выявлен высокий показатель носительства мутации гена CHEK2 Ile157Thт. Из 70 генотипированных образцов у 9 человек были отмечены замены аминокислоты изолейцин на треонин, что составило 12,8% от общей выборки (χ2=3,88; p=0.05).
При анализе клинико-морфологических особенностей можно отметить более ранний возраст манифестации заболеваний у носителей данной мутации. Согласно литературным данным, мутация в гене CHEK2 Ile157Thr достаточно распространена в мире и ассоциирована с наследственными формами РМЖ [10]. При проведении генотипирования в контрольной группе, среди здоровых лиц, исследованных мутаций не выявлено.
В ходе исследований также были изучены клинико-морфологические характеристики течения болезни лиц с диагнозом РМЖ. В эту часть исследования были включены пациентки с анализируемой мутацией Ile157Thr гена CHEK2. У 9 пациенток, согласно клиническим наблюдениям, на момент установления диагноза средний размер опухоли варьировал от 2 до 5 см, как и в общей опытной группе (82%), т.е. статистически значимых различий не установлено (р=0,038).
Изучение молекулярных механизмов, ведущих к появлению злокачественных новообразований, является современным требованием при диагностике и лечении онкологических заболеваний. Установление механизмов инактивации гена CHEK2, в результате которого происходит прекращение продукции белка опухолевого супрессора либо синтез его неактивной формы, позволяет выявить новые возможности при таргетной терапии в лечении рака. Изучение механизмов подавления работы гена супрессора CHEK2 и отсутствие контроля при прохождении клеткой цикла деления, а также нарушение в работе систем репарации и апоптоза является актуальной задачей, стоящей перед исследователями.
Заключение
В популяции Кабардино-Балкарии на анализируемой выборке выявлена высокая частота носительства (12,8%) мутации Ile157Thr, данная мутация обнаружена у 9 женщин (n=70). Мутация 1100delC в гене CHEK2 на данной изучаемой выборке не обнаружена. В дальнейшем планируется продолжить работу по увеличению анализируемой выборки и выявлению носительства других мутаций в гене CHEK2 с целью определить генетические группы риска и причины роста онкозаболеваемости в республике.
Библиографическая ссылка
Биттуева М.М., Боготова З.И., Дзамихова А.З., Шабиханова Э.И., Хандохов Т.Х. ПОЛИМОРФИЗМ CHEK2-ГЕНА У БОЛЬНЫХ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В КАБАРДИНО-БАЛКАРИИ. // Современные проблемы науки и образования. 2022. № 6-1. ;URL: https://science-education.ru/ru/article/view?id=32226 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/spno.32226



