Ксенотрансплантаты, полученные от пациентов (patient derived xenografts – PDX), представляют собой важную экспериментальную платформу для изучения эффективности противоопухолевых препаратов, в связи с чем актуальной задачей является не только разработка новых методов создания PDX, но также их корректное хранение и воспроизведение [1; 2]. В данном аспекте процедуру криоконсервации необходимо рассматривать не только как этап создания биологических коллекций опухолей, но и как элемент для практического планирования экспериментов, а также для перекрестной проверки результатов, полученных с помощью PDX, в рамках выполнения программы качества.
Процесс криоконсервации представляет собой документированную процедуру замораживания биологических образцов с целью хранения их в течение длительного времени с поддержанием жизнеспособности клеток после восстановления из криохранилища [3; 4]. Применение этой процедуры по отношению к ксенотрансплантатам, полученным от пациентов, позволяет формировать коллекцию ранних поколений PDX с возможностью оттаивания и повторной ксенотрансплантации в любое время в зависимости от потребностей исследователей [5; 6]. Кроме того, криохранение образцов PDX позволяет осуществить отсроченное применение ранее сгенерированных ксенотрансплантатов, что является целесообразной альтернативой содержанию мышей-опухоленосителей [7; 8].
Криоконсервация клеточных линий или отдельных клеток является широко распространенной в экспериментальной практике процедурой [9; 10]. Однако создание коллекций PDX предполагает работу с макроскопическими объектами, что требует иного подхода, нежели при работе с отдельными клетками или их суспензиями, так как важным моментом являются отличительные характеристики теплопередачи в объемных системах.
В связи с этим важным вопросом представляется выявление наиболее надежных способов криоконсервации и хранения PDX, способных обеспечить защиту от потери с течением времени ценных и незаменимых опухолевых образцов.
Целью данной работы являлось изучение эффективности трех различных протоколов криоконсервации образцов PDX.
Материал и методы исследования
Опухолевый материал
Криоконсервации, хранению и последующему восстановлению из криоконсервации подвергали третью генерацию подкожных PDX, полученных в ходе ранее выполненных работ в ФГБУ «НМИЦ онкологии». Всего криоконсервации было подвергнуто 12 PDX: из них 4 были ксенотрансплантатами рака пищевода, 4 – ксенотрансплантатами рака кишки, 4 – ксенотрансплантатами рака желудка,
Криоконсервация опухолевого материала
Каждый PDX подвергали трем протоколам криоконсервации:
1) протокол 1 криомикс 1 (80% RPMI1640, 10% FBS, 10% DMSO) хранение -80 °С;
2) протокол 2 криомикс 2 (90% FBS, 10% DMSO), хранение -80 °С;
3) протокол 3 криомикс 1 (80% RPMI1640, 10% FBS, 10% DMSO) + использование криоконтейнера Mr. Frosty, хранение -80 °С.
Для этого предварительно выделенный PDX делили на фрагменты размером ориентировочно 3×3×3 мм и помещали в стерильные криопробирки с завинчивающейся крышкой объемом 1,8 мл, содержавшие микс для криоконсервации. В каждую пробирку помещали по 3 фрагмента. Таким образом, от каждого из 12 ксенотрансплантатов сохранили по 9 фрагментов (по 3 фрагмента для каждого из трех протоколов криоконсервации). Средняя продолжительность хранения образцов при -80 °С была одинаковой для всех используемых протоколов и всех образцов и составила от 90 до 120 дней.
Создание подкожных PDX моделей после криоконсервации
Оттаивание образцов PDX осуществляли на водяной бане (34–37 °C), затемсодержание криопробирки помещали в чашку Петри и тщательно промывали образцы опухоли (не менее трех раз) 0,9% раствором NaCl, чтобы удалить остатки криопротектора, которые потенциально могут отрицательно повлиять на эффективность приживления.Размороженные и промытые образцы PDX имплантировали иммунодефицитным мышам подкожно. Имплантацию выполняли с применением инъекционного наркоза для лабораторных животных с использованием препаратов «Ксила» и «Золелил-100», дозы 20 и 50 мг/кг соответственно. Для исследования использовали 108 иммунодефицитных мышей Balb/c Nude, полученных из «SPF-вивария» ИЦиГ СО РАН (г. Новосибирск). Мышей содержали в SPF-виварии в системе ИВК в помещении с контролем параметров микроклимата (температура 18-25 °C, влажность 40-60%, световой режим день-ночь).
Анализ роста опухолевых ксенографтов
Замеры опухолевых узлов выполняли при помощи штангенциркуля. Размеры ксенографтов рассчитывали по формуле Шрека для эллипсоида: V=а×в×с×p/6, где V – объем опухоли (мм3), а, в, с – максимальные диаметры эллипсоида в трех плоскостях (мм).
Анализ эффективности протокола криоконсервации
В качестве критериев эффективности протокола криоконсервации оценивали эффективность приживления ксенотрансплантата, выраженную в %, и длительность латентной фазы (время от момента имплантации опухолевого фрагмента до начала роста), выраженную в сутках.
Статистический анализ
Статистический анализ результатов исследования выполнили с помощью программы Statistica 12.0 (StatSoft Inc., США). Данные представлены в виде выборочного среднего значения, стандартной ошибки среднего. Достоверность различий средних величин независимых выборок оценивали с помощью параметрического критерия Стьюдента.
Результаты исследования и их обсуждение
Жизнеспособные биологические ткани, имеющие значимый потенциал для проведения как фундаментальных исследований, так и доклинических испытаний, нельзя длительное время сохранять при простом замораживании в связи с явлениями образования кристаллов льда, осмотического шока и повреждения мембраны, возникающих вследствие замораживания-оттаивания, что приводит к гибели клеток [3].В данном аспекте предотвращение клеточного повреждения в процессе криоконсервации является важным научным вопросом, в связи с чем поиск наиболее эффективного протокола рассматривается нами как приоритетная задача, имеющая большое практическое значение. Учитывая плюрализм мнений относительно оптимальных условий для сохранения жизнеспособности клеток и тканей при экстремально низких температурах, становится очевидной необходимость выполнения оценки имеющихся возможностей, а также представление надежного метода криоконсервации PDX. В связи с этим нами были выполнены работы по криоконсервации образцов PDX c использованием различных вариантов криомиксов и криоконтейнера Mr. Frosty в качестве дополнительного оборудования.
В ходе данной работы каждый из 12 уникальных PDX был подвергнут процедуре криоконсервации согласно трем различным протоколам, то есть каждому протоколу соответствовал одинаковый комплект из 12 криопробирок. Каждая криопробирка вне зависимости от используемого протокола содержала по три фрагмента PDX. Схема криоконсервации образцов представлена на рисунке 1.
 |
После процедуры оттаивания каждый из фрагментов был подкожно имплантирован иммунодефицитной мыши (1 процедура – 1 криопробирка – 3 фрагмента – 3 мыши), затем была выполнена оценка приживления и скорости роста 108 опухолевых ксенотрансплантатов. Результаты оценки приживления после восстановления из заморозки приведены в таблице.
Оценка приживления образцов PDX после применения различных вариантов протокола криоконсервации
|
Используемый протокол |
Количество животных |
Эффективность приживления
|
|
|
количество животных с успешным приживлением /общее количество животных |
% успешного приживления/% общего количества |
||
|
Протокол 1 |
36 |
11/36 |
30,5/100 |
|
Протокол 2 |
36 |
26/36 |
72,2/100 |
|
Протокол 3 |
36 |
27/36 |
75,0/100 |
Оценка результатов показала, что при выполнении протокола 1 общая эффективность приживления составила 30,5% (успешное приживление 11 из 36 опухолевых фрагментов), при этом в двух случаях из двенадцати не произошло приживление ни одного из трех имплантированных иммунодефицитным мышам фрагментов ксенотрансплантата, что указывает на потенциальную вероятность утраты уникальных образцов PDX при использовании этого протокола криоконсервации.
Для протокола 2 общая эффективность приживления составила 72,2% (успешное приживление 26 из 36 опухолевых фрагментов), а в рамках выполнения протокола 3 общая эффективность приживления составила 75,0% (успешное приживление 27 из 36 опухолевых фрагментов).
Полученные данные продемонстрировали более высокие показатели эффективности приживления при применении протокола 2 и 3 в сравнении с протоколом 1, однако ни одна из процедур не продемонстрировала 100% приживления. В связи с этим целесообразно предложить в качестве обязательного условия работы с восстановленными из криосохранения образцов PDX использование нескольких животных (от 3 до 5 голов), так как использование одной особи и отсутствие дублирующих экземпляров может привести к потере уникальных образцов PDX.
Помимо оценки эффективности приживления, нами также была проанализирована длительность латентной фазы, представляющая собой время от момента имплантации опухолевого образца до первой пальпации растущей опухоли. Результаты оценки длительности латентной фазы, соответствующей каждому из использованных нами протоколов, представлены на рисунке 2.
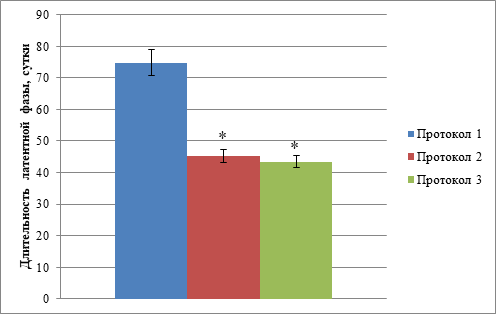
Рис. 2. Сравнение длительности латентной фазы при росте ксенотрансплантатов после криоконсервации в зависимости от используемого протокола
Примечание: * - статистически значимые различия относительно длительности латентной фазы при применении протокола 1, p <0,001.
Было установлено, что длительность латентной фазы, соответствующая протоколу 1, составила 76,1±4,1 суток, при этом длительности латентной фазы для протокола 2 и протокола 3 были значимо короче и составили 46,0±2,1 суток (p <0,001) и 44,8±2,0 суток (p <0,001). Значимых различий между продолжительностью латентной фазы, соответствующей протоколу 2, и длительностью латентной фазы, соответствующей протоколу 3, не было зафиксировано.
Важно отметить, что криомикс 1, используемый для протокола 1 и 3, представляет собой один из широко применяемых растворов для криоконсервации с криопротектором, основная часть которого состоит из питательной среды для культуры клеток. В литературе наиболее часто в качестве стандартных миксов для криоконсервации упоминаются различные комбинации питательных сред для культивирования клеток, сывороточного альбумина или фетальной бычьей сыворотки (fetal bovine serum – FBS) и криопротекторных агентов, при этом растворы культуральных сред и сыворотки выполняют роль аналога внеклеточной жидкости и имитируют условия, нужные для поддержания жизнедеятельности клеток, а криопротекторы защищают от низкотемпературной деструкции [5].
В качестве криопротектора в данной работе для всех вариантов протоколов использовали диметилсульфоксид (ДМСО), добавляя его в количестве 10% от всего объема криомикса. На сегодняшний день ДМСО является одним из наиболее широко используемых криопротекторов, предназначенных для эффективного криосохранения живых клеток и тканей. Его протективное действие реализуется за счет снижения концентрации электролитов в клетках и растворах вокруг нее при любой температуре, однако при этом ДМСО может приводить к повышенному метилированию ДНК и изменению гистонов, создавая тем самым определенные трудности для его использования в рутинных процедурах [11–13].
Для протокола 3, помимо криомикса, содержащего среду для культивирования клеток, сыворотку и ДМСО, использовали также контейнер Mr. Frosty,разработанный для медленного замораживания живых клеток. Применение подобного рода контейнеров или другого дополнительного оборудования позволяет избежать резкого понижения температуры и обеспечивает равномерное охлаждение со скоростью -1 °C/мин., которая является оптимальной для сохранения жизнеспособности тканей.
Анализ литературных данных продемонстрировал, что поиск и разработка оптимального решения для выполнения наиболее эффективной криоконсервации PDX является актуальной задачей в сфере трансляционных исследований. Например, в исследовании Ivanics T. (2018), выполненном по схожему с предложенным в нашей работе дизайном, была выполнено криосохранение 57 уникальных образцов PDX согласно стандартному и специализированному протоколу, однако из 57 PDX только 7 были подвергнуты криоконсервации согласно обоим протоколом. Авторы данной работы для стандартной процедуры криоконсервации использовали RPMI1640, содержащую 10% ДМСО и 10% фетальной бычьей сыворотки, как это было выполнено и в нашем исследовании, а в качестве специализированной криосреды – Cryostor™CS10. Авторами продемонстрированы более высокие показатели эффективности приживления и более короткое время формирования опухолевого узла при криоконсервации с использованием специализированной криосреды, чем при применении традиционных миксов, что указывает на превосходство первых, но тем не менее значительная вариативность времени хранения замороженных образцов, колеблющаяся от 29 до 177 недель, указывает на необходимость разработки и применения дизайна, позволяющего получить более сопоставимые данные [5].
Также немаловажно упомянуть, что успех процесса криоконсервации зависит не только от свойств криозащитных агентов. Критическим фактором является также скорость замораживания и хранения объектов при криогенных температурах. Было показано, что при низких скоростях охлаждения в клетках происходит отток внутриклеточной воды, что препятствует образованию внутриклеточного льда, при этом оптимальная скорость охлаждения зависит от типов клеток [14]. В классических протоколах медленного охлаждения типичная скорость охлаждения составляет около 1 °C / мин., что можно обеспечить путем использования дополнительного оборудования, позволяющего контролировать скорость и температуру в ходе процесса. К такому оборудованию можно отнести программируемые морозильные камеры (FreezerPro) или более простые в эксплуатации переносные морозильные контейнеры типа CoolCell®, CryoMed LX или Mr.Frosty, используемый в ходе нашего исследования.
Также в качестве возможной альтернативы медленной заморозки с использованием спецоборудования применяют процедуру витрификации, представляющую собой процесс замораживания, при котором растворы, в которых располагаются живые объекты, не кристаллизуются при охлаждении, а приобретают стекловидное состояние [15]. Например, в работе по созданию биобанка PDX опухолей яичника был продемонстрирован опыт использования процедуры витрификации, а также выполнено сравнение эффективности приживления и длительности латентной фазы после прямого приживления, использования криомикса (фетальная бычья сыворотка+ДМСО) и витрификации, при этом авторы заявляют о том, что криоконсервация с использованием криомикса была более успешна, чем витрификация [15].
Таким образом, анализ полученных в ходе нашего исследования результатов криоконсервации с использованием различных вариантов протоколов и сравнение их с данными, представленными в работах других авторов, показал, что для сохранения способности к устойчивому росту PDX после восстановления из криоконсервации важную роль играют скорость охлаждения, в также состав криомиксов.
Заключение
Было продемонстрировано, что показатели приживления PDX и длительность латентной фазы были наилучшими из сравниваемых при применении протокола 2 с использованием криомикса на основе фетальной бычьей сыворотки с содержанием 10% ДМСО и протокола 3 c использованием криомикса на основе питательной среды с 10% фетальной бычьей сывороткой, 10% ДМСО и применением криоконтейнера Mr.Frosty, чем при использовании протокола 1 с криомиксом на основе питательной среды с 10% фетальной бычьей сывороткой и 10% ДМСО без применения Mr.Frosty. Однако, несмотря на сопоставимые показатели эффективности протоколов 2 и 3, предпочтительнее является применение протокола 3, так как использование криоконтейнера Mr.Frosty позволяет снизить расход фетальной бычьей сыворотки – наиболее дорогостоящего компонента криомикса, что является экономически целесообразным.
Библиографическая ссылка
Гончарова А.С., Ходакова Д.В., Миндарь М.В., Галина А.В., Карасев Т.С., Колесников Е.Н., Каймакчи О.Ю., Маслов А.А., Позднякова В.В. ИЗУЧЕНИЕ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ ВАРИАНТОВ КРИОКОНСЕРВАЦИИ КСЕНОТРАНСПЛАНТАТОВ, ПОЛУЧЕННЫХ ОТ ПАЦИЕНТОВ // Современные проблемы науки и образования. 2022. № 5. ;URL: https://science-education.ru/ru/article/view?id=32062 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/spno.32062



