Согласно национальным клиническим рекомендациям, вовлечение в злокачественный процесс кожи при раке молочной железы (РМЖ) расценивается как локорегиональное распространение карциномы [1–4], что автоматически позволяет отнести таких пациенток к группе первично неоперабельных и диктует необходимость проведения на первом этапе лекарственной терапии. При этом локальное хирургическое лечение часто откладывается на неопределенные сроки, определяемые эффективностью назначенной неоадъювантной терапии. Более того, в ряде случаев прорастание опухоли в кожу приводит к возникновению ран, язв с их вторичным инфицированием и, как следствие, к общей интоксикации организма, что, в свою очередь, откладывает проведение лекарственной противоопухолевой терапии и является абсолютным противопоказанием для проведения лучевой терапии [5, 6].
На настоящий момент предложен ряд схем лечения пациенток с распадающимся РМЖ, в большинстве своем подразумевающих стартовое неоперативное лечение в виде системной неоадьювантной химио- или гормонотерапии. Оперативное вмешательство предпринимается при наличии убедительной положительной динамики после проведенного неоадьювантного лечения. В то же время существуют работы, указывающие на то, что удаление первичной опухоли ассоциировано с улучшением показателей выживаемости при других заболеваниях, таких как меланома, рак почки, колоректальный рак и рак желудка. Известно, что удаление первичной опухоли устраняет опухолевую супрессию иммунитета, препятствует распространению опухолевых клеток из первичного очага и может способствовать устранению источника формирования резистентных клонов опухолевых клеток, а может просто являться циторедуктивной манипуляцией, если рассматривать первичную опухоль как просто еще один метастатический очаг [7, 8, 9]. Положительный эффект, а именно улучшение выживаемости, достигается в этой ситуации за счет снижения опухолевой нагрузки и некоторого иммуномодулирующего эффекта [10-14]. Вероятно, экстраполяция этих данных в вопросах лечения распадающихся форм рака молочной железы также может быть справедлива.
Цель работы – улучшение отдаленных результатов лечения больных с распадающимся раком молочной железы путем применения хирургического этапа в комплексном лечении рака молочной железы.
Материал и методы исследования. Основу работы составил анализ отдаленных результатов лечения 176 пациенток, находившихся на лечении с 2009 по 2015 гг. по поводу распадающегося РМЖ. В исследование включены больные с РМЖ, осложненным местным распространением и изъязвлением кожи (T4), при этом стадия заболевания соответствовала IIIb-IV согласно классификации UICC/AJCC. В статистический анализ не вошли больные, у которых на момент первичного обращения в клинику были зафиксированы рецидивные формы рака молочной железы, а также пациентки, чьи отдаленные результаты не удалось отследить по разным причинам, не связанным с течением основного или сопутствующих заболеваний.
Отобранные для проведения исследования 176 пациенток были разделены на 2 группы в соответствии с применявшимся лечебным алгоритмом:
– группа сравнения в составе 86 больных с распадающимся раком молочной железы, которые получали лечение в соответствии с общепринятыми схемами, подразумевающими стартовую неоадьювантную лекарственную или лучевую терапию, а также комбинации указанных методов лечения. На основании клинических и патогистологических сведений были определены особенности распадающегося РМЖ, оказывающие существенное негативное влияние на прогноз заболевания, и разработана схема стратификации пациенток в соответствии с риском неблагоприятного течения;
– основная группа в составе 90 пациенток, в которой практиковался тактический подход, разработанный на основе анализа результатов лечения больных группы сравнения. Ключевой компонент разработанного алгоритма подразумевал разделение больных в соответствии с риском неблагоприятного течения заболевания, высокие значения которого служили показанием к более ранним хирургическим вмешательствам, направленным на снижение онкологической нагрузки.
Сопоставимость описанных групп больных определялась путем сравнения ряда параметров – среднего возраста, коморбидного фона согласно шкале CIRS-G (Cumulative Illness Rating Scale-Geriatric), стадии заболевания, наличия и локализации отдаленных метастазов, иммуногистохимических и патогистологических характеристик опухолей.
Возраст больных варьировал от 33 до 91 года, составив 56,3±26,2 и 59,1±25,6 года для групп сравнения и основной соответственно, при этом статистически значимой разницы при сравнении указанных показателей выявлено не было (95%-ный доверительный интервал (ДИ) для разницы средних возрастов -6,6-1,1, p=0,16). С учетом возрастного состава исследуемых пациенток коморбидный фон в большинстве случаев был отягощен за счет наличия заболеваний сердечно-сосудистой, дыхательной и эндокринной систем различной степени компенсации. Объективизация тяжести сопутствующих заболевания была осуществлена путем подсчета средних значений шкалы CIRS-G. Последующее сравнение полученных результатов позволило выявить отсутствие статистически значимых различий между средними значениями указанной балльной шкалы: 13,5±10,4 балла в группе сравнения против 12,6±9,7 балла в основной группе (p=0,21).
Распространенность заболевания в исследовании определялась согласно международной классификации по системе TNM. Все больные имели распадающуюся опухоль с местным распространением и изъязвлением кожи, при этом стадия IIIb диагностирована у большей части женщин (94 человека, или 53,4%), стадия IIIc выявлена у 23 (13,1%) больных и стадия IV ‒ у 59 (33,5%) пациенток (рис. 1). Сравнение распределения согласно стадиям заболевания между исследуемыми группами продемонстрировало отсутствие статистически достоверных различий – критерий значимости р согласно тесту Колмогорова–Смирнова составил 0,2. Дальнейший, более детальный анализ стадии заболевания, осуществленный путем сравнения распределения больных согласно параметрам TNM-классификации (варьировавшим от рT4N0M0 до рT4NлюбоеM1), продемонстрировал схожие статистические результаты (p=0,58).
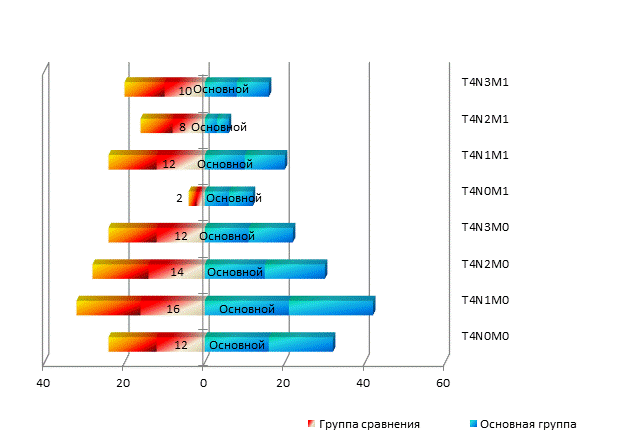
Рис. 1. Стадии заболевания исследуемых групп больных (патологоанатомическая классификация)
В таблице 1 приведена сравнительная характеристика патогистологических и иммуногистохимических характеристик опухолей в сравниваемых группах. Исходя из представленных данных существенных отличий в структуре степени злокачественности, гормональном и рецепторном статусах, а также в биологическом подтипе опухолей выявлено не было.
Таблица 1
Результаты сравнения морфологических особенности опухолей в исследуемых группах
|
Морфологическая характеристика опухоли |
Исследуемые группы (176) |
χ2 |
p |
|||
|
Сравнения (86) |
Основная (90) |
|||||
|
Степень злокачественности |
G1 |
7 (8,1%) |
8 (8,8%) |
2,29 |
0,52 |
|
|
G2 |
24 (27,9%) |
30 (33,3%) |
||||
|
G3 |
53 (61,7%) |
47 (52,4%) |
||||
|
н/д* |
2 (2,3%) |
5 (5,5%) |
||||
|
Экспрессия рецепторов к эстрогенам |
+ |
44 (51,2%) |
55 (61,1%) |
3,84 |
0,15 |
|
|
– |
40 (46,5%) |
30 (33,4%) |
||||
|
н/д |
2 (2,3%) |
5 (5,5%) |
||||
|
Экспрессия рецепторов к прогестерону |
+ |
37 (43,0%) |
40 (44,4%) |
1,35 |
0,51 |
|
|
– |
47 (54,7%) |
45 (50,1%) |
||||
|
н/д |
2 (2,3%) |
5 (5,5%) |
||||
|
HER2-статус |
1+ |
45 (52,3%) |
31 (34,4%) |
8,69 |
0,07 |
|
|
2+ |
28 (32,6%) |
30 (33,3%) |
||||
|
3+ |
3 (3,5%) |
7 (7,8%) |
||||
|
– |
8 (9,3%) |
17 (18,9%) |
||||
|
н/д |
2 (2,3%) |
5 (5,6%) |
||||
|
Средние значения Ki67 |
42,8±29,5% |
35,7±25,0% |
– |
0,09 |
||
|
Биологический подтип опухоли |
Люминальный А |
25 (29,1%) |
31 (34,5%) |
8,75 |
0,07 |
|
|
Люминальный В HER2 – |
13 (15,1%) |
24 (26,7%) |
||||
|
Люминальный В HER2 + |
6 (7,0%) |
4 (4,4%) |
||||
|
HER2 гипер-экспрессирующий |
2 (2,3%) |
6 (6,7%) |
||||
|
Трижды негативный |
38 (44,2%) |
22 (24,4%) |
||||
|
н/д |
2 (2,3%) |
3 (3,3%) |
||||
Исследуемые группы были сопоставимы как по характеристикам общесоматического фона, так и по параметрам онкологического процесса.
Лечение больных группы сравнения проводилось в соответствии с общепринятыми принципами, подразумевавшими неоадьювантную лекарственную или лучевую терапию с последующим оперативным лечением в различные сроки от обращения пациенток в лечебное учреждение. В большинстве случаев первым и единственным методом неоадьювантного лечения была химиотерапия (58 больных – 67,5% случаев). У 10 пациенток (11,6%) этот метод лечения дополнялся гормональными препаратами, а в 2 случаях (2,3%) – и местной лучевой терапией. Комбинированная химио- и лучевая терапия была проведена у 8 больных (9,3%), изолированное лечение гормональными препаратами – еще у 8 пациенток (9,3%). В дальнейшем все пациентки группы сравнения были подвергнуты оперативному лечению в различные сроки от момента обращения в стационар, значения которых варьировали от 2,1 до 87,3 месяца, составив в среднем 20,1±15,9 месяца. Наиболее частым оперативным вмешательством, практиковавшимся в группе сравнения, была мастэктомия по Patey, проведенная 64 пациенткам (73,6%), на втором и третьем местах по частоте были различные варианты санитарных ампутаций (15 больных – 18,1%) и мастэктомий по Холстеду (2 – 2,3%) соответственно. Различные варианты адъювантной терапии были проведены в подавляющем большинстве случаев – у 65 больных из 86 (75,6%).
Комплекс лечебных мероприятий, практиковавшихся в группе сравнения, соответствовал общепринятым, подразумевавшим неоадъювантную терапию в качестве up-front методики. В дальнейшем на основе сведений об отдаленных результатах такого лечения была проанализирована связь между рядом клинических, патоморфологических и иммуногистохимических характеристик, с одной стороны, и общей трехлетней выживаемостью – с другой. Однофакторному анализу подверглись ряд клинических, патогистологических и иммуногистохимических характеристик, после чего 14 параметров, обладавших наибольшими коэффициентами корреляции, были отобраны для проведения RОС-анализа с целью выявления пороговых значений. В таблице 2 суммированы результаты проведенного однофакторного анализа прогностически значимых детерминант с указанием общей выживаемости различных подгрупп пациенток, сформированных в соответствии с выявленными cut-off критериями, а также приведены соответствующие критерии значимости.
Таблица 2
Однофакторный анализ предикторов риска развития неблагоприятного исхода у женщин с распадающимся раком молочной железы в группе сравнения
|
Фактор |
Число пациентов |
ОВ (%) |
χ2 |
Log-rank test |
|
|
Возраст
|
≥55 лет |
44 |
81,4±6,9 |
5,0565 |
0,018 |
|
˂55 лет |
43 |
58,9±7,5 |
|||
|
Менопаузальный статус |
Менопауза |
78 |
88,9±10,5 |
3,503 |
0,018 |
|
Menses |
8 |
65,7±5,8 |
|||
|
Клиническая стадия |
IIIB |
43 |
70,3±5,7 |
5,4239 |
0,0254 |
|
IIIC+IV |
44 |
58,3±14,2 |
|||
|
Статус л/у*
|
N0 |
14 |
73,3±11,4 |
14,86 |
0,0019 |
|
N1 |
28 |
82,4±8 |
|||
|
N2 |
22 |
82,6±9,1 |
|||
|
N3 |
22 |
23,1±11,7 |
|||
|
Статус л/у |
N0-2 |
64 |
79,8±5,5 |
12,5824 |
0,0021 |
|
N3 |
22 |
23,1±11,7 |
|||
|
Висцеральные метастазы |
Есть |
44 |
57,1±9,4 |
5,8588 |
0,0015 |
|
Нет |
42 |
77,3±6 |
|||
|
Костные метастазы |
Есть |
17 |
64,8±16,5 |
0,7584 |
0,3886 |
|
Нет |
69 |
70,4±5,6 |
|||
|
Множественные метастазы |
Есть |
32 |
57,8±8,4 |
7,5282 |
0,0047 |
|
Нет |
54 |
77,6±6,6 |
|||
|
Степень злокачественности |
G1 |
7 |
88±10,5 |
1,4668 |
0,0242 |
|
G2 |
24 |
77,3±8,9 |
|||
|
G3 |
53 |
56,5±7,3 |
|||
|
Степень злокачественности |
G1-2 |
31 |
80,7±7,1 |
3,5707 |
0,049 |
|
G3 |
53 |
56,5±7,3 |
|||
|
Эстрогеновый статус
|
+ |
44 |
78,8 ± 6,3 |
16,6374 |
0,00004 |
|
‒ |
40 |
49,5±9,2 |
|||
|
Прогестероновый статус |
+ |
37 |
82,4±6,5 |
18,862 |
0,0000 |
|
– |
47 |
53,4±8,1 |
|||
|
Гормональный статус |
+ |
46 |
62,3±9 |
6,3456 |
0,0119 |
|
‒ |
40 |
47,6±10,9 |
|||
|
HER2 статус |
+ |
31 |
40±15,5 |
0,0034 |
0,9523 |
|
– |
53 |
62,9±7,6 |
|||
|
Ki67 статус
|
Низкий |
26 |
83,7±6,7 |
14,7195 |
0,00064 |
|
Высокий |
52 |
54,6±8,8 |
|||
|
Ki67 статус
|
≤ 15% |
36 |
81,1±5,7 |
26,9469 |
0,0000 |
|
˃ 15% |
50 |
45,3±9,6 |
|||
|
Биологический подтип
|
Люминальный А |
25 |
85,7±6,7 |
17,6223 |
0,00015 |
|
Люминальный В |
19 |
58,6±12,1 |
|||
|
Трижды негативный |
38 |
51,3±10,1 |
|||
* – лимфатический узел
В дальнейшем все выявленные факторы были включены в многофакторный регрессионный анализ, позволивший выделить ряд параметров, обладавших наибольшим прогностическим весом: статус лимфатических узлов N3, отрицательный гормональный статус, значения Ki67 более 15% и наличие висцеральных метастазов. Ранжирование округленных прогностических коэффициентов, рассчитанных с помощью уравнения логарифмированного коэффициента правдоподобия, привело к разделению упомянутых параметров на «большие» и «малые» факторы риска, имеющие связь с прогнозом заболевания (табл. 3).
Таблица 3
Прогностическая карта с выделением «больших» и «малых» факторов риска неблагоприятного прогноза
|
Параметры |
Коэффициент правдоподобия |
Прогностический коэффициент |
Округленный прогностический коэффициент |
|
«Большие» факторы |
|||
|
Статус N3 |
7,32 |
8,645111 |
8 |
|
Отрицательный гормональный статус |
4,68 |
6,702459 |
6 |
|
Ki67 более 15% |
4,49 |
6,522463 |
6 |
|
«Малые» факторы |
|||
|
Наличие висцеральных метастазов |
2,28 |
3,579348 |
3 |
|
Возраст <55 лет |
1,49 |
1,731863 |
1 |
Исходя из приведенных данных наибольшее значение округленного прогностического коэффициента имели статус лимфатических узлов N3, отрицательный гормональный статус опухоли и Ki67 более 15%, что позволило отнести указанные параметры к «большим» факторам риска неблагоприятного прогноза. Наличие висцеральных метастазов и возраст женщины младше 55 лет характеризовались меньшими значениями округленного прогностического коэффициента. На основании приведенных балльных значений был разработан индекс риска неблагоприятного течения заболевания у пациенток с распадающимся РМЖ, согласно которому все больные были стратифицированы на три подгруппы:
– высокого риска (сумма баллов >11). В группе сравнения таких больных было 49, общая трехлетняя выживаемость составила 46,9±4,5%;
– среднего риска (сумма баллов от 5 до 10). Показатель ОВ в этой подгруппе, состоявшей из 21 пациентки, был 66,5±7,4%;
– низкого риска (<5 баллов). Данная подгруппа (16 пациенток) характеризовалась наилучшим показателем трехлетней общей выживаемости – 81,2±6,6%. Различия ОВ между выделенными подгруппами были статистически достоверны (критерий χ2 Пирсона 6,7, двусторонняя асимптотическая значимость 0,036).
Приведенные данные свидетельствуют о том, что подобное разделение является обоснованным.
Описанное разделение было применено в основной группе с целью выделения подгруппы пациенток высокого риска, нуждавшихся в более активной хирургической тактике, направленной на максимально раннее снижение общей опухолевой нагрузки оперативным путем. На рисунке 2 приведена последовательность мероприятий, практиковавшаяся в основной группе, состоявшей из 90 больных с распадающимся раком молочной железы.
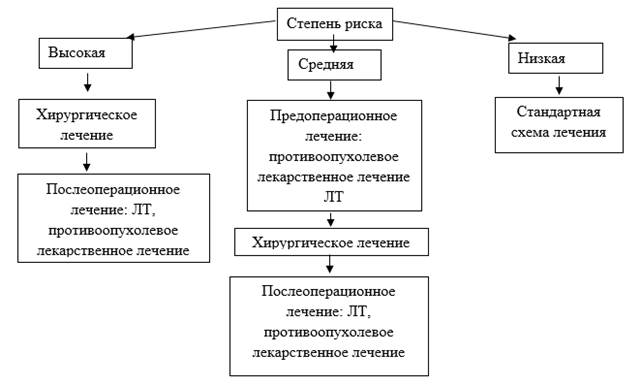
Рис. 2. Лечебный алгоритм, применявшийся в основной группе
В соответствии с предложенным индексом, все пациентки основной группы были подразделены следующим образом.
Подгруппа высокого риска (51 больная – 56,7%), в которой в качестве первичного лечебного мероприятия было избрано оперативное вмешательство. Этому контингенту больных, как правило, выполнялись обширные резекции с иссечением существенных площадей кожных покровов, требовавшие выполнения послабляющих разрезов с целью закрытия образовавшихся дефектов кожных покровов. Каждой из 51 больной в послеоперационном периоде проводилась адъювантная химио- или гормонотерапия, а также комбинации указанных методик. С учетом времени, необходимого для предоперационного стадирования опухоли и проведения иммуногистохимического анализа, оперативные вмешательства пациенткам указанной подгруппы выполнялись в кратчайшие сроки – в пределах 2 недель от обращения в стационар.
В подгруппе среднего риска, состоявшей из 29 пациенток (32,2%), в качестве up-front терапии осуществлялась лекарственная или лучевая терапия по сокращенной программе с дальнейшим оперативным лечением независимо от эффекта неоадъювантного лечения. В дальнейшем пациентки, у которых не было зафиксировано ответа на стартовую терапию, получали в обязательном порядке послеоперационную адъювантную лекарственную терапию.
Больные в подгруппе низкого риска неблагоприятного течения рака молочной железы (10 пациенток – 11,1%) получали лечение в соответствии с общепринятыми принципами, аналогичными практиковавшимся в группе сравнения.
Анализ основной и группы сравнения согласно описываемому распределению продемонстрировал отсутствие статистически значимой разницы, иными словами, средний риск неблагоприятного течения в обеих группа был примерно одинаков (критерий χ2 Пирсона 2,62, двусторонняя асимптотическая значимость 0,27).
Исходя из разработанного алгоритма специфическое дооперационное лечение проводилось в подгруппах среднего и низкого риска (39 – 43,3% больных основной группы). Сравнение структуры и длительности дооперационных мероприятий с аналогичными в группе сравнения продемонстрировало статистически значимую разницу в характере выбранного неоадъювантного лечения за счет относительного преобладания в основной группе комбинированных способов неоадъювантной терапии – химио- + гормонотерапии (критерий χ2 Пирсона 12,3, р=0,015). Подобные, более жесткие схемы обусловлены уменьшенными сроками дооперационной терапии и стремлением провести более раннее оперативное вмешательство в подгруппе больных среднего риска. Итоговая продолжительность предоперационного лечения составляла от 1,1 до 30,4 месяца, составив в среднем 7,1±6,0 месяца. Упомянутая разница в длительности предоперационного лечения в сравниваемых группах составила 13,0 месяца (95%-ный ДИ для разницы средних 9,4–16,6) в пользу основной группы.
Все пациенты основной группы были прооперированы в различные сроки после обращения в стационар: после предоперационного обследования (группа высокого риска), предоперационного лечения по сокращенной (больные среднего риска) и стандартной программам (пациентки низкого риска). Сравнительный анализ структуры выполненных оперативных вмешательств продемонстрировал несколько большее количество санитарных резекционных вмешательств в группе сравнения: 15 (17,4%) против 9 (10%) в основной группе. Впрочем, величина указанных различий не достигала статистически значимых значений (критерий χ2 Пирсона 3,84, р=0,28). Различия имелись также в частоте назначения послеоперационной терапии (92,2% в основной против 75,6% группы сравнения, критерий χ2 Пирсона 9,1, р=0,003). При сохранении приблизительно равных пропорций химио- и гормонотерапии комбинированное лечение в основной группе практиковалось чаще (отношение рисков 4,85, 95%-ный ДИ 1,87–12,56 в пользу основной группы).
Результаты исследования и их обсуждение. Эффективность разработанного алгоритма оценивалась исходя из сравнения общей и бессобытийной трехлетней выживаемости в группе сравнения и основной группы, а также частоты и структуры послеоперационных осложнений.
Неосложненный послеоперационный период имел место у 79 (87,7%) больных основной и 82 (95,3%) пациентов группы сравнения. В остальных случаях зафиксированы различные (чаще всего раневые) осложнения, связанные с проведением обширных резекционных вмешательств. Летальный исход в раннем послеоперационном периоде был зафиксирован у одной пациентки основной группы в результате развития тяжелой послеоперационной пневмонии с явлениями сепсиса на фоне метастатического поражения легких. Структура отклонений от нормального течения послеоперационного периода представлена в таблице 4.
Таблица 4
Послеоперационные осложнения в сравниваемых группах
|
Характер послеоперационных осложнений |
Исследуемые группы (176) |
|
|
Сравнения (86) |
Основная (90) |
|
|
Неосложненное послеоперационное течение |
79 (87,7%) |
82 (95,3%) |
|
Серома послеоперационной раны |
4 (4,7%) |
3 (3,3%) |
|
Заживление раны вторичным натяжением вследствие краевого некроза послеоперационной раны |
2 (2,3%) |
6 (6,7%) |
|
Бронхолегочные осложнения |
2 (2,3%) |
4 (4,4%) |
|
Желудочно-кишечное кровотечение |
1 (1,2%) |
0 |
|
Острый инфаркт миокарда |
1 (1,2%) |
1 (1,1%) |
|
Другие осложнения |
0 |
1 (1,1%) |
Таким образом, частота раневых осложнений в основной группе в среднем превышала аналогичный показатель в группе сравнения. Впрочем, статистически значимого уровня данные различия не достигали (критерий χ2 Пирсона 3,23, p=0,072).
Сравнительная характеристика временны́х параметров, зафиксированных в исследуемых группах (средних длительности наблюдения, выживания, в том числе бессобытийного, а также общей и бессобытийной трехлетней выживаемости) приведена в таблице 5.
Таблица 5
Результаты наблюдения за пациентками сравниваемых групп
|
Параметр |
Группа сравнения (86) |
Основная группа (90) |
p |
||
|
Среднее |
95%-ный ДИ |
Среднее |
95%-ный ДИ |
||
|
Длительность наблюдения, месяцев |
39,2 |
34,4–44,0 |
36,3 |
32,9–39,7 |
0,33 |
|
Длительность выживания, месяцев |
54,5 |
46,1–62,9 |
66,9 |
58,1–75,6 |
<0,05 |
|
Длительность бессобытийного выживания, месяцев |
51,9 |
44,3–59,5 |
58,3 |
50,5–66,2 |
<0,05 |
|
Количество событий |
8 (9,3%) |
– |
12 (13,3%) |
– |
0,4 |
|
Общая выживаемость, % |
69,3 |
58,3–79,5 |
76,8 |
66,2–87,4 |
0,015 |
|
Бессобытийная выживаемость, % |
69,1 |
58,5–79,7 |
68,9 |
57,9–79,9 |
0,174 |
Исходя из полученных результатов средняя длительность наблюдения существенным образом не отличалась в сравниваемых группах: 39,2 и 36,3 месяца в группе сравнения и основной соответственно. Также статистически значимых отличий не было выявлено при сравнении частоты событий – 9,3 против 13,3% (критерий χ2 Пирсона 5,48, р=0,91) – и бессобытийной выживаемости, составившей 69,3% и 68,9% в группах сравнения и основной соответственно (p=0,17). Напротив, общая трехлетняя выживаемость в основной группе, равно как и продолжительность выживания, значимо превышали аналогичные показатели группы сравнения (рис. 3 и 4).
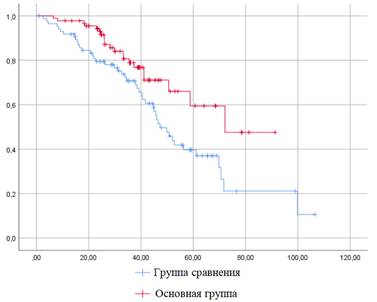
Рис. 3. Общая трехлетняя выживаемость в сравниваемых группах (p=0,015)
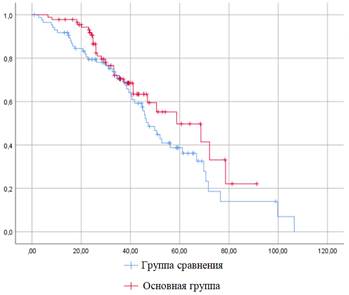
Рис. 4. Бессобытийная трехлетняя выживаемость в сравниваемых группах (p=0,174)
Таким образом, применение разработанного алгоритма позволило увеличить общую выживаемость среди пациенток основной группы без существенного влияния на остальные показатели результативности лечения. Безусловно, итоговая разница в показателях трехлетней выживаемости невелика, однако с учетом особенностей изучаемого контингента больных распадающимся раком молочной железы III и IV стадий подобные отличия имеют значение. Дальнейшая работа в данном направлении может способствовать улучшению результатов лечения пациенток с поздними стадиями рака молочной железы.
Выводы
1. Частота применения лекарственной противоопухолевой терапии, как и средняя ее продолжительность, значительно меньше за счет применения комбинированных схем и стремления осуществить раннее оперативное вмешательство.
2. Применение хирургического метода в комплексном лечении распадающегося РМЖ позволило провести «условно радикальное» лечение 152 (86,37%) больных, что дало возможность провести послеоперационное лечение в полном объеме.
3. Применение указанного алгоритма не оказывает влияния на частоту рецидивов и прогрессирования заболевания, однако способствует росту общей трехлетней выживаемости.
4. Отсутствие изменений в бессобытийной выживаемости при наличии достоверной разницы в ОВ можно объяснить снижением общей онкологической нагрузки в результате практики более ранних оперативных вмешательств; при этом какого-либо патогенетического воздействия на звенья патологического процесса не оказывается, ввиду чего частота рецидивов и прогрессирования сохраняется на прежнем уровне.
Библиографическая ссылка
Михайличенко В.Ю., Садыгова С.Н., Котков П.А., Сигуа Б.В., Самарин С.А. КОНЦЕПЦИЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ БОЛЬНЫХ С РАСПАДАЮЩИМСЯ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2021. № 6. ;URL: https://science-education.ru/ru/article/view?id=31324 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/spno.31324



