Введение.
Для понимания поведения любой сложной системы необходимо ее моделирование за счет выделения значимых параметров, причинно-следственных связей между ними, начальных и граничных условий, алгоритмов функционирования. Имея такую формализованную (упрощенную) копию системы, возможно моделировать ее поведение и объяснять кажущиеся противоречия.
В случае простых систем или очень высокого уровня формализации (упрощения), для понимания и прогнозирования поведения системы достаточно концептуального моделирования. Но, в случае сложных систем - ‑ биологических, экологических и т.д.,иных ‑ детальная концептуальная модель оказывается уже критично тяжелой для восприятия и необходимо функциональное, а также математическое моделирование, которое позволит переложить оперирование деталями на вычислительные системы.
Функциональное моделирование in vitro на человеческих клетках и тканях, полученных из клеточных линий, от доноров или с использованием плюрипотентных стволовых клеток человека, позволяет изучать многие физиологические процессы, включая регуляцию экспрессии генов и белков. При этом модельные системы обеспечивают строго контролируемую клеточную среду, которую можно оценивать в режиме реального времени, масштабировать и воспроизводить, что в ряде случаев дает значительное преимущество перед моделями на животных или клиническими исследованиями [1, 2].
Первые попытки математического моделирования относились к популяционной биологии, где для получения исходной информации о системе было достаточно полевых наблюдений. (например, модели колебаний численности хищник ‑ жертва, насекомоядные птицы ‑ растительноядные насекомые ‑ растительная биомасса, модели микробиологического роста и т.д.). По мере совершенствования экспериментальной техники и роста возможностей измерений в физиологии, появились модели болезней с периодической динамикой, электрофизиологические модели, огромное количество моделей, описывающих физиологические процессы и функционирование различных систем организма, в том числе физиологические ответы на стрессы и физическую нагрузку [3].
В настоящее время выявлено важное значение оксида азота (NO) в регуляции патофизиологических процессов легких. Накоплена доказательная база о вкладе NO в патогенез многих заболеваний респираторного тракта, таких как ХОБЛ, БА и других. [4, 5, -6]. Расширена концепция цикла оксида азота, включающая в себя и NO-синтазную и NO-синтаза независимую составляющую его синтеза и сопутствующий каскад окислительно-восстановительных в разной степени обратимых реакций, показана роль не NO-синтазных составляющих цикла. Дана развернутая характеристика субстратов для синтеза NO в организме человека, которыми могут служить оксиды азота, нитрит- и нитрат- анионы, органические нитраты, а также нитраты и нитриты пищевых продуктов. Показанаы роль значимых компонентов нитрит- и нитрат-редуктазных систем в цикле оксида азота, механизмы их активации и дезактивации (участие ферментов, кофакторов, гомеостатических показателей и др.) при различных условиях [7]. Это позволяет детализировать механизмы регулирования цикла NO для таргетного воздействия терапевтических агентов при патологических состояниях респираторной системы, ассоциированных с дисбалансом разнонаправленных каскадов продукции и модификации NO, а также может служить основой для имитационного моделирования цикла оксида азота.
Целями настоящей работы являются систематизация существующих данных о математическом моделировании процессов в респираторном тракте, и в особенности цикла NO, а также анализ перспектив практического применения.
Материалы и методы исследования.
В качестве основного источника медицинских данных при голографическом анализе литературных данных по исследуемой проблематике нами использовалась база PubMed (https://pubmed.ncbi.nlm.nih.gov/https://pubmed.ncbi.nlm.nih.gov), в качестве дополнительного источника данных, касающихся математического моделирования биологических процессов, использовалсяприменялся поисковик https://scholar.google.ru/. Глубина поиска составила 41 год (с 1980 по 2021 гг.). В качестве ключевых слов использовались следующие: кинетическое моделирование, математическое моделирование, имитационное моделирование, легких человека, оксида азота, цикла оксида азота, процессов в респираторном тракте, NO синтазы, оксид азота, атерогенное действие, апоптоз, вазодилатация, перекисное окисление липидов. Общее количество источников при сочетании ключевых слов «((kinetic) OR (mathematical) OR (imitation)) AND ((model)) AND ((nitric oxide) OR (nitric oxide cycle) OR (NOS) OR (lung))» ‑ 9300 в PubMed при низкой релевантности, 481 000 в https://scholar.google.ru/https://scholar.google.ru также при быстро снижающейся релевантности, при сочетании «(nitric oxide) AND ((vasodilatation) OR (lipid peroxidation) OR (apoptosis) OR (atherogenic))» - ‑ 33 018 в PubMed при очень высокой релевантности. Отмечено, что в последние два десятилетия количество работ по теме физиологических эффектов оксида азота стабильно высокое и не имеет тенденции к росту (14 000 с 2000 по 2010 гг. и 13 700 с 2011 по 2021 гг.)., тогда как общее количество ссылок при запросе на моделирование цикла оксида азота значительно выросло (2500 с 2000 по 2010 гг. и почти 4000 с 2011 по 2021 гг.) при сохранении низкой релевантности. Также, в базе PubMed отмечается отсутствие работ по математическому моделированию процессов в легких человека.
Математическое моделирование биологических процессов в легких.
Первые модели легких человека были сформулированы и использованы в физиологических исследованиях в середине 19-огоXIX века.
Простейшая модель легких была крайне упрощена: легкие и грудная клетка моделировались упругими оболочками (пузырями), а все воздухоносное дерево ‑ трубкой с некоторым аэродинамическим сопротивлением, которая соединяет пузырь ‑ легкие ‑ с атмосферой. Несмотря на предельное упрощение, такая модель до сих пор успешно используется при проектировании приборов для пульмонологических исследований, а также позволяет получить простейшие связи между параметрами, характеризующими легкие [8]. Эта модельОна адекватно описывает динамику дыхания здоровых людей в спокойном состоянии, когда скорости воздуха и изменения объемов невелики, а легкие по своим свойствам достаточно однородны. Но при форсированном дыхании человека или при изменении механических свойств легких в результате заболевания, простейшая модель уже не удовлетворяет экспериментальным данным. В случаях, когда легкие неоднородны по механическим характеристикам, достаточно хорошую адекватность проявляет модель двух упругих пузырей, соединенных с атмосферой разветвлением трубок (растяжимость пузырей и сопротивления в ветвях различны). Вариант данной модели, который исходит из отсутствия взаимодействия компонент, используется чаще, но не отвечает ряду экспериментальных данных [8]. В случае форсированного выдоха здорового человека достаточную адекватность показывает простейшая модель, но с использованием реальных сопротивлений и учетом динамического сужения трахеи [9]. При наличии патологически измененных тканей (неоднородные легкие), для форсированного выдоха хорошую адекватность проявляет модель, в которой легкие аппроксимируются не упругим пузырем, а вязкоупругим пористым телом, обладающим свойством релаксации напряжений [9].
Наряду с вышеописанными моделями функционирования легких, существуют модели с распределенными параметрами. Они позволяют смоделировать и исследовать механизм ограничения потока воздуха при форсированном выдохе за счет динамического сжатия дыхательных путей [8, 10]. При этом воздухоносные пути моделируются системой упругих трубок с геометрическими параметрами, соответствующими бронхиальному дереву. По элементам такой модели распределяются параметры, соответствующие физическим свойствам бронхов и действию внешних сил. Практическое применение таких моделей пока ограничено недостаточностью экспериментальных данных об указанных параметрах и необходимостью делать сильные допущения.
Возможности применения математических моделей легких для диагностических задач.
Несмотря на кажущуюся простоту и абстрактность простейшей модели легких, она позволяет снимать противоречия экспериментальных данных и теоретических построений, а также получать диагностическую ценность от кажущихся неинформативными данных.
Так, попытки оценивать тяжесть воспалительного процесса в альвеолярном отделе легких по выдыхаемому оксиду азота (NO) - ‑ маркеру воспаления, ‑ упирались в слабую корреляцию данных. Но моделирование зависимости концентрации NO в выдыхаемом воздухе от скорости выдоха и уровня NO в альвеолярном отделе легких, позволило добиться хорошей корреляции данных и дало возможность разработки необременительной для пациентов, неинвазивной методики оценки тяжести воспалительных процессов в легких, а также контроля эффективности проводимой теаррапии. Такая двухкомпартментальная модель зависимости концентрации NO в альвеолярном отделе легких от концентрации NO в выдыхаемом воздухе была впервые предложена еще в 1998 г. Н. Цукиасом и С. Джорджем [11]. Поскольку модель создавалась с целью прогнозирования интенсивности воспалительного процесса в альвеолярном отделе по выдыхаемому NO, авторы исходили из допущения, что NO ‑ достоверный показатель воспаления.
Модель состоит из нерасщепленного отсека, имитирующего воздухопроводящие пути (бронхиальное дерево), и отсека, который имитирует альвеолярную область легких. Каждый отсек окружен слоем ткани, способной поглощать и производить NO. Помимо ткани, в каждом отсеке присутствует слой крови, имитирующий бронхиальное и альвеолярное кровообращение,. Было принято допущение, что этот слой является бесконечным поглотителем NO (рис. 1).
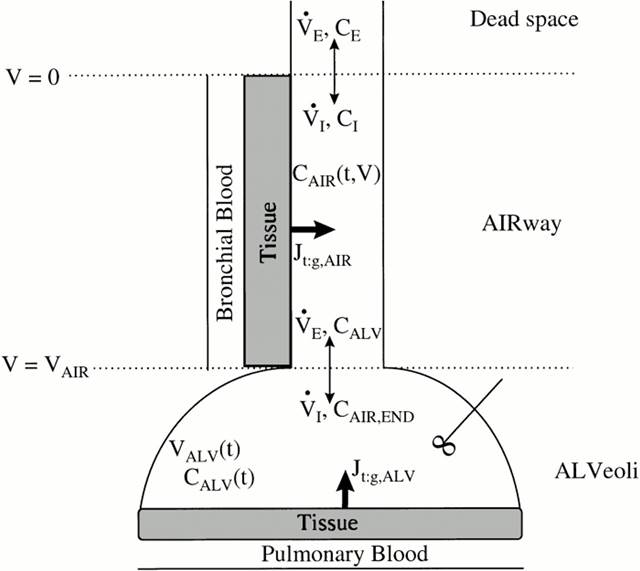
Рис. 1. Двухкомпартментальная модель зависимости концентрации NO в альвеолярном отделе легких от концентрации NO в выдыхаемом воздухе
В модели были сделаны еще несколько довольно жестких допущений:
- не рассматривались мелкие бронхи, как отдельный компартмент, за основу была взята именно простейшая модель легких, упрощенная до 2-х отсеков,;
- не учитывалась аксиальная диффузия NO.
Поскольку качество исходной модели не позволяло использовать ее, как универсальный и достоверный инструмент диагностики, авторы и другие научные группы продолжают работать над ее уточнением, верификацией и модернизацией.
В 1998 году. был представлен обзор двух способов применения упрощенного линеаризованного варианта этой модели [12]. Модель верифицировалась экспериментальными данными. Методика, названная по фамилии автора ‑ Tsoukias (Цукиас), была признана более точной и дающей больше данных по выдыхаемому NO.
В 2004 г. вышла публикация [13], в которой ранее описанная двухкомпартментальная модель верифицировалась клинически на больных с фиброзом, склеродермией, альвеолитом, ХОБЛ и аллергическим ринитом. Данная модель была признана простой, надежной и достоверной для заявленных применений [13].
В 2007 г. научная группа С. Джорджа ооппубликовала модернизированную версию двухкомпартментальной модели [14]. Был введен третий компартмент между альвеолярным отделом легких и воздушной трубой - ‑ имитация мелких бронхов. Также был добавлен обратный выдыхаемому потоку воздуха поток NO - ‑ обратная аксиальная диффузия. Необходимо отметить, что в модели было сделано важное допущение о стабильности скорости выдыхаемого воздуха, что обеспечить на практике довольно сложно [14].
В 2014 году . эта научная группа доработала и верифицировала двухкомпартментальную модель на основе результатов исследований 1507 школьников Южнокалифорнийского центра исследования детского здоровья [15]. В результате были достигнуты хорошие показатели достоверности, которые соответствовали и модельным предположениям, и клиническим данным [15].
Впоследствии двухкомпартментальная модель усложнялась за счет увеличения количества компартментов вплоть до нескольких поколений бронхов. Другая научная группа [16] предложила значительно более детализированную модель оценки концентрации NO в альвеолярном отделе легких по динамике выдыхаемого NO, альтернативную ранее предложенной двухкомпартментальной [16]. Указанная модель описывала все 23 поколения бронхов, причем для поколений бронхов от 0-го до 18-го включалось более детализированное описание латеральной стенки воздухоносных путей: слой слизи, слой эпителиальный, слой мускульный. Это позволило описать диффузию NO из эпителия в просвет дыхательных путей, как функцию нескольких базовых параметров, а именно: объем продуцированного в эпителии NO, скорость воздушного потока, геометрию слоев. При этом в поколениях 19-‑23 стенка дыхательных путей считалась почти полностью состоящей из альвеол и слоистым строением пренебрегли.
Модель позволила адекватно смоделировать бронхоспазм за счет модуляции поперечного сечения дыхательных путей в одном или нескольких поколениях верхней части легких, что важно для многих патологий. При имитации бронхоспазма, модель пересчитывает толщины слоев исходя из сохранения объема тканей, а также позволяет учитывать влияние бронхоспазма на уровень газообмена NO между эпителием и просветом дыхательных путей в этих поколениях бронхов [16].
Актуальность математического моделирования нитрозивного метаболизма и цикла NO.
С момента открытия оксида NO и его метаболитов лавинообразно растет количество информации о новых аспектах их физиологических активностей. Причем, зачастую,о регистрируемые эффекты не просто противоречивы, а диаметрально противоположны. Так, известно, что NO способен вызывать вазодилатацию [17, 18, 19]. Кроме того, в эксперименте на мышах NO предотвращал развитие гипертензии, индуцированной ангиотензином-2 [20]. С другой стороны, Однако зафиксировано усиление вазоконстрикции, вызванной ангиотензином-2 в условиях поведенческого стресса при наличии сахарного диабета. Так, в эксперименте на крысах линии Вистар с сахарным диабетом 1-го типа, индуцированная ангиотензином-2 вазоконстрикция, была выше при более высокой активности NO-синтаз, вызванной стрессом. При этом, в случае ингибирования NO-синтаз, острый поведенческий стресс не вызывал у крыс с диабетом усиления ответа на ангиотензин-2. Поскольку у нормогликемических крыс индуцированная вазоконстрикция не зависела от активности NO-синтазы, авторами был сделан вывод, что подобный эффект у диабетических крыс возникает из-за более высокой концентрации АФК и, как следствие, пероксинитрита при увеличении активности NO-синтазы [21].
Выявлено, что NO проявляет антиатерогенные свойства [22, 23], в том числе усиливает антиатерогенный эффект аторвастатина у мышей [24]. При этом, избыточная генерация NO и активных форм кислорода приводит к образованию пероксинитрита, проявляющего проатерогенные свойства [25, 26].
При рассмотрении влияния NO на перекисное окисление липидов (ПОЛ) в мембранах клеток и липопротеинах сыворотки, тоже обнаруживаются противоположные эффекты. Сам по себе NO ‑ недостаточно сильный оксидант, чтобы самостоятельно запустить цепную реакцию ПОЛ. Но пероксинитрит - ‑ продукт его реакции с супероксидным радикалом, ‑ обычно приводит к инициации прооксидантных процессов, включая окисление полиненасыщенных жирных кислот биомембран и липопротеинов [27]. Однако, NO способен останавливать цепные окислительные реакции, например, перекисное окисление липидов может быть ингибировано избытком NO с последующим образованием нитрозо- и нитро- производных жирных кислот [28]. Также отмечено, что окисление ненасыщенных жирных кислот в биомембранах и липопротеинах инициируется одноэлектронным окислением, приводящим к образованию алкильного радикала, который быстро реагирует с молекулярным кислородом, давая соответствующий липидный пероксильный радикал (LOO•), играющий ключевую роль в цепной реакции перекисного окисления липидов. Кроме того, LOO• легко реагирует с NO, приводя к появлению промежуточных продуктов окисленных и нитрозированных жирных кислот, которые, в свою очередь, могут превращаться в нитрированные жирные кислоты, в частности, нитроалкены, вызывающие широкий спектр физиологических реакций [28]. Известно, что базовая продукция пероксинитрита происходит даже в нормальных физиологических условиях. А, в случае устойчивой гиперактивации конститутивных NOS (eNOS или nNOS) или индукции iNOS, концентрации NO будут приближаться к микромолярным уровням или превышать их. Как следствие, NO будет более эффективно конкурировать с супероксиддисмутазой (SOD) за связывание АФК, что приведет к еще более значимому образованию пероксинитрита [28].
К настоящему моменту накопленао большое количество данных, подтверждающих, что NO способен индуцировать процессы апоптоза. Например, у самок крыс после овариэктомии из-за дефицита эстрогенов развивался апоптоз передней доли гипофиза, механизм которого был достоверно связан с генерацией NO. Так, уровень NO и экспрессия гуанилилциклазы (sGC) в клетках передней доли гипофиза одновременно повышались до апоптоза, а ингибирование активности NO-синтазы (NOS) и sGC предотвращало снижение жизнеспособности клеток. Таким образом, авторы пришли к заключению, что повышенные уровни NO и sGC, наблюдаемые после овариэктомии, играют ключевую роль в индукции апоптоза. [29].
Показано, что экспрессия индуцируемой NO-синтазы (iNOS) в клетках меланомы человека A375-S2 приводила к генерации NO, что способствовало индукции процессов апоптоза [30].
Изучение молекулярных механизмов NO-индуцированного цитотоксического эффекта в клетках фибробластов десны человека (HGF) показало, что NO инициировал апоптоз через опосредованный митохондриями путь ‑ за счет регулирования активности Bax/Bcl-2 и c-Jun N-terminal kinase [31].
Было показано, что новый донор NO - ‑ NG (1- (N-гидроксиэтилметиламино) диазен-1-ил-1,2-диолат), ‑ ингибирует рост клеток и индуцирует апоптоз в клетках HepG2. Былои обнаруженоы выделение цитохрома С из митохондрий и активация каспазы-9/3, что указывает на то, что NG может индуцировать апоптоз через митохондриально-опосредованный путь [31].
Наряду с вышесказанным, получены данные, что NO способен влиять на процессы апоптоза, индуцированного другими агентами. Так, обнаружено, что NO, продуцируемый в панкреатических β-клетках в ответ на провоспалительные цитокины, играет двойную роль в регуляции судьбы этих клеток. Хотя NO индуцирует клеточное повреждение и нарушает функцию β-клеток, он также способствует выживанию β-клеток путем предотвращения их апоптоза за счет ослабления ответа на повреждение ДНК [32, 33].
Известно, что эстрогены способствуют увеличению выживаемости остеоцитов. В работе [34], исследующей механизмы антиапоптотического действия 17β-эстрадиола на остеоциты, показано, что защитные эффекты 17β-эстрадиола реализуются через активацию каскада NO / cGMP / PKG.
Такое разнообразие эффектов NO означает, что результирующее действие будет зависеть от баланса конкурирующих факторов: уровней концентраций NO и его метаболитов, их пространственного распределения, наличия и концентрации ловушек и т.п.
Для того, чтобы связать имеющуюся противоречивую экспериментальную информацию в единую систему, необходимо формирование цельной модели цикла NO.
Попытки моделирования цикла оксида азота (NO).
Для имитационного математического моделирования необходима концептуальная модель (схема) изучаемой системы. Принципиальные представления о путях синтеза и метаболизма NO у разных авторов очень близки. Одной из распространенных на сегодняшний день является схема, предложенная А.А. Недоспасовым А.А. и Н.В. Беда Н.В (рис. 2).
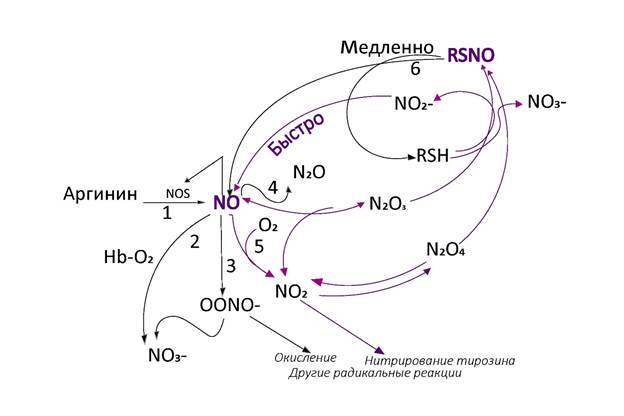
Рис. 2. Схема биосинтеза NO и основных метаболических путей оксидов азота.
NO, первоначально образующийся из аргинина под действием NOS (путь 1), вступает во множество конкурирующих реакций [35]:
- комплекс кислорода с гемоглобином (HbEO2) и другими гем-содержащими белками окисляет его в нитрат NO3- (путь 2);
‑ при взаимодействии с супероксид-радикалом он образует пероксинитрит (OONO-) (путь 3);
‑ небольшие количества NO восстанавливаются до N2O (путь 4) и даже до аммония;
‑ NO окисляется до диоксида NO2 (путь 5), дающего смесь других оксидов азота (изомеры N2O3 и N2O4);
‑ поскольку все высшие оксиды реакционноспособны, показано нитрозирование тиолов (RSH) с образованием тионитритов (RSNO) и ионов нитрата (NO3-) или нитрита (NO2-);
‑ NO2- и RSNO могут снова превращаться в NO;
‑ избыток NO ингибирует NOS.
На схеме, представленной в работе [36], рассматривается индуцирующее действие NO на апоптоз при ишемии-реперфузии, нейродегенеративных и воспалительных патологиях. Показано, что повреждающее действие NO опосредуется через образование пероксинитрита (ONOO-), в качестве основных метаболитов цикла выделяются NO2-, NO3-, RSNO, ONOO-, cGMP (рис. 3).
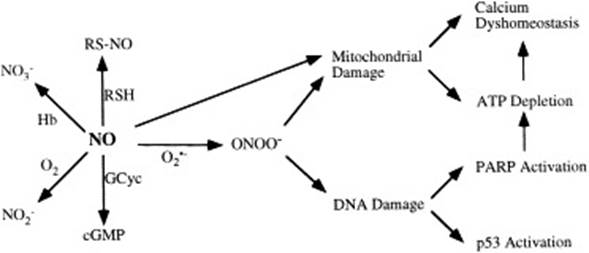
Рис. 3. Реакции, опосредующие повреждающее действие NO.
В работе [37] рассматриваются основные пути окисления, нитрозирования и нитрования и делаются предположения об интермедиатах этих реакций (рис. 4).
В результате быстрой реакции NO и O2- образуется пероксинитрит (ONOOH), который приводит к окислению, нитрозированию (добавление NO) или нитрованию (добавление NO2). Оксид азота образуется в результате ферментативного действия NOS, которые при некоторых обстоятельствах могут также продуцировать O2-. Существуют и другие потенциальные источники O2- в клетке, включая ксантиноксидазу (XOD) и NAD(P)H оксидазы [37].
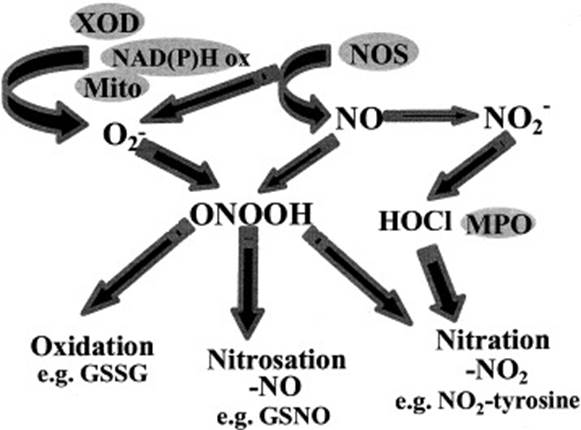
Рис. 4. Зависящие от NO реакции, приводящие к образованию RNS.
Попыток математического моделирования цикла NO в целом пока обнаружить не удалось. В силу большей практической применимости, усилия сфокусированы на построении моделей отдельных процессов, которые делают измеряемые параметры цикла оксида азота диагностически значимыми. Пример такой модели зависимости выдыхаемого NO от концентрации NO в легких и скорости выдоха рассмотрен выше [11, 12, -13].
По направлению динамического математического моделирования NO-синтаз существует исследование по моделированию кинетики работы нейрональной NO-синтазы (nNOS) [38]. Авторы разработали 10-ступенчатую кинетическую модель (рис. 5), в которой комплекс «трехвалентное гемовое железо- ‑ NO NO» формируется, как непосредственный продукт катализа, а затем часть его диссоциирует, а часть восстанавливается до комплекса двухвалентного гемового железа ‑ NO. Константы модели оценивались по литературным данным.
Рис. 5 Кинетическая модель катализа nNOS.
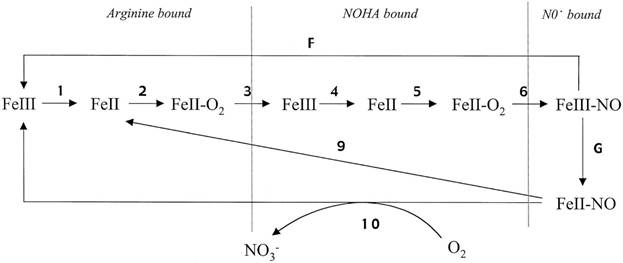
Рис. 5. Кинетическая модель катализа nNOS
Компьютерный расчет модели точно описал особенности переходного и установившегося катализа nNOS, включая потребление NADPH и производство NO, накопление комплекса «гем- ‑ NO». Модель также адекватно моделирует каталитические особенности мутантных nNOS: W409F и W409Y, которые являются гиперактивными и вызывают меньшее образование комплекса гем-NO в устойчивом режиме [38]. Указанная модель аккумулирует актуальные литературные данные, особенно концепцию быстрой рекомбинации между гемовым железом и NO, сформированноым в активном центре. Авторы утверждают, что предложенная кинетическая модель является достаточно точным инструментом для изучения каталитического поведения nNOS и дает новые перспективы в регуляции ее активности. Кроме того, разработанная кинетическая модель описывает кажущиеся парадоксальными особенности регулирования eNOS и iNOS, приведенные в работе [38]. Других динамических математических моделей по каким-либо типам NO-синтаз обнаружить не удалось.
Заключение.
Таким образом, на сегодняшний день существует очень ограниченное число динамических моделей отдельных составляющих цикла NO. Соответственно, очевидна необходимость формирования математической модели цикла NO в целом, что, при успешной верификации, сделает возможным проведение модельных экспериментов. Благодаря этому можно будет численно прогнозировать изменение параметров цикла NO в зависимости от большого количества внешних по отношению к системе, эндогенных и экзогенных факторов. Это особенно ценно при прогнозе поведения системы при пограничных физиологических условиях (экстремальных состояниях), а также, для определения чувствительных точек системы,, при таргетных воздействиях на которые можно добиваться значимых физиологических изменений.
Библиографическая ссылка
Попова Н.А., Климанов И.А., Соодаева С.К. ИССЛЕДОВАНИЕ ВОЗМОЖНОСТИ МАТЕМАТИЧЕСКОГО МОДЕЛИРОВАНИЯ ЦИКЛА ОКСИДА АЗОТА В РЕСПИРАТОРНОМ ТРАКТЕ // Современные проблемы науки и образования. 2021. № 6. ;URL: https://science-education.ru/ru/article/view?id=31234 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/spno.31234



