Одной из актуальных проблемой общественного здравоохранения является хроническая болезнь почек (ХБП), от которой страдают более 850 миллионов как пожилых, так и молодых людей во всем мире [1; 2]. Среди них терминальную почечную недостаточность (ТПН) имеют 3,36 млн человек, из которых 2,99 млн получают лечение программным гемодиализом (ГД), а 0,37 млн пациентов – перитонеальным диализом (ПД) [3; 4]. Основными последствиями ХБП являются прогрессирующая потеря функции почек, ведущая к развитию терминальной почечной недостаточности, рост сердечно-сосудистой заболеваемости и повышение риска смерти от болезней системы кровообращения, а также саркопения [5].
Уменьшение фильтрационной способности почек вызывает ряд изменений в гомеостазе, таких как оксидативный стресс, системное воспаление, уремическая интоксикация, дизэлектролитемии, метаболический ацидоз и др. [6-8]. Вместе с тем эти нарушения сами по себе индуцируют повреждение почек и способны вызывать ускорение темпов потери их функции [9; 10].
Оксидативный стресс представляет собой дисбаланс про- и антиоксидантной систем. Его развитие считается одним из ключевых компонентов патогенеза и прогрессирования ХБП. Ввиду высокого темпа метаболизма почки в значительной степени чувствительны к оксидативному повреждению, в связи с чем оксидативный стресс может как ускорить прогрессирование заболевания, так и потенцировать осложнения [11].
Несмотря на достигнутые успехи в понимании механизмов развития и прогрессирования ХБП, а также особенностей кардиоренальных взаимоотношений, научная дискуссия в отношении молекулярных основ патогенеза оксидативного стресса и оценки его роли в развитии и прогрессировании, в том числе эндотелиальной дисфункции, как основного предиктора сердечно-сосудистых событий, сохраняется [12; 13]. Это связано, прежде всего, с тем, что оксидативный стресс является одним из основных ответов организма на адаптацию в условиях нарушенной функции почек, а его активность коррелирует не только с выраженностью клинических проявлений, но и с прогнозом заболевания [14].
В связи с этим поиск перспективных молекулярных маркеров для оценки выраженности оксидативного стресса позволит оптимизировать диагностику этого клинического состояния у пациентов с ХБП и выделить потенциальные цели для терапевтического вмешательства. К представителям этой группы биомаркеров можно отнести малоновый диальдегид (МДА), который является одним из продуктов свободнорадикального окисления липидов [15].
Цель настоящего исследования состояла в оценке особенностей оксидативного стресса у пациентов с ХБП на разных стадиях болезни и его ассоциации с клинико-лабораторными параметрами, а также вклада МДА, АДМА и СОД в развитие этого клинического состояния.
Материалы и методы исследования
В исследование были включены 80 пациентов с ХБП С3А-5Д стадии, из них 40 больных получали заместительную почечную терапию (ЗПТ) в отделении гемодиализа клинической больницы № 1 ЮОМЦ г. Ростова-на-Дону на протяжении 53,6±47,4 месяца, 40 пациентов были с ХБП С3А-5, сопоставимых по полу и возрасту, наблюдались в отделении нефрологии ФГБОУ ВО «РостГМУ» Минздрава России. Основными причинами ХБП были гипертоническая нефропатия (n=27), хронический тубулоинтерстициальный нефрит (n=24) и хронический гломерулонефрит (n=21), реже – диабетическая нефропатия (n=15), мочекаменная болезнь (n=15) и аутосомно-доминантная поликистозная болезнь почек (n=8). Средний возраст больных составил 58,8±13,2 года, из них лиц мужского пола - 34, женского - 46. Средняя продолжительность анамнеза ХБП составила 9,3±8,68 года.
Всем пациентам проводилось общеклиническое обследование, лабораторные анализы (общий анализ крови, биохимический анализ крови, показатели кислотно-щелочного состояния крови). Также определялся уровень МДА. Всем пациентам проводили оценку антропометрических параметров, кистевую динамометрию (КДМ) и биоимпедансометрию. Дополнительно определялась стадия белково-энергетической недостаточности (БЭН) с помощью комплексной методики в модификации Bilbrey G.I. и Cohen T.L. (1989), вероятность формирования саркопении с помощью опросника SARC-F, а также проводился тест 6-минутной ходьбы (Т6МХ).
Статистический анализ проводился с использованием программ Microsoft и Statistica. Распределение признаков анализировалось с применением анализа Колмогорова-Соколова, при р<0,05 распределение считалось отличным от нормального. Средние значения признака с нормальным распределением определялись с помощью средней арифметической с учетом стандартного отклонения, признака с распределением, отличающимся от нормального – медиана и интерквартильный размах. Для сравнения двух групп применяли критерий Стьюдента (при нормальном распределении), при распределении, отличном от нормального – критерий Манна-Уитни, критерий Вилкоксона (при связанных группах) и критерий Фридмана (при более двух групп). Статистически значимыми считались различия при р<0,05. При нормальном распределении признаков оценивали корреляционную связь Пирсона, при ненормальном распределении – ранговые корреляции Спирмена. Использовались методы линейного множественного регрессионного анализа в отношении количественных признаков и логит-регрессионного анализа в отношении количественных и качественных признаков. Применяли ROC-анализ (Receiver Operating Characteristic curve) с формированием операционных характеристических кривых и определением коэффициента площади под кривой в отношении диагностической значимости параметров оксидативного стресса и антиоксидантной защиты, оцениваемой как отличная при значениях Area 0,9-1,0, как очень хорошая – при 0,8-0,9, как хорошая – при 0,7-0,8, средняя – при 0,6-0,7, неудовлетворительная – при 0,5-0,6.
Результаты исследования и их обсуждение
Встречаемость БЭН в группе пациентов с ХБП3А-5Д составила 82,5%. Стоит отметить, что у мужчин ее распространенность была реже (80,9% случаев): 1-я стадия – 50%, 2-я стадия – 27,3%, 3-я стадия – 13,6%. В когорте женщин этот показатель был 84,4%: 1-я стадия – 44,4%, 2-я стадия –38,9%, 3-я стадия – 11,1%.
Риск наличия саркопении в группе пациентов, оцениваемый по опроснику SARC-F, составил в среднем 2,9±0,4 балла (у мужчин - 3±0,6, у женщины - 2,6±0,4), при этом 4 и более баллов, которые являются показателем высокой вероятности саркопении, набрали 36,4% мужчин и 33,4% женщин. Определение мышечной силы на правой и левой руках с помощью КДМ продемонстрировало статистически достоверную разницу между пациентами 3А-5 стадий и 5Д стадии (29,7±11; 26,4±12,1, p<0,05 и 27,7±10,2; 24,9±11,4 соответственно, p<0,05). Расстояние, пройденное респондентами в рамках Т6МХ, было значимо больше в группе пациентов на додиализных стадиях ХБП по сравнению с пациентами, получающими лечение ГД (360,2±75,6 и 224±102,7 соответственно, p<0,05). Было установлено, что распространенность саркопении на додиализных стадиях ХБП значительно меньше (12,5%) по сравнению с пациентами на ГД (42,5%).
Исходные клинические характеристики и лабораторные данные пациентов исследуемой группы представлены в таблице 1.
Таблица 1
Показатели общего и биохимического анализа крови
|
Наименование показателя |
Среднее значение (М±σ или Ме[Q1;Q3]) |
|
Возраст, лет |
58,9±13,1 |
|
Длительность ХБП, лет |
9,33±8,69 |
|
ОХС, ммоль/л |
4,95±1,37 |
|
ХС-ЛПНП, ммоль/л |
2,96±1,21 |
|
Креатинин, мкмоль/л |
405,15 [148,5;810,4] |
|
СКФ, мл/мин/1,73м2 |
10,5 [5,0;34,5] |
|
Мочевина, ммоль/л |
15,41±6,88 |
|
Мочевая кислота, мкмоль/л |
394,92±91,8 |
|
Эритроциты, *1012/л |
3,93±0,58 |
|
Железо крови, мкмоль/л |
12,53±9,09 |
|
СРБ, мг/л |
2,34 [1,34;5,05] |
|
Общий белок, г/л |
68,39±6,83 |
|
Альбумин крови, г/л |
39,06±3,89 |
|
Натрий крови, ммоль/л |
138,6 [136,9;140,6] |
|
Калий крови, ммоль/л |
4,95 [4,56;5,77] |
|
Кальций крови, ммоль/л |
1,11 [1,04;1,17] |
|
Хлор крови, ммоль/л |
103,0 [101;105] |
|
Глюкоза крови, ммоль/л |
5,50 [4,9;6,15] |
|
Фосфат крови, ммоль/л |
1,39 [1,09;2,11] |
Для оценки влияния МДА на развитие саркопении и белково-энергетической недостаточности (БЭН) были применены несколько статистических методов. Был проведен корреляционный анализ критериев БЭН и параметров оксидативного стресса. Медиана распределения МДА в группе составила 6,1 нмоль/л. Было показано, что по мере уменьшения индекса массы тела (ИМТ), окружности плеча (ОП) и уровня лимфоцитов происходит повышение уровня МДА (табл. 2).
Таблица 2
Корреляционные связи МДА и критериев БЭН в модификации Bilbrey G.I. и Cohen T.L.
|
|
МДА, нмоль/мл |
|
|
|
r |
p |
|
ИМТ, кг/м2 |
-0,25 |
0,028 |
|
ОП, см |
-0,37 |
0,001 |
|
Лимфоциты, *109/л |
-0,30 |
0,008 |
|
Альбумин, г/л |
-0,14 |
0,43 |
При этом у лиц с ХБП сывороточные уровни МДА коррелировали практически со всеми параметрами БЭН за исключением уровня альбумина.
Однако при исследовании взаимосвязи активности оксидативного стресса и выраженности БЭН (в баллах) было установлено, что повышение уровня МДА в сыворотке крови сопровождалось прогрессированием БЭН (r=0,59, p=0,0001) (рис. 1).
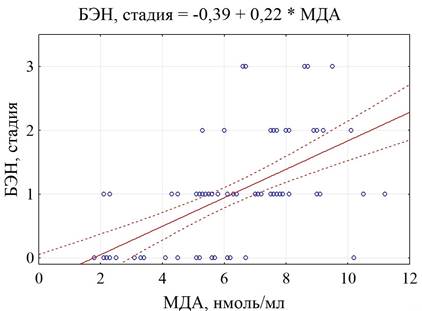
Рис. 1. График корреляционной связи МДА с БЭН
Примечательно, что по мере усугубления почечной дисфункции (снижение СКФ (r=-0,33, p=0,035), увеличения уровня мочевины (r=0,34, p=0,04)), нарастания фосфатемии (r=0,38, p=0,022), уменьшения гемоглобина (r=0,59, p=0,0001) и усиления дефицита железа (r=-0,44, p=0,007) отмечалось увеличение значения МДА.
По результатам ROC-анализа было установлено, что использование МДА обладало большей диагностической значимостью не только в отношении прогнозирования БЭН (чувствительность – 86%, специфичность – 75%), но и саркопении (чувствительность – 78%, специфичность – 65%).
Характеризуя функциональное состояние мышц нижних конечностей, установили, что дистанция, пройденная пациентом при выполнении 6-минутной пробы (r=-0,65, p=0,0001), и скорость преодоления (r=-0,65, p=0,0001) этого расстояния снижались при повышении уровня МДА в сыворотке крови.
С помощью логит-регрессионного анализа были определены риски развития саркопении (χ2=10,7, р=0,001) и БЭН (χ2=16,4, р<0,0001) в зависимости от уровня МДА, а затем риск повышения уровня МДА в крови (т.е. развития оксидативного стресса) в зависимости от количества баллов SARC-F (χ2=5,73, р=0,017) и БЭН (χ2=26,5, р<0,0001).
Кроме того, обнаружено, что нарастание уровня МДА в крови больных повышалось соответственно выраженности саркопении (в баллах) согласно результатам опросника SARC-F (r=0,59, p=0,0001) (рис. 2).
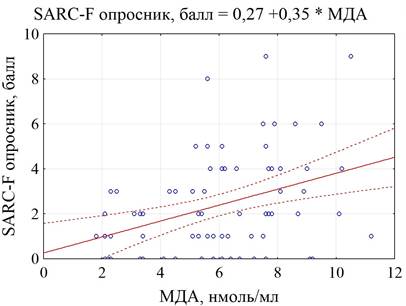
Рис. 2. График корреляционной связи МДА и саркопении
Следующим шагом явилось изучение влияния большинства клинических параметров на повышение МДА. По медиане МДА данный параметр был определен, как высокий (≥6,1 нмоль/мл) и низкий (<6,1).
В процессе исследования было установлено, что по мере проявлений саркопении и БЭН, уменьшения жировых запасов организма происходило развитие оксидативного стресса (повышение МДА). Внеклеточная гипергидратация при метаболическом ацидозе, гипоксии и гиперкапнии также способствовали формированию оксидативного стресса. Кроме того, выявлена зависимость минерально-костного метаболизма, обмена железа и развития оксидативного стресса по мере прогрессирования ХБП.
Окислительный стресс представляет собой тонкий дисбаланс между накоплением активных форм кислорода и способностью антиоксидантной системы к их детоксикации. Накопление активных форм кислорода в условиях окислительного стресса потенцирует реакции перекисного окисления липидов, что приводит к продукции альдегидов и их производных, в том числе и МДА.
При оценке функционального состояния мышц выявлена взаимосвязь снижения качества выполнения теста 6-минутной ходьбы и повышения уровня МДА в сыворотке крови, тогда как другие тесты не продемонстрировали ассоциации с оксидативным стрессом. Таким образом, увеличение МДА является одним из дополнительных причин снижения выносливости у пациентов с ХБП.
Несмотря на то что альбумин остается общепринятым показателем хронического воспаления у пациентов на диализе, и, по данным DOPPS (Dialysis Outcomes and Practise Patterns Study), концентрация альбумина менее 35 г/л увеличивает летальность пациентов на ГД на 1,38%, в исследовании не удалось установить корреляционную связь альбумина и МДА. Возможно, отсутствие корреляции обусловлено тем, что концентрация альбумина у пациентов была выше 35 г/л (39,1±3,9 г/л). Кроме того, по результатам логит-регрессионного анализа, в рамках которого исследовалось влияние медикаментозной терапии на вероятность повышения уровня МДА в крови, применение кетоаминокислот не влияло на увеличение МДА.
Заключение
Таким образом, нами обнаружены клинико-лабораторные особенности развития оксидативного стресса у пациентов с ХБП 3А-5Д стадий. Выявлена высокая распространенность саркопении в обсуждаемой группе больных, как одного из осложнений ХБП, индуцируемого в том числе свободнорадикальным окислением. МДА является одним из ключевых компонентов оценки активности оксидативного стресса при ХБП, коррелируя с выраженностью БЭН, саркопении, анемии и др. клиническими компонентами. МДА может быть рассмотрен в качестве доступного молекулярного маркера, определение которого позволит оценить выраженность оксидативного стресса и оптимизировать терапевтическую тактику у пациентов с ХБП.
Библиографическая ссылка
Негода В.М., Гасанов М.З., Батюшин М.М., Гергия С.Р., Руденко Л.И. ОСОБЕННОСТИ РАЗВИТИЯ ОКСИДАТИВНОГО СТРЕССА У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ БОЛЕЗНЬЮ ПОЧЕК 3А-5Д СТАДИЙ // Современные проблемы науки и образования. 2021. № 3. ;URL: https://science-education.ru/ru/article/view?id=30836 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/spno.30836



