Среди онкологических заболеваний по числу летальных исходов 4-е место занимают злокачественные новообразования кишечника. В данной группе наибольший процент составляют опухоли прямой кишки [1; 2]. В настоящее время для лечения рака прямой кишки применяют комбинированные протоколы, отличающиеся от протоколов для других отделов кишечника, так как сочетают предоперационную лучевую терапию (в стандартном варианте - разовая очаговая доза (РОД) 2,4 Гр до суммарной очаговой дозы (СОД) 54 Гр) и последующее хирургическое вмешательство [3; 4]. Анализ результатов отечественной и мировой радиотерапевтической практики показывает наличие большого числа (до 30-40%) случаев с радиорезистентностью опухолей, обусловленной молекулярными (генетическими/эпигенетическими) аномалиями в опухолевых клетках, в частности аберрантной экспрессией определенных групп генов. Ранее нами было показано, что транскрипционная активность генетических локусов, регулирующих системы репарации (RBBP8, H2AX, BRCA2), пролиферации и апоптоза (CASP9, BCL2), связана с эффективностью проводимой лучевой терапии у больных раком прямой кишки [1]. Как известно, важнейшими регуляторами транскрипционной активности генов являются микроРНК, представляющие собой некодирующие одноцепочечные РНК, содержащие приблизительно два десятка нуклеотидов, осуществляющие регуляцию трансляции и деградации матричной РНК посредством связывания с комплементарными сайтами в нетранслируемых участках молекул последних, служащих их мишенями [5].
Поэтому целью исследования стало выявление с помощью биоинформационного анализа микроРНК, таргетирующих гены RBBP8, H2AX, BRCA2, CASP9 и BCL2, и изучение влияния изменения экспрессии этих микроРНК на эффективность лучевой терапии опухолей прямой кишки.
Материалы и методы исследования
Биоинформационный поиск микроРНК, таргетирующих гены RBBP8, H2AX, BRCA2, CASP9 и BCL2, осуществляли с использованием модифицированного алгоритма TarPmiR и базы данных mirDB. TarPmiR для прогнозирования сайта связывания мРНК и микроРНК использует алгоритм машинного обучения random forest («случайный лес»), сочетающий в себе метод случайных подпространств и метод бэггинга Бреймана. Результатом работы алгоритма является значение вероятности того, что обнаруженный сайт-мишень кандидат и есть истинный сайт-мишень [6; 7].
В исследовании участвовали 32 пациента (возраст от 45 до 65 лет), госпитализированных в ФГБУ «НМИЦ онкологии» с диагнозом аденокарцинома прямой кишки (G1-2). До лучевой терапии (ЛТ) от этих пациентов при проведении видеоколоноскопии (ВКС) получали препараты биопсии - фрагменты немалигнизированных (нормальных) и опухолевых тканей прямой кишки. Фрагменты ткани, извлеченные во время биопсии, мгновенно замораживали при минус 195 °C и в последующем использовали для выделения суммарной РНК. ЛТ проводили по стандартной схеме - РОД 2,4 Гр, СОД 54,0 Гр - на линейном ускорителе частиц Novalis TX.
Препараты суммарной РНК выделяли методом фенол-хлороформной экстракции в модификации [7]. Для выявления микроРНК и малой РНК U6 препараты суммарной РНК подвергали реакции обратной транскрипции (ОТ), которая проводилась одновременно с полиаденилированием РНК, с использованием специфичных RT-праймеров. Олигонуклеотидные праймеры были разработаны нами с использованием алгоритма предложенного Balcells I. [8]. Реакцию ОТ проводили в одном повторе, отдельно для каждой микроРНК, для этого использовали лиофилизированную смесь «Мастер-микс ОТ» («Вектор-Бест», Россия). ОТ проводили при 16 °С (15 минут), далее при 42 °С (15 минут), обратную транскриптазу инактивировали инкубацией при 95 °С в течение 2 минут [7].
Относительную экспрессию микроРНК оценивали методом RT-qPCR. Постановку RT-qPCR каждого образца проводили в 3 повторах. Для подбора референсных локусов оценивали стабильность экспрессии микроРНК по алгоритму geNorm [9]. Первоначальный список предполагаемых референсных локусов для микро-РНК включал: miR-191; miR-23a и U6. С помощью geNorm для нормализации данных по экспрессии микроРНК был выбран U6. Нормализацию проводили по референсному локусу и уровню экспрессии соответствующих микроРНК в образцах нормальной ткани. Относительную экспрессию микроРНК (RЕmir) определяли по формуле RЕmir=Е-ΔΔCt, где Е - вычисленная эффективность реакции амплификации [5].
Статистический анализ данных проводили с использованием языка программирования Python (библиотека SciPy). Различия между группами оценивались с использованием U-критерия Манна-Уитни, для корректировки множественного сравнения была применена поправка Бонферрони [7]. Также проводили анализ избыточной представленности микроРНК в сигнальных путях (ORA, Over-Representation Analysis). Этот метод определяет долю участия дифференциально экспрессирующихся микроРНК в определенных сигнальных путях, его результатом является получение списка наиболее значимых сигнальных путей. Статистическая значимость в ORA рассчитывалась с применением точного критерия Фишера [10].
Результаты исследования и их обсуждение
Биоинформационный поиск микроРНК, таргетирующих гены RBBP8, H2AX, BRCA2, CASP9 и BCL2, с использованием модифицированного алгоритма TarPmiR, выявил 1338 микроРНК (рис. 1А), из которых валидированы в базе данных miRDB 86 микроРНК (рис. 1Б), в том числе 26 с минимальным значением термодинамического потенциала (свободной энергии) взаимодействия микроРНК и матричной РНК (табл. 1): 9 микроРНК, взаимодействующих с BCL2, 2 микроРНК, взаимодействующие с BRCA2, 12 микроРНК, взаимодействующих с CASP9, 2 микроРНК, взаимодействующие с H2AX, и 1 микроРНК, взаимодействующая с RBBP8.
Таблица 1
МикроРНК, таргетирующие гены RBBP8, H2AX, BRCA2, CASP9 и BCL2, выявленные с использованием алгоритма TarPmiR*
|
МикроРНК |
RefSeq id |
Ген |
Координаты в геноме |
Энергия |
AU |
Длина участка связывания, п.н. |
Участок связывания |
Валидировано в miRDB |
|
|
start |
end |
||||||||
|
hsa-miR-1249-5p |
NM_000633 |
BCL2 |
3468 |
3517 |
-30.1 |
0.382 |
49 |
3UTR |
да |
|
hsa-miR-6861-5p |
NM_000633 |
BCL2 |
3474 |
3513 |
-29.6 |
0.368 |
20 |
3UTR |
да |
|
hsa-miR-8052 |
NM_000633 |
BCL2 |
4393 |
4412 |
-29.3 |
0.412 |
19 |
3UTR |
да |
|
hsa-miR-324-3p |
NM_000633 |
BCL2 |
4680 |
4700 |
-28.6 |
0.618 |
20 |
3UTR |
да |
|
hsa-miR-6820-3p |
NM_000633 |
BCL2 |
1670 |
1701 |
-28.1 |
0.456 |
31 |
3UTR |
да |
|
hsa-miR-4717-5p |
NM_000633 |
BCL2 |
2322 |
2364 |
-28.0 |
0.368 |
18 |
3UTR |
да |
|
hsa-miR-3943 |
NM_000633 |
BCL2 |
2750 |
2774 |
-27.8 |
0.632 |
24 |
3UTR |
да |
|
hsa-miR-557 |
NM_000633 |
BCL2 |
2549 |
2584 |
-27.6 |
0.5 |
20 |
3UTR |
да |
|
hsa-miR-4690-5p |
NM_000633 |
BCL2 |
2147 |
2172 |
-27.3 |
0.426 |
25 |
3UTR |
да |
|
hsa-miR-6757-3p |
NM_000059 |
BRCA2 |
10786 |
10812 |
-25.7 |
0.412 |
26 |
3UTR |
да |
|
hsa-miR-7151-3p |
NM_000059 |
BRCA2 |
10797 |
10825 |
-25.1 |
0.441 |
20 |
3UTR |
да |
|
hsa-miR-6779-5p |
XM_011542273 |
CASP9 |
1482 |
1537 |
-34.3 |
0.441 |
35 |
3UTR |
да |
|
hsa-miR-1273h-5p |
NM_032996 |
CASP9 |
2555 |
2590 |
-33.1 |
0.456 |
23 |
3UTR |
да |
|
hsa-miR-6812-5p |
NM_001229 |
CASP9 |
2593 |
2622 |
-30.6 |
0.441 |
29 |
3UTR |
да |
|
hsa-miR-6737-5p |
NM_032996 |
CASP9 |
1329 |
1347 |
-30.1 |
0.5 |
18 |
3UTR |
да |
|
hsa-miR-661 |
XM_011542273 |
CASP9 |
1516 |
1552 |
-29.8 |
0.456 |
36 |
3UTR |
да |
|
hsa-miR-6799-5p |
NM_032996 |
CASP9 |
2609 |
2656 |
-29.7 |
0.574 |
23 |
3UTR |
да |
|
hsa-miR-6893-5p |
NM_032996 |
CASP9 |
2442 |
2484 |
-28.5 |
0.574 |
42 |
3UTR |
да |
|
hsa-miR-6819-5p |
NM_032996 |
CASP9 |
1329 |
1347 |
-27.0 |
0.5 |
18 |
3UTR |
да |
|
hsa-miR-6874-5p |
NM_001278054 |
CASP9 |
2505 |
2535 |
-26.6 |
0.559 |
30 |
3UTR |
да |
|
hsa-miR-4728-5p |
NM_001229 |
CASP9 |
2906 |
2925 |
-26.3 |
0.426 |
19 |
3UTR |
да |
|
hsa-miR-6808-5p |
NM_032996 |
CASP9 |
1588 |
1610 |
-26.2 |
0.471 |
22 |
3UTR |
да |
|
hsa-miR-30b-3p |
XM_011542273 |
CASP9 |
1967 |
1987 |
-25.6 |
0.485 |
20 |
3UTR |
да |
|
hsa-miR-3202 |
NM_002105 |
H2AFX |
620 |
639 |
-20.3 |
0.221 |
19 |
3UTR |
да |
|
hsa-miR-5195-3p |
NM_002105 |
H2AFX |
1478 |
1504 |
-23.8 |
0.471 |
26 |
3UTR |
да |
|
hsa-miR-130b-3p |
NM_002894 |
RBBP8 |
3196 |
3215 |
-23.7 |
0.676 |
19 |
3UTR |
да |
* - представлены только микроРНК, валидированные в базе данных miRDB и с минимальной свободной энергией взаимодействия микроРНК и матричной РНК.
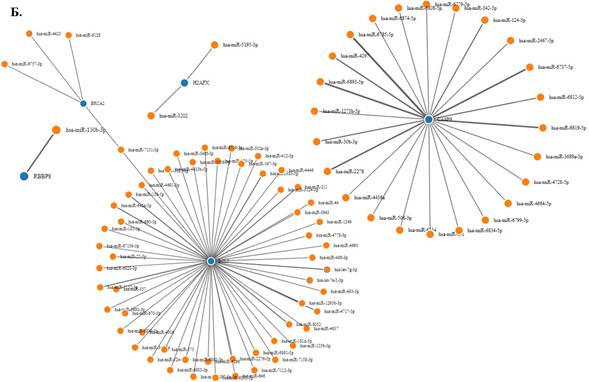
Рис. 1. А - все микроРНК, таргетирующие гены RBBP8, H2AX, BRCA2, CASP9 и BCL2, выявленные с использованием алгоритма TarPmiR. Б - микроРНК, выявленные с использованием алгоритма TarPmiR и валидированные в базе данных miRDB
Для 26 микроРНК, выявленных с использованием биоинформационных подходов, проведено профилирование экспрессии в нормальных и опухолевых тканях у больных раком прямой кишки.
Анализ результатов ЛТ опухолей прямой кишки у 32 больных позволил разделить их на 2 группы. У 17 больных после ЛТ был зафиксирован полный регресс опухоли (группа 1), у 8 больных был зафиксирован незначительный регресс опухоли, и у 7 больных отсутствовала динамика изменения размера опухоли (группа 2). В этих двух группах пациентов наблюдалась дифференциальная экспрессия ряда микроРНК (как относительно нормальной ткани, так и относительно каждой из групп). Так, у больных с незначительным регрессом опухоли или отсутствием динамики после лучевой терапии (n=15) выявлено статистически значимое (p<0,05) снижение экспрессии miR-1249 в 2,5 раза относительно экспрессии в нормальной ткани и в 2,3 раза относительно экспрессии в опухолевой ткани больных с полным регрессом опухоли, снижение экспрессии miR-6820 в 1,7 раза относительно экспрессии в нормальной ткани и в 1,6 раза относительно экспрессии в опухолевой ткани у больных с полным регрессом опухоли, снижение miR-4717 в 2,5 раза относительно нормальной ткани, снижение hsa-miR-3943 в 3,3 раза по сравнению с уровнем экспрессии в нормальной ткани, снижение miR-557 в 2,5 раза относительно нормальной ткани и в 2,3 раза относительно пациентов с полным регрессом опухоли, при этом наблюдается увеличение экспрессии hsa-miR-4690-5p в 2,1 раза относительно нормальной ткани (рис. 2).
Также у больных с полным регрессом опухоли была снижена экспрессия miR-4717 в 1,8 раза (р<0,05) относительно уровня экспрессии в нормальной ткани прямой кишки. Данные микроРНК (miR-557, miR-1249, miR-6820, miR-4717, miR-3943), за исключением miR-4717, в опухолевой ткани у больных с незначительным регрессом опухоли или отсутствием динамики обладают преимущественно сниженной экспрессией как относительно нормальной ткани, так и относительно опухолевой ткани пациентов с полным регрессом опухоли после лучевой терапии. Эти микроРНК таргетируют антиапоптозный ген BCL2, и их сниженная активность может способствовать сохранению на повышенном уровне транскрипционной активности этого гена-мишени. BCL2 кодирует белок, участвующий в подавлении апоптоза двумя путями: во-первых, этот белок изменяет проницаемость мембран митохондрий и предотвращает выход из них цитохрома C, тем самым останавливая активацию каспазного каскада; во-вторых, он инактивирует белок CED4 (фактор активации апоптоза) [11]. Соответствующий эффект увеличения экспрессии гена BCL2 у пациентов с незначительным регрессом опухоли или отсутствием динамики после лучевой терапии мы и обнаружили в предыдущем исследовании [1].
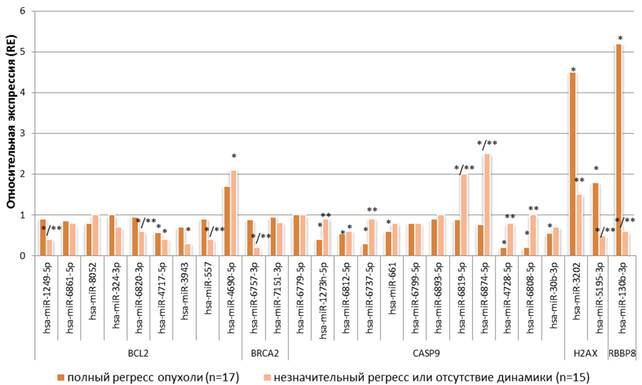
Рис. 2. Уровень экспрессия микроРНК в ткани опухоли прямой кишки больных с полным регрессом (группа 1) или его отсутствием (группа 2). * – статистически значимые отличия (р<0,05) относительно уровня экспрессии в нормальной ткани, ** – статистически значимые отличия (р<0,005) экспрессии микроРНК в опухолевой ткани пациентов
группы 2 от группы 1
Также в опухолевой ткани у больных с незначительным регрессом опухоли или отсутствием динамики после лучевой терапии обнаружено статистически значимое (p<0,05) снижение экспрессии микроРНК-6757 в 5,0 раз относительно уровня экспрессии в нормальной ткани и в 4,4 раза относительно экспрессии в опухолевой ткани у больных с полным регрессом опухоли. Данная микроРНК таргетирует ген BRCA2, и её снижение теоретически должно способствовать увеличению экспрессии BRCA2, что показано нами ранее [1].
Экспрессия miR-1273h, miR-6737, miR-661, miR-4728, miR-6808 и miR-30b статистически значимо (p<0,05) снижена в 2,5; 3,3; 1,7; 5,0; 5,0 и 1,8 раза в опухолевой ткани у больных с полным регрессом опухоли относительно нормальной ткани. При этом уровень экспрессии miR-1273h в 2,3 раза, miR-6819 в 2,3 раза, miR-6737 в 3,0 раза, miR-6874 в 3,3 раза, miR-4728 в 4,0 раза и miR-6808 в 5,0 раз статистически значимо (p<0,05) выше в опухолевой ткани у больных с незначительным регрессом опухоли/ отсутствием динамики после лучевой терапии относительно аналогичных показателей в опухолевой ткани больных с полным регрессом опухоли. Следует отметить, что hsa-miR-6812-5p статистически значимо (p<0,005) снижает экспрессию в опухолевой ткани пациентов группы 1 и 2 в 1,9 и 1,7 раза соответственно относительно нормальной ткани прямой кишки. Указанные выше микроРНК таргетируют ген каспазы-9, и теоретически их высокая экспрессия у больных с незначительным регрессом опухоли/ отсутствием динамики должна способствовать снижению экспрессии этого гена, а их более низкая экспрессия у больных с полным регрессом опухоли, наоборот, должна способствовать повышенному уровню транскрипционной активности гена инициаторной каспазы-9, выполняющей критическую для запуска апоптоза функцию. Дифференциальная экспрессия CASP9 в этих двух группах больных была обнаружена в нашем предыдущем исследовании [1].
В опухолевой ткани у пациентов с полным регрессом опухоли обнаружено статистически значимое (p<0,05) увеличение экспрессии микроРНК miR-3202 и miR-5195 в 4,5 и 1,8 раза соответственно относительно экспрессии в нормальной ткани и в 3,0 и 3,6 раза соответственно относительно экспрессии в опухолевой ткани у пациентов с незначительным регрессом опухоли/отсутствием динамики после лучевой терапии. Эти две микроРНК таргетируют H2AFX (H2AX) - ген, который кодирует гистоновый белок, инициирующий ремоделирование хроматина при двуцепочечных разрывах в ДНК, вызванных ионизирующим облучением. Такое ремоделирование хроматина позволяет белку BRCA1/2 связаться с участком ДНК, на котором произошел двуцепочечный разрыв [12; 13]. Соответственно, повышенная экспрессия miR-3202 и miR-5195 у больных с полным регрессом опухоли будет способствовать сниженной экспрессии гена H2AX, а обратный эффект будет наблюдаться у больных с незначительным регрессом опухоли/ отсутствием динамики после лучевой терапии, что находит подтверждение в результатах исследования Кутилина Д.С. и соавторов [1], выполненного в 2019 году.
Также обнаружено статистически значимое (p<0,05) повышение уровня экспрессии miR-130b в 5,2 раза в опухолевой ткани у больных с полным регрессом опухоли и снижение в 1,7 раза в опухолевой ткани у больных с незначительным регрессом опухоли или отсутствием динамики относительно нормальной ткани прямой кишки. При этом у больных первой группы экспрессия hsa-miR-130b-3p была в 8,7 раза выше (p<0,05) по сравнению с больными второй группы. Это, очевидно, способствовало снижению экспрессии гена RBBP8 у больных первой группы и повышению его экспрессии у больных второй группы, показанному в работе Кутилина Д.С. и соавторов [1]. Данный ген кодирует белок, регулирующий пролиферацию клеток [14].
Как известно, микроРНК имеют множество мишеней [5; 15], поэтому для дифференциально экспрессирующихся (hsa-miR-130b-3p, hsa-miR-6819-5p, hsa-miR-1249-5p, hsa-miR-6874-5p, hsa-miR-4728-5p, hsa-miR-6808-5p, hsa-miR-3202, hsa-miR-5195-3p, hsa-miR-6820-3p, hsa-miR-557, hsa-miR-6757-3p, hsa-miR-1273h-5p, hsa-miR-6737-5p) в опухолевых тканях двух групп пациентов микроРНК был проведен анализ избыточной представленности микроРНК в сигнальных путях (ORA, Over-Representation Analysis). Результаты анализа представлены в таблице 2.
Таблица 2
Представленность (over-represented) дифференциально экспрессирующихся микроРНК в сигнальных путях (KEGG Pathways)
|
Сигнальный путь |
P-value |
Кол-во miRNA |
микроРНК |
|
Переваривание и всасывание белков |
0,0005 |
11 |
miRNA-130b, miRNA-557, miRNA-3202, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-6757, miRNA-5195, miRNA-1249 |
|
Апоптоз |
0,0006 |
11 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Сигнальные каскады эпителиальных клеток при инфекции Helicobacter pylori |
0,0010 |
11 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь Notch |
0,0023 |
10 |
miRNA-1249, miRNA-557, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь RIG-I-подобного рецептора |
0,0027 |
10 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Сигнальный путь Wnt |
0,0060 |
13 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь p53 |
0,0061 |
13 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Окислительное фосфорилирование |
0,0062 |
11 |
miRNA-1249, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь IL-17 |
0,0079 |
11 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Метаболизм лекарств |
0,0094 |
8 |
miRNA-1249, miRNA-557, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Сигнальные пути сфинголипидов |
0,0173 |
12 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Некроптоз |
0,0174 |
12 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сплайсосома |
0,0180 |
12 |
miRNA-1249, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Транспорт РНК |
0,0228 |
12 |
miRNA-1249, miRNA-6820, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-130b |
|
Сигнальный путь Toll-подобного рецептора |
0,0262 |
10 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Сигнальный путь NOD-подобного рецептора |
0,0318 |
12 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Биогенез рибосом |
0,0360 |
9 |
miRNA-1249, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь TGF-beta |
0,0386 |
11 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Клеточное старение |
0,0396 |
13 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь нейротрофина |
0,0404 |
12 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Сигнальный путь ABC транспортеров |
0,0431 |
6 |
miRNA-557, miRNA-1273h, miRNA-4728, miRNA-6808, miRNA-5195, miRNA-130b |
|
Сигнальный путь VEGF |
0,0444 |
9 |
miRNA-1249, miRNA-6820, miRNA-6757, miRNA-6737, miRNA-6819, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
|
Формирование плотных контактов |
0,0453 |
12 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Цитомегаловирусная инфекция человека |
0,0469 |
13 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195, miRNA-130b |
|
Убиквитин-опосредованный протеолиз |
0,0481 |
11 |
miRNA-1249, miRNA-6820, miRNA-557, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-130b |
Как видно из представленных в таблице 2 данных, дифференциально экспрессирующиеся в двух группах пациентов микроРНК, помимо регуляции транскрипционной активности генов RBBP8, H2AX, BRCA2, CASP9 и BCL2, участвуют в следующих ключевых сигнальных путях и биологических процессах: апоптоз, окислительное фосфорилирование, убиквитин-опосредованный протеолиз, формирование клеточных плотных контактов, сигнальный путь VEGF, сигнальный путь Toll-подобного рецептора и NOD-подобного рецептора, сигнальный путь Notch и Wnt, сигнальный путь p53 и др. (табл. 2, рис. 3).

Рис. 3. Облако категорий (wordcloud of categories) сигнальных путей дифференциально экспрессирующихся микроРНК (100 категорий с наименьшим значением P-value)
Заключение
Данное исследование выявило, что эффективность ЛТ опухолей прямой кишки может быть ассоциирована с дифференциальной экспрессией 13 микроРНК (miRNA-130b, miRNA-1249, miRNA-6820, miRNA-6757, miRNA-1273h, miRNA-6737, miRNA-6819, miRNA-557, miRNA-6874, miRNA-4728, miRNA-6808, miRNA-3202, miRNA-5195), которая обеспечивает эффективную регуляцию системы восстановления двухцепочечных разрывов ДНК (увеличение экспрессии BRNACA2, H2AX и RNABBP8 при снижении экспрессии miRNA-6757, miRNA-3202, miRNA-5195 и miRNA-130b, и наоборот) и регуляцию апоптоза (увеличение экспрессии CASP9 при снижении экспрессии miRNA-1273h, miRNA-6737, miRNA-661, miRNA-4728 и miRNA-6808, снижение экспрессии BCL2 при повышении экспрессии miRNA-1249, miRNA-6820, miRNA-557, и наоборот).
Исследование выполнено в рамках гос. задания «Поиск предикторов радиорезистентности рака прямой кишки и разработка персонифицированных неоадъювантных терапевтических подходов».
Библиографическая ссылка
Кутилин Д.С., Гусарева М.А., Кошелева Н.Г., Габричидзе П.Н., Донцов В.А., Легостаев В.М., Шляхова О.В., Лиман Н.А., Солнцева А.А., Васильева Е.О. ВЛИЯНИЕ АБЕРРАНТНОЙ ЭКСПРЕССИИ МИКРОРНК НА ЭФФЕКТИВНОСТЬ ЛУЧЕВОЙ ТЕРАПИИ ОПУХОЛЕЙ ПРЯМОЙ КИШКИ // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30384 (дата обращения: 02.01.2026).
DOI: https://doi.org/10.17513/spno.30384



