Актуальность поиска средств профилактики ревматоидного артрита определяется высоким социально-экономическим бременем заболевания на общество, заключающимся в утрате профессиональной трудоспособности и инвалидизации, вовлеченностью относительно широких слоев населения в патологию – от 0,5 до 1,0% (при 5,8-6,8% в отдельных регионах мира [1]), увеличением рисков развития болезни после 60 лет [2]. Так, по оценкам экспертов, среднегодовые медицинские затраты, включая лечение, на одного пациента с диагнозом РА составляют от 2682 (Таиланд) до 4457 (Китай) долларов США [3; 4]. Общегосударственные затраты в двух наиболее экономически развитых регионах мира – США и Европе, составляют соответственно 41,6 и 45,3 млрд евро в год [5].
Эффективность лечения ревматоидного артрита напрямую зависит от сроков постановки клинического диагноза и начала базисной терапии. Отсутствие многопрофильных медицинских центров во многих регионах нашей страны и сложность диагностических процедур при ревматоидных заболеваниях обусловливают необходимость развития комплекса вспомогательных мер для реализации подхода T2T (Treat to Targe – «Лечение до достижения цели») в лечении РА [6]. Для улучшения существующей ситуации авторами работы [7] предлагается ряд практических рекомендаций, включающих расширение междисциплинарного взаимодействия и обогащение опыта, накопленного ревматологами, за счет достижений других смежных медицинских специальностей. В этом аспекте представляется важным поиск и изучение эффективных и безопасных способов профилактики негативных проявлений ревматоидного артрита на начальных стадиях заболевания, ассоциированного с дисбалансом иммунной системы.
Основу механизмов развития РА составляет неинфекционный воспалительный процесс в соединительной ткани, одним из проявлений которого является оксидативный стресс, обусловленный активацией генерации свободных радикалов в результате избыточного патологического функционирования иммунитета [8; 9]. Изучение возможности коррекции антиоксидантного статуса и энергетического обмена в патогенезе аутоиммунного РА является актуальным вопросом современной медицины.
Цель исследования – научное обоснование эффективности применения смеси лимонной и янтарной кислот для профилактики индуцированного аутоиммунного артрита в эксперименте на теплокровных животных.
Материалы и методы исследования. Исследования проводили на крысах-самцах линии Wistar (n=29) массой 400-440 г в возрасте 24 месяца (ФГУП «Питомник лабораторных животных «Рапполово», Ленинградская область). Животные содержались в стандартных условиях вивария при постоянной температуре, влажности и световом режиме 12:12 со свободным доступом к пище и воде. В работе с лабораторными животными придерживались правил и этических норм содержания и ухода, описанных в руководстве National Research Council, 2011 г., и ГОСТ Р53434-2009 «Принципы надлежащей лабораторной практики», с разрешения этического комитета при Институте биомедицинских исследований РАН. Эвтаназию крыс осуществляли в CO2-затравочной камере. Животные были разделены на четыре группы. Манипуляции по введению растворов проводились под легким общим наркозом («Золетил», Франция). Крысам первой группы (негативный контроль (n=6)) вводили в правую заднюю конечность подкожно изотонический раствор натрия хлорида в объеме 0,1 мл на 200 г веса. Во второй группе крыс (позитивный контроль (n=7)) моделировали адъювантный артрит путем однократного введения в правую заднюю конечность адъюванта Фрейнда (АФ) DIFCO LABORATORIES (Detroit, Michigan, США) в объеме 0,1 мл на 200 г веса. Животным третьей и четвертой групп (по 8 животных в каждой) на фоне индуцированной патологии (0,1 мл на 200 г веса АФ) вводили однократно в день с едой смесь лимонной и янтарной кислот («Л» и «Я» соответственно) в массовом соотношении 1:4 на протяжении всего периода эксперимента (7 недель). Дозировка кислот (нейтрализованных до рН=7,5 минеральной водой) составляла: третья группа 17 мг/кг, четвертая – 88 мг/кг.
Суммарную оксигеназную активность митохондрий лимфоцитов периферической крови определяли цитобиохимическим методом. Для этого по истечении 7 недель с момента введения затравок под общим наркозом у животных из сердца отбирали кровь и наносили на обезжиренные смесью Никифорова стекла. Равномерность нанесения обеспечивалась использованием аппарата Microscopy Vision (Австрия). Мазки высушивали на воздухе при комнатной температуре в течение 30 минут, а затем их фиксировали забуференным (10 мМ HEPES) 60% раствором ацетона (рН 5,2-5,4) на бидистиллированной воде. После фиксации стекла ополаскивали дистиллированной водой и повторно высушивали на воздухе в течение 30 минут. Оценку оксигеназной активности осуществляли по реакции восстановления нитросинего тетразолия окисленного (НСТ) в среде, содержащей следующие реагенты: KCl - 125 мМ, HEPES – 10 мМ, НСТ – 1 мг/мл, рН 7,2±0,01 при температуре 37 °С.
Мазки инкубировали в водяном термостате 1 ТЖ-0-03 в течение 1 часа при температуре 37 °С и небольшом перемешивании. По окончании процесса стекла ополаскивали дистиллированной водой и высушивали при комнатной температуре в течение 20 минут. Ядра клеток окрашивали 0,05% раствором водного нейтрального красного в течение 8 мин., затем предметные стекла промывали в течение 5-10 секунд в дистиллированной воде. Высушенные на воздухе мазки подвергали микроскопическому анализу не позднее чем за 1 месяц после получения. Клетки фотографировали и обрабатывали в программах Blood Runner и BioImages (г. Пущино), используя тринокулярный микроскоп «Микромед-2» (Россия), увеличение 10х100 и цифровую камеру Toup Cam 9.0 MP (Китай). На каждую крысу анализировалось по 100 лимфоцитов, рандомизированно отбираемых из трех зон стекла: начальной, средней и финишной. Интенсивность восстановления НСТ и особенности морфологических признаков иммунных клеток (радиус) рассчитывали в соответствии с принципом работы программы, основанным на обсчете площадных характеристик клеток и их компартментов, сканирования гранул на разных уровнях плотности, что позволяло выявить интенсивность отложения формазана, вычислить количество образуемого маркера дыхательной активности митохондрий – диформазана (рис. 1). Биохимические исследования проведены в соответствии с протоколом, описанным в [10].

Рис. 1. Вариант профайла, полученный на основании цифровой обработки первичного снимка лимфоцита
У всех крыс в конце эксперимента проводили комплексное обследование, включающее общий осмотр, пальпацию и определение антропометрических показателей (размеры задних лапок).
Статистический анализ данных проводили с использованием критерия Стьюдента и коэффициента корреляции Пирсона (rxy) в программе Excel 2016.
Результаты исследования и их обсуждение
Введение животным адъюванта Фрейнда, представляющего собой водно-масляную эмульсию термически обработанных микобактерий [11], привело к активации аутоиммунной реакции, вызывающей выраженные дистрофические изменения в костно-мышечном аппарате подопытных грызунов (рис. 2).
|
а |
б |
|
в |
г |
Рис. 2. Фотографии правых задних конечностей контрольных и опытных крыс: а – негативный контроль; б – позитивный контроль; в, г – животные, получавшие смесь лимонной и янтарной кислот в концентрациях 17 и 88 мг/кг веса соответственно
Из рисунка видно, что деформация суставов животных модельной группы (позитивный контроль (рис. 2б)) достигает максимальной степени выраженности; при пальпации у отдельных крыс выявляется анкилоз. В группах леченых животных припухлость суставов и отечность тканей проявляются в меньшей степени, свидетельствуя о профилактическом действии исследуемой антиоксидантной смеси из кислот (рис. 2 в, г).
Поскольку течение системных заболеваний сопровождается энергетическим дефицитом, нами изучены изменения суммарной оксигеназной активности митохондрий клеточного звена иммунной системы в ходе эксперимента (рис. 3).
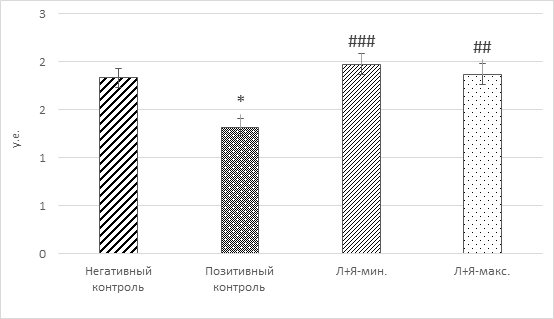
Рис. 3. Общая оксигеназная активность митохондрий лимфоцитов у крыс
(*-р<0,05 относительно негативного контроля; ##-p<0,01, ###-p<0,001 относительно позитивного контроля)
Из рисунка 3 видно, что на поздних стадиях развития патологии метаболическая активность митохондрий достоверно снижается на 29% относительно контрольной группы. Включение в состав диеты животных основных субстратов цикла Кребса, обладающих антиоксидантными свойствами, приводит к коррекции энергетического статуса. Энергообмен в клетках леченых животных достоверно возрастает на 42-50% относительно модельной группы с индуцированной патологией. При этом видно, что применение смеси лимонной и янтарной кислот в дозировках 17 мг/кг способствует сохранению физиологической активности энергообеспечивающих органелл клетки на уровнях, отвечающих норме (контрольные животные).
На рисунке 4 представлены результаты измерения линейных размеров клеток лимфоидного ростка.
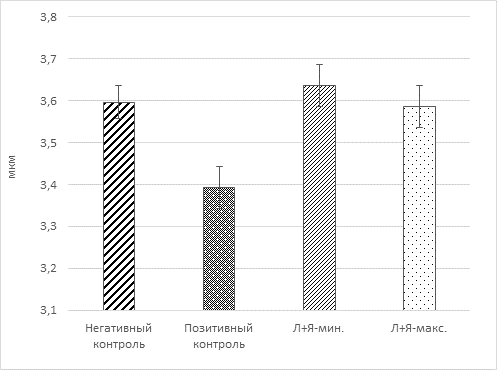
Рис. 4. Радиус лимфоцитов
Из рисунка 4 видно, что дефицит энергии, выявленный для животных модельной группы (позитивный контроль), сказывается на морфологических признаках иммунных клеток. Относительно группы негативного контроля радиус клеток у крыс с адъювант-индуцированным аутоиммунным РА оказывается сниженным на 6%, в то время как профилактика сукцинат-цитратной смесью приводит к сохранению размеров лейкоцитов в пределах нормы и составляет 3,59-3,64 мкм.
Одним из наиболее характерных клинических признаков ревматоидного артрита является симметричное поражение суставов, которое нами отмечено уже на 4-й неделе с момента индукции патологии. К окончанию эксперимента (7-я неделя) выраженность симптоматики неуклонно нарастала. Авторы работы [12] приводят схожие результаты, демонстрирующие воспаление и отек конечностей у крыс в условиях адъювант-индуцированного артрита.
Поскольку воспалительный процесс протекает с гиперактивацией процессов липопероксидации, непосредственное антиоксидантное действие применяемых веществ может быть дополнительно усилено за счет хелатирующей способности янтарной кислоты, которая образует малорастворимые соединения с переходными металлами переменной валентности, присутствующими в биосредах организма:
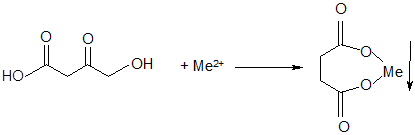 ,
,
где Ме2+ - ионы железа или меди. При этом растворимость сукцината железа составляет 0,36 г/100 мл, а меди – еще меньше: 0,04 г /100 мл. Указанные элементы являются катализаторами разложения перекиси водорода на высокореактивные интермедиаты – гидроксильные радикалы в реакции Фентона:
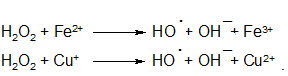
Реакция Фентона, составляющая основу процессов свободнорадикального биологического окисления в цикле Габера-Вейсса [13], служит движущей силой инициации процессов перекисного окисления липидов, являющих этиологическую основу оксидативного стресса и нарушения нормального функционирования биологических мембран. В этом аспекте можно рассматривать позитивный вклад в профилактический эффект исследуемой смеси органических кислот за счет мембраностабилизирующего действия.
Особого внимания заслуживают данные биохимического и морфологического изучения лейкоцитов животных. Высокая степень корреляции между суммарной оксигеназной активностью митохондрий лимфоцитов и их радиусом, выявляемая значением rxy=0,99, свидетельствует о недостаточности энергетического обеспечения клеток в условиях патологии и, как следствие, снижении пластического обмена в процессе митоза лимфобластов. Это может также сказываться на функциональной активности основных клеток иммунной системы, обеспечивающих гуморальный и клеточный иммунитет. Коррекция патологических изменений с помощью смеси лимонной и янтарной кислот благоприятствует поддержанию метаболической активности АТФ-продуцирующих органоидов на уровне животных контрольной группы и проявляется сохранением размеров клеток в диапазоне физиологической нормы.
Заключение
Применение цитрат-сукцинатной смеси обеспечивает сохранение морфофункциональных свойств лимфоцитов и способствует устранению некоторых патологических изменений вследствие адъювант-индуцированного ревматоидного артрита, что определяет целесообразность включения указанных компонентов в состав комплексной профилактики патологии соединительной ткани.
Библиографическая ссылка
Скупневский С.В., Пухаева Е.Г., Бадтиев А.К., Руруа Ф.К., Батагова Ф.Э., Фарниева Ж.Г. ПРОФИЛАКТИЧЕСКИЙ ЭФФЕКТ СМЕСИ ЛИМОННОЙ И ЯНТАРНОЙ КИСЛОТ В МОДЕЛИ АУТОИММУННОГО РЕВМАТОИДНОГО АРТРИТА У КРЫС // Современные проблемы науки и образования. 2020. № 6. ;URL: https://science-education.ru/ru/article/view?id=30379 (дата обращения: 24.01.2026).
DOI: https://doi.org/10.17513/spno.30379







