Метастатический процесс в злокачественных опухолях является многосторонним, и, несмотря на его роль в исходе заболевания и эффективности лечения онкологических больных, остается много вопросов, связанных как со свойствами самой опухоли, так и с состоянием регуляторных систем иммунитета больного [1]. Количество циркулирующих опухолевых клеток (ЦОК) в качестве одного из таких механизмов рассматривается и исследуется во всем мире в течение двух последних десятилетий [2]. Результаты корреляции ЦОК и состояния иммунной системы нередко являются противоречивыми и в большинстве своем выполнены на экспериментальных моделях. В связи с этим представляется важной оценка состояния иммунной системы у онкологических больных в зависимости от наличия ЦОК, с учетом того, что она может играть как противоопухолевую, так и проонкогенную роль. Колоректальный рак (КРР) в силу локализации тесно связан не только с системным, но и с локальным иммунитетом [3]. Известно, что у больных с онкологической патологией происходит нарушение различных звеньев иммунитета [4, 5]. Изучение системного иммунного статуса больных КРР после различных оперативных вмешательств показало большую сохранность Т-, В- и НК-клеточного звеньев иммунитета после лапароскопического удаления опухоли толстой кишки, в отличие от открытой операции [6].
Иммунные инфильтраты различаются между типами опухолей и между отдельными пациентами. В одной опухоли могут существовать различные типы иммунных клеток, в том числе врожденные и адаптивные иммунные клетки [7].
Изучение взаимодействия таких системных показателей, как ЦОК, с локальными особенностями иммунологического микроокружения и эпителиально-мезенхимального перехода необходимо для понимания биологии опухоли. Подобные исследования в перспективе могут быть использованы для прогнозирования течения заболевания и разработки новых подходов к лечению.
Цель исследования: проведение корреляционного анализа показателей локального противоопухолевого иммунитета и маркеров эпителиально-мезенхимального перехода и количества циркулирующих опухолевых клеток у первичных больных с II–IV стадией колоректального рака.
Материал и методы исследования. В исследовании принимали участие 60 первичных больных с II–IV стадией КРР (по 20 человек с каждой стадией). Все больные были проинформированы об исследовании и подписывали согласие на участие в нем.
Детекцию ЦОК у больных выполняли до операции. Для этого проводили забор 8 мл периферической крови из локтевой вены в пробирки Сell Save Preservative Tube (Janssen Diagnostics LLC, США), содержащие антикоагулянт K2ЭДТА в смеси с реагентом для сохранения жизнеспособности опухолевых клеток. Подготовленные образцы крови помещали в систему анализа CellSearchSystem™ (Janssen Diagnostics LLC, США), которая состоит из двух аппаратов: а) CellTracks® AutoPrep® System, обогащающего суспензию клетками с экспрессией маркера адгезии эпителиальных клеток EpCAM, основного лимфоцитарного маркера CD45 и цитокератинов 8, 18, 19; б) анализатора CellTracks® Analyzer II®. ЦОК≤3 считали негативными (ЦОК-), ЦОК>3 – позитивными (ЦОК+). Оценку статистической достоверности различий между уровнем ЦОК в группах исследования определяли по t-критерию Стьюдента. Данные выражали средними значениями и их ошибкой.
После оперативного вмешательства проводили иммуногистохимическое (ИГХ) исследование уровня опухолевой инфильтрации клетками иммунной системы с применением моноклональных антител к человеческому CD3, CD4, CD8, CD20 и CD56 (Abcam, Великобритания) и экспрессии белков эпителиально-мезенхимального перехода: E-cadherin, N-cadherin (DAKO, Германия). Данные ИГХ анализа выражали как средние значения выборки в каждой группе. Сравнение совокупностей по количественным признакам проводили по U-критерию Манна–Уитни. U-критерий Манна–Уитни является непараметрическим критерием, поэтому не требует наличия нормального распределения сравниваемых совокупностей и подходит для сравнения малых выборок.
Корреляционный анализ между показателями ИГХ анализа и уровнем ЦОК проводили в программе Statistica. Для выборок, подчиняющихся нормальному закону распределения (согласно критерию Шапиро–Уилка, поскольку выборки менее 50 значений), применяли параметрический коэффициент корреляции Пирсона, а для выборок, не подчиняющихся нормальному закону распределения, – непараметрический коэффициент корреляции Спирмена.
Результаты исследования и их обсуждение. Исследование уровня ЦОК у больных II–IV стадией КРР показало у всех больных системное наличие опухолевых клеток в периферической крови (рис. 1). У пациентов со II стадией КРР ЦОК определяли в 65% случаев (у 13 больных из 20) в количестве от 1 до 7 клеток. Средние значения в данной группе составили 2±0,5 ЦОК. В группе с III стадией КРР циркулирующие опухолевые клетки детектировали в 85% случаев (у 17 больных из 20), при этом максимальное количество ЦОК – у 1 пациента, а, следовательно, и вариационный разброс уровня ЦОК в данной группе был больше, чем у больных со II стадией КРР данного исследования, и составил от 1 до 47 клеток. Средние значения уровня ЦОК в группе больных с III стадией КРР составили 6,2±3,8. В группе с генерализованным КРР (IV стадия) ЦОК выявляли в 75% случаев (у 15 больных из 20). Для больных с IV стадией КРР был характерен большой разброс количества определяемых ЦОК, которые находились в диапазоне от 1 до 121 клеток. Средние значения уровня ЦОК у больных с IV стадией КРР составили 8,4±4,4. Высокие значения ЦОК в данной группе встречались лишь в единичных случаях, а именно у 4 больных с количеством ЦОК, равным 17, 20, 31 и 121. Изучение показателей ЦОК в зависимости от стадии опухолевого процесса при КРР не показало связи частоты определения опухолевых клеток в периферической крови со стадией заболевания.

Рис. 1. Диаграмма размаха уровня ЦОК у больных со II–IV стадией КРР
Вместе с тем наблюдали увеличение количества ЦОК при росте злокачественности опухоли, что объяснимо для IV стадии, в которой происходит активное метастазирование опухолевых клеток. Однако для II и III стадий развития опухоли подобное нехарактерно, при этом мы наблюдали диссеминацию опухолевых клеток уже при местно-распространенном процессе. В свою очередь это согласуется с ранее проведенными экспериментальными исследованиями. Например, Fidler и иные (1970) обнаружили на мышиных экспериментальных моделях метастазирования, что в преметастатических легких через 24 ч после внутривенной инъекции опухолевых клеток лишь 1% сохраняет жизнеспособность [8]. В работе Luzzi и соавт. (1998) на 13-й день после инъекции опухолевых клеток только 1% микрометастазов в печени прогрессировал с образованием макрометастазов, 36% опухолевых клеток оставались изолированными; 95% из них были в состоянии покоя (2% пролиферативные и 3% апоптотические) [9]. В отечественном исследовании А.А. Ковалева и иных (2012) было показано, что лишь 0,01% ЦОК достигают своей метастатической ниши и реализуются в метастазы [10]. Вероятными причинами подобного могут являться механический стресс в кровеносных сосудах, сложность перемещения из одного участка в другой, наличие конечной микросреды, не подходящей для пролиферации, и вмешательство клеток иммунной системы больного (иммунный надзор) [8, 9, 11]. Исходя из этих предположений, возможно, метастазирование опухоли происходит именно при IV стадии из-за увеличения числа опухолевых клеток, циркулирующих в периферической крови больного, что и было показано в нашей работе, хотя и в единичных случаях.
В работе Cohen и иных (2008) было показано, что уровень ЦОК меньше 3 (благоприятный прогноз) или больше 3 (неблагоприятный прогноз) при КРР коррелирует с прогнозом безрецидивной и общей выживаемости [12]. После распределения выборок по уровню ЦОК во всех стадиях преобладали больные с ЦОК≤3 (отрицательный уровень ЦОК) (табл.). Наибольшее количество случаев с отрицательным уровнем ЦОК было у больных со II стадией КРР и составило 15 человек (75%). Сравнение количества пациентов с ЦОК>3 во всех стадиях данного исследования показало наибольшее количество больных с позитивным уровнем ЦОК с III стадией КРР – 8 человек (40%).
Уровень ЦОК у больных со II–IV стадией КРР
|
Стадия КРР |
Уровень ЦОК |
|||
|
ЦОК≤3 |
ЦОК>3 |
|||
|
Абс. число |
Отн. число (%) |
Абс. число |
Отн. число (%) |
|
|
II стадия |
15 |
75 |
5 |
25 |
|
III стадия |
12 |
60 |
8 |
40 |
|
IV стадия |
14 |
70 |
6 |
30 |
Проведенное ИГХ исследование показало, что с увеличением стадии КРР от II к IV снижается опухолевая инфильтрация CD3+ клетками (II стадия – 70,9%, IV стадия – 62,05%) за счет уменьшения доли CD8+ клеток (II стадия – 41,2%, IV стадия – 26,8%) и статистически достоверно увеличивается процентное содержание CD20+ клеток (II стадия – 17,05%, IV стадия – 25,0%) (p≤0,05) (рис. 2).
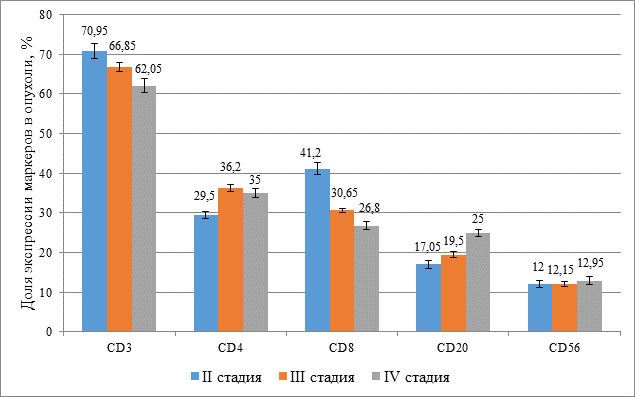
Рис. 2. Уровень опухолевой инфильтрации иммунными клетками у больных колоректальным раком II–IV стадии
Также достоверно снижается экспрессия E-кадгерина (II стадия – 90%, IV стадия – 25%) и повышается N-кадгерин (II стадия – 10%, IV стадия – 75%) (p≤0,05) (рис. 3).
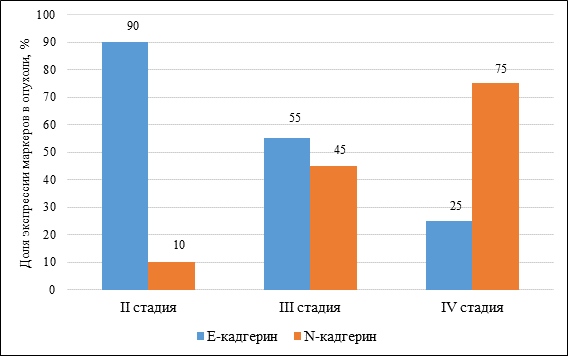
Рис. 3. Уровень экспрессии кадгеринов в опухолевых клетках у больных колоректальным раком II–IV стадии
Проведенный корреляционный анализ показал ряд статистически достоверных корреляций (например, потерю связи между показателями локального иммунитета у больных с ЦОК+ во II стадии КРР). Вместе с тем возникает отрицательная корреляция между СD4+ и экспрессией Е-кадгерина (p<0,05). Подобные изменения были отмечены и при III стадии, однако у этих больных возникают корреляции между Е- и N-кадгерином (p<0,05), что, вероятно, говорит об усилении эпителиально-мезенхимального перехода. У больных с IV стадией КРР были получены аналогичные данные.
При исследовании показателей ЦОК--больных в III стадии КРР в сравнении с данными у ЦОК--больных во II стадии обнаружена потеря связи локальных уровней CD4+ и CD8+, а у ЦОК--больных с IV стадией – и между CD3+ и CD4+. У тех же больных, начиная с III стадии, отмечается отрицательная корреляция между экспрессией Е- и N-кадгерина (p<0,05), не связанная с исследованными показателями клеточного локального иммунитета.
У ЦОК+-больных при всех трех исследованных стадиях КРР происходит потеря многих связей между показателями 3 звеньев клеточного локального иммунитета. Если у ЦОК--больных выявлены отрицательные корреляции между показателями Т-, В- и НК-клеток, то у ЦОК+-больных их количество сократилось до одной. Важной представляется положительная корреляция между локальными уровнями CD3+ и CD8+, выявленная при всех стадиях у ЦОК--больных и свидетельствующая о преобладании цитотоксических Т-клеток в опухоли. У ЦОК+-больных данная корреляция теряет достоверность независимо от стадии.
При II стадии у больных с ЦОК+ отмечена обратная корреляция между показателями локального иммунитета и экспрессией эпителиальных и мезенхимальных маркеров: между уровнем CD4-лимфоцитов и Е-кадгерина в опухолевых клетках, что, возможно, отражает наличие среди этих клеток иммуносупрессивной и ростостимулирующей фракции Т-регуляторных клеток.
Заключение. В ходе проведенного многоэтапного исследования системных показателей, таких как ЦОК, и локальных – уровня иммунологического микроокружения и эпителиально-мезенхимального перехода – у пациентов со II–IV стадией КРР была отмечена потеря взаимосвязи факторов локального иммунитета у ЦОК+-больных по сравнению с ЦОК--больными. Помимо этого, в нашей работе наличие ЦОК оказалось более значимым для определения количества и характера соотношения клеточных показателей локального иммунитета, чем стадия заболевания.
Библиографическая ссылка
Ситковская А.О., Новикова И.А., Златник Е.Ю., Ульянова Е.П., Шульгина О.Г., Колесников В.Е., Габричидзе П.Н., Донцов В.А., Мезенцев С.С. КОРРЕЛЯЦИОННЫЙ АНАЛИЗ ПОКАЗАТЕЛЕЙ ЛОКАЛЬНОГО ИММУНИТЕТА И ЭПИТЕЛИАЛЬНО-МЕЗЕНХИМАЛЬНОГО ПЕРЕХОДА БОЛЬНЫХ КОЛОРЕКТАЛЬНЫМ РАКОМ В ЗАВИСИМОСТИ ОТ УРОВНЯ ЦИРКУЛИРУЮЩИХ ОПУХОЛЕВЫХ КЛЕТОК // Современные проблемы науки и образования. 2020. № 5. ;URL: https://science-education.ru/ru/article/view?id=30107 (дата обращения: 15.12.2025).
DOI: https://doi.org/10.17513/spno.30107



