Известно, что выраженная лимфопения коррелирует с ухудшением состояния и снижением выживаемости при заболеваниях различной этиологии [1, 2]. Данное обстоятельство в значительной степени обусловлено патогенетической ролью общей неспецифической адаптационной реакции (АР) стресс, характеризующейся относительной лимфопенией и являющейся неспецифическим фоном развития большинства патологических процессов [3–5]. При этом речь идет об АР стресс как об интегральной реакции организма, развивающейся в ответ на высокоинтенсивные экзо- или эндогенные воздействия, часто выводящие организм за границы физиологической нормы [3, 5]. Более поздние вариации понятия «стресс», включающие так называемый физиологический стресс, или эустресс, соответствуют антистрессорным АР, кардинально отличающимся от АР стресс системными параметрами и влиянием на неспецифическую резистентность организма [5–7]. Было показано, что развитие стойких антистрессорных АР, в отличие от АР стресс, способствует улучшению состояния онкологических больных, повышению противоопухолевой резистентности организма и характеризуется увеличением относительного числа лимфоцитов до верхних значений зоны нормы [5, 8].
Ранее был установлен периодический характер системы АР как одного из важных механизмов адаптации [5, 9], обусловленный существованием различных уровней реактивности организма (УР), на которых могут развиваться АР стресс и известные антистрессорные АР. Относительная и абсолютная шкала зависимости характера интегральной реакции организма от интенсивности воздействия обеспечивает возможность адаптации биологических систем к широкому диапазону действующих факторов. Как выраженность структурно-функциональных и регуляторных нарушений при стрессе, так и степень активизации защитных систем, напряженность или сбалансированность регуляторных процессов при антистрессорных АР зависят от УР, на которых развиваются аналогичные АР. У онкологических больных нередко наблюдаются варианты наиболее неблагоприятной АР – АР стресс очень низких УР, характеризующиеся выраженной лимфопенией (относительное число лимфоцитов 10% и менее) и значительными отклонениями других гематологических показателей от нормальных величин [4, 5, 9]. При этом особенности адаптационного статуса онкологических больных, а также механизмы развития лимфопении и ее влияние на последующую динамику состояния больных со злокачественным процессом различной локализации при разных методах противоопухолевого лечения остаются недостаточно изученными [1, 2].
Цель работы состояла в сравнительном анализе адаптационного статуса и прогностической значимости его количественного показателя при выраженной лимфопении у двух категорий онкологических больных – пациенток с распространенным раком яичников при полихимиотерапии и больных с хирургическим лечением рака поджелудочной железы.
Материал и методы исследования
Исследования проводили у 14 пациенток в возрасте 43–70 лет, проходивших комбинированное лечение по поводу рака яичников (РЯ), и 19 больных в возрасте 49–80 лет, которым проводили хирургическое лечение рака поджелудочной железы (РПЖ). Большинство пациентов обеих групп имели сопутствующие заболевания, связанные с нарушениями деятельности нейроэндокринной и сердечно-сосудистой систем, воспалительными и дегенеративными процессами в органах опорно-двигательной системы.
В группе больных РЯ возраст большинства пациенток (71%) находился в пределах диапазона 50–70 лет. Критериями включения служили морфологически верифицированный РЯ III–IV стадии (T3cN0-1M0-1), асцитный вариант, отсутствие мутации генов BRCA 1/2. На первом этапе пациенткам проводилось 2–3 курса неоадъювантной полихимиотерапии (ПХТ) с использованием карбоплатина AUC и паклитаксела на фоне сопроводительной терапии. Дальнейшее продолжение курсов ПХТ зависело от эффективности лечения. На втором этапе пациенткам выполнялись хирургическое вмешательство и адъювантная ПХТ (до 6 курсов). Исследования проводили на этапе первого курса неоадъювантной (43%) или адъювантной (57%) ПХТ.
В группу больных РПЖ вошли 6 женщин и 13 мужчин. Доминировали пациенты в возрасте 50–70 лет (47%). Относительное число больных в возрасте менее 50 лет или более 70 лет не превышало 27%. Как правило, опухоль локализовалась в головке ПЖ и большом дуоденальном сосочке. В большинстве случаев проводили стандартную панкреатодуоденальную резекцию. Результаты гистологического анализа и постхирургического стадирования свидетельствовали о наличии у пациентов аденокарцином различной степени дифференцировки со II–III стадией (T1-3N0-1M0) распространенности процесса.
У всех исследованных больных перед началом лечения и через сутки после операции (РПЖ) или введения химиопрепаратов (РЯ) проводили анализ крови с подсчетом лейкоцитарной формулы. Гематологические показатели использовали для определения характера (типа) АР [3, 5, 7]. Кроме того, для идентификации АР также применяли экспертную компьютерную программу «Антистресс» [10]. Данная программа позволяет не только определять характер АР, но также и получать количественную характеристику АР в баллах – балльную оценку реакции (БО АР) и по гематологическим признакам напряженности АР оценивать относительный УР, на котором развивается конкретная реакция. В настоящее время с помощью программы «Антистресс» выделяют четыре диапазона УР – очень низкие, низкие, средние и высокие, на которых могут развиваться АР известных типов: АР стресс, антистрессорные АР тренировки, спокойной активации, повышенной активации. Согласно использованному алгоритму самые низкие значения балльной оценки – 1–50 баллов – соответствуют вариантам наиболее неблагоприятной интегральной реакции – АР стресс очень низких УР. Варианты АР стресс низких УР попадают в диапазон 51–100 баллов. Напряженным антистресорным АР очень низких УР соответствует диапазон 150–700 баллов (в порядке повышения баллов – АР тренировки, АР спокойной активации и АР повышенной активации). Диапазон 300–1600 баллов включает количественные оценки антистрессорных АР низких уровней реактивности. Далее следуют диапазон средних УР и диапазон высоких УР. Максимальная оценка – 6400 баллов – соответствует наиболее благоприятной интегральной реакции, развивающейся в ответ на действие низкоинтенсивных факторов – АР повышенной активации высоких УР. БО АР может служить количественным показателем адаптационного статуса.
Статистическую обработку результатов исследования проводили с использованием t-критерия Стьюдента и критерия Вилкоксона–Манна–Уитни.
Результаты исследования и их обсуждение
Функциональные нарушения, вызванные злокачественным процессом и сопутствующими заболеваниями, способствовали заметному снижению адаптационного статуса исследованных больных. Перед началом лечения у всех пациентов были отмечены АР низких или очень низких УР, тогда как в зрелом возрасте в случае отсутствия тяжелого патологического процесса и обострения хронических заболеваний обычно преобладают антистрессорные АР средних УР [6, 7]. Исследованные группы онкологических больных демонстрировали определенное сходство в распределении случаев БО АР в пределах трех выделенных диапазонов, в целом ограниченных значениями 80 и 800 баллов (рис. 1). В то же время пациенты с РПЖ и РЯ заметно различались по представленности значений БО АР в пределах диапазона минимальных значений (менее 50 баллов) и диапазона максимальных значений БО АР (более 1000 баллов). Так, в случаях РЯ были зафиксированы наиболее низкие БО АР (менее 50 баллов), соответствовавшие вариантам АР стресс очень низких УР, которые отсутствовали на данном этапе у больных РПЖ. Кроме того, пациенты с РПЖ отличались от онкогинекологических больных значительно большей (в 5 раз) частотой развития антистрессорных АР спокойной активации и АР повышенной активации низких УР, имевших БО более 1000 баллов (p<0,05, рис. 1). Выявленные различия адаптационного статуса могли быть обусловлены большей распространенностью злокачественного процесса у больных РЯ.
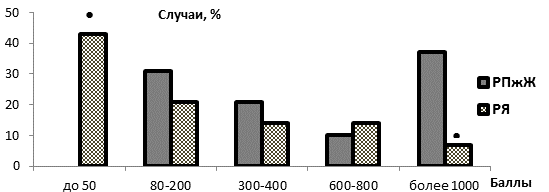
Рисунок 1. Распределение значений балльной оценки характера и напряженности общих неспецифических адаптационных реакций организм (БО АР) у больных раком поджелудочной железы (РПЖ) и раком яичников (РЯ) перед началом лечения
Примечание: • – статистически значимо отличается от значений при РПЖ, p<0,05
Оперативное вмешательство или ПХТ приводили к закономерному ухудшению показателей адаптационного статуса пациентов исследованных групп. Так, через сутки после панкреатодуоденальной резекции, в отличие от этапа перед началом лечения, не наблюдалось развития АР спокойной и повышенной активации низких УР. Более чем у половины больных РПЖ отмечали варианты АР стресс с лейкоцитозом и анэозинофилией. При этом почти у трети пациентов идентифицировали варианты АР стресс очень низких УР. Развития такой АР не наблюдалось у больных РПЖ до операции. Максимальная БО АР через сутки после панкреатодуоденальной резекции не превышала 400 баллов, тогда как исходно данный показатель был выше 1000 баллов более чем у трети пациентов (рис. 1).
У больных РЯ через сутки после введения химиопрепаратов наблюдалось еще более выраженное снижение БО АР (табл.). В подавляющем большинстве случаев (86%) в данной группе были отмечены варианты АР стресс очень низких УР с относительным числом лимфоцитов не более 10%. Средняя БО АР через сутки после ПХТ была в 3 раза ниже средней величины показателя у прооперированных больных РПЖ (p<0,05, табл.). Наличие немногочисленных случаев развития более благоприятных АР с БО, кратно превышавшими минимальные значения БО АР стресс очень низких УР, через сутки после ПХТ обусловило высокую вариабельность рассматриваемого показателя у больных РЯ. Коэффициент вариации БО АР в группе больных РЯ был в 3 раза выше, чем у пациентов с РПЖ (p<0,01, табл.).
Балльная оценка характера и напряженности общих неспецифических адаптационных реакций организм (БО АР) через сутки после панкреатодуоденальной резекции у больных раком поджелудочной железы (РПЖ) или после полихимиотерапии у больных раком яичников (РЯ)
|
Группа |
БО АР (баллы) |
CVБО АР (%) |
БОАР≤ 18 баллов |
|
|
Число случаев (%) |
Осложнения (%) |
|||
|
РПЖ, n=19 |
187±39,2 |
88 |
4(21) |
4(100) |
|
РЯ, n=14 |
60,5±43,5 ⃰ |
266 ⃰ |
12(86) ⃰ |
0 |
Примечание: CVБО АР –коэффициент вариации БО АР;
⃰ – статистически значимо отличается от значений при РПЖ, p<0,01– 0,05
В отличие от интерпретации межгрупповых различий в БО АР в отношении адаптационного статуса пациентов с РПЖ и РЯ до начала лечения, анализ весьма существенной разницы по БО АР между больными сравниваемых групп через сутки после лечебных воздействий представлял определенные трудности в связи с эффектами дексаметазона, применявшегося для премедикации больных РЯ. Введение дексаметазона, профилактируя развитие реакций гиперчувствительности на паклитаксел как препарат таксанового ряда, закономерно вызывало лейкоцитоз, анэозинофилию и сдвиг формулы белой крови влево, с развитием выраженной лимфопении, «маскируя» таким способом интегральные реакции на противоопухолевые химиопрепараты. Известно, что относительная лимфопения, вызванная глюкокортикоидами, обусловлена целым рядом процессов, приводящих к трансмиграции лимфоцитов через стенки кровеносных сосудов, цитокин-зависимому торможению пролиферации Т-клеток и апоптозу незрелых или активированных форм Т- и В-лимфоцитов [11].
Очевидно, для выяснения вопроса о значении сдвигов изученных показателей в адаптационном статусе больных РПЖ и РЯ через сутки после операции или проведения первого курса ПХТ целесообразно было оценить дальнейшую динамику состояния этих пациентов. Результаты анализа случаев развития осложнений в группе больных РПЖ свидетельствовали о прогностическом значении БО АР этих пациентов через сутки после панкреатодуоденальной резекции [12]. Так, осложнения (послеоперационный панкреатит, гастростаз) были отмечены у 4 больных, имевших через сутки после операции наиболее низкие БО АР, от 7 до 18 баллов, при относительном содержании лимфоцитов не более 10% и различных комбинациях отклонений других гематологических показателей от нормальных значений (табл.). И только в одном случае развитию осложнения предшествовала АР с более высокой БО, превышавшей также и БО АР нескольких пациентов, у которых осложнений не наблюдалось.
Как уже было отмечено, в отличие от больных РПЖ, в группе онкогинекологических больных через сутки после первого введения химиопрепаратов АР стресс очень низких УР была доминирующей интегральной реакцией (табл.). Во всех таких случаях, так же как и у 4 больных РПЖ с послеоперационными осложнениями, была отмечена БО АР не выше 18 баллов, соответствовавшая выраженной лимфопении с относительным содержанием лимфоцитов менее 10%, и комплексом негативных сдвигов ряда других гематологических показателей. При этом, в отличие от пациентов с РПЖ, у онкогинекологических больных не наблюдалось значительных осложнений. Во всех случаях спустя 3 недели были отмечены значительное улучшение гематологических показателей и увеличение БО АР (рис. 2), что позволяло беспрепятственно проводить очередной курс ПХТ.
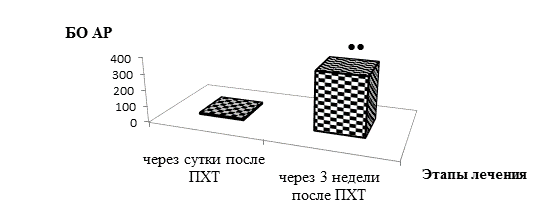
Рисунок 2. Восстановление адаптационного статуса больных раком яичников после полихимиотерапии (ПХТ)
Примечание: БО АР – балльная оценка характера и напряженности общих неспецифических адаптационных реакций организма
•• – статистически значимо отличается от значений через сутки после ПХТ, p<0,001
Возникает вопрос о причине наличия или отсутствия прогностического значения БО АР при выраженной лимфопении у исследованных категорий онкологических больных через сутки после интенсивных лечебных воздействий. Эта причина может быть обусловлена различным влиянием изученных методов лечения на организм пациентов. В обоих случаях очевидна связь лимфопении с эффектами глюкокортикоидов. При этом у больных РПЖ речь может идти о действии глюкокортикоидов надпочечникового происхождения, участвующих в механизмах развития острого операционного стресса. В группе больных РЯ лимфопения через сутки после ПХТ в наибольшей степени была связана с влиянием дексаметазона. Имеются сведения о более выраженных эффектах эндогенных глюкокортикоидов по сравнению с экзогенными [13]. Можно предположить, что в случае пациенток с РЯ действие дексаметазона приводило в первую очередь к увеличению миграции лимфоцитов из кровеносных сосудов без существенного повреждения этих клеток. Развитие же операционного стресса у больных РПЖ, вероятно, оказывало более выраженное негативное влияние на лимфоциты, в том числе на их функции, связанные с регуляцией состояния соматических клеток и процессов регенерации [14, 15], что и могло в определенной степени обусловить развитие послеоперационных осложнений у некоторых пациентов.
Заключение
Обнаружены различия в исследованных качественных и количественных характеристиках адаптационного статуса больных раком яичников и пациентов, страдающих раком поджелудочной железы, которые могут быть связаны с большей распространенностью злокачественного процесса у онкогинекологических больных. Изучение динамики состояния исследованных больных после интенсивных лечебных воздействий различной модальности указывает на возможную зависимость прогностической значимости балльной оценки адаптационных реакций при выраженной лимфопении, развивающейся в ранние сроки после воздействия, от эндогенного или экзогенного происхождения глюкокортикоидов как регуляторов процессов миграции, пролиферации и апоптоза лимфоцитов крови. Прогностическое значение показателя отмечено только у больных раком поджелудочной железы.
Библиографическая ссылка
Жукова Г.В., Якубова Д.Ю., Газиев У.М., Снежко А.В., Меньшенина А.П., Моисеенко Т.И., Торпуджан И.С., Гуськова Н.К. АДАПТАЦИОННЫЙ СТАТУС И ПРОГНОСТИЧЕСКАЯ ЗНАЧИМОСТЬ ЕГО КОЛИЧЕСТВЕННОГО ПОКАЗАТЕЛЯ ПРИ ВЫРАЖЕННОЙ ЛИМФОПЕНИИ У РАЗНЫХ КАТЕГОРИЙ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ // Современные проблемы науки и образования. 2020. № 4. ;URL: https://science-education.ru/ru/article/view?id=29944 (дата обращения: 01.01.2026).
DOI: https://doi.org/10.17513/spno.29944



