Постгипоксическая энцефалопатия (ПЭ), возникающая в хирургической практике в интраоперационном или раннем послеоперационном периодах, – это изменение структурного и функционального состояния головного мозга преимущественно сосудистого генеза, проявляющееся в виде преходящих или стойких неврологических или нейропсихологических нарушений. Данное состояние до сих пор отличается высокой распространенностью после аортокоронарного шунтирования (АКШ), способствует снижению качества жизни пациентов и их приверженности терапии, ухудшению бытовой и социальной адаптации [1]. Классификация клинических типов ПЭ включает в себя инсульт, послеоперационную когнитивную дисфункцию и делирий [2].
Несмотря на высокую актуальность церебральных осложнений кардиохирургических вмешательств, вопросы их ранней диагностики остаются во многом нерешенными. В последнее время получают распространение методики, направленные на изучение коннектома – полного описания структуры связей в головном мозге, основы его структурной и функциональной организации. Так, структурная коннективность описывает морфологическую связь между участками мозга, которая осуществляется с помощью проводящих путей. Функциональная же коннективность является отражением синхронной активации нейронов, расположенных в разных областях, но объединенных выполнением единой определенной задачи, формирующих сети покоя головного мозга [3]. Можно предположить, что изучение изменений в сетях покоя при сопоставлении с клиническими данными позволит определить ранние диагностические признаки ПЭ.
C целью профилактики церебральных осложнений применяются стратегии, направленные на оптимизацию самого хирургического вмешательства и анестезиологического пособия [4]. В настоящее время, к сожалению, также не найдено лекарственного средства, обладающего доказанным надежным и эффективным нейропротекторным действием у пациентов, которым предстоит АКШ.
Известно, что в профилактике нейрональной депрессии и в последующих процессах восстановления целостности нейронов головного мозга определяющую роль играют нейротрофические факторы, стимулирующие процессы нейропластичности и репарацию нейронов. Уровень нейротрофического фактора головного мозга (BDNF) и фактор роста нервов (NGF) коррелируют со степенью восстановления нейрональной активности [5]. Одним из препаратов, активирующих синтез нейротрофинов (в том числе BDNF и NGF) в головном мозге, является «Семакс» — синтетический гептапептид (фрагмент АКТГ4-7 с присоединением трипептида Pro-Gly-Pro) с аминокислотной последовательностью метионил-глутамил-гистидил-фенилаланил-пролил-глицил-пролин (формула С39Н55N9O12S, молекулярная масса 873,97 Да). Важными особенностями препарата являются быстрота наступления терапевтического эффекта, отсутствие развития лекарственной зависимости и синдрома отмены. При гипоксическом повреждении нейронов «Семакс» оказывает нейропротективное, нейрометаболическое и антиоксидантное действие, которое основывается на синтезе нейротрофинов, повышении активности эндогенной антиокислительной системы (инициация синтеза ключевого фермента системы – супероксиддисмутазы), снижении уровня оксида азота и циклического гуазинмонофосфата [6].
Цель исследования – проанализировать клинические типы ПЭ у пациентов, перенесших АКШ, выявить морфофункциональные корреляции, определить безопасность и эффективность нейропротекторной терапии.
Материал и методы исследования. В исследовании приняли участие 108 пациентов, которые получили АКШ в плановом порядке в ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России по поводу ишемической болезни сердца. Группу «Работающее сердце» сформировали 28 пациентов (14 мужчин, 14 женщин, средний возраст 65 [60; 69] лет), им операцию выполняли на работающем сердце. 80 пациентов были оперированы с применением аппарата искусственного кровообращения (АИК) – из них 51 (30 мужчин, 21 женщина, средний возраст 65 [57; 70] лет) вошел в группу «Искусственное кровообращение», остальным 29 пациентам (18 мужчин, 11 женщин, средний возраст 64 [58; 66] года) был в дополнение к стандартной терапии назначен пептид «Семакс» 1%-ный (интраназально по 3 капли в каждую ноздрю, 3 раза в день до операции в течение 2–3 дней, после операции в течение 7 дней) с целью нейропротекции, они вошли в группу «Нейропротекция».
Всем пациентам с целью комплексной оценки состояния головного мозга выполняли обследование за 2–3 дня до операции для определения базового уровня и на 5–6-й день после оперативного вмешательства. Нейропсихологическое тестирование включало в себя тесты MMSE, MoCA, запоминания пяти слов, рисования часов, пробу Шульте. Нейровизуализационное обследование состояло из нативного сканирования (режимы Т1, FLAIR, Т2, DWI) и функциональной МРТ (фМРТ) в покое, проводилось на томографе с силой индукции магнитного поля 3 Тл.
Статистическую обработку данных проводили с использованием программ IBM SPSS Statistics V.22 (SPSS Inc, Chicago, Illinois), результатов нейровизуализации – FreeSurfer и CONN v.18 (Functional connectivity toolbox). Вывод о наличии ПОКД формировали при выявлении снижения показателей в двух и более тестах не менее чем на 10% от дооперационного уровня. Различия считали статистически значимыми при р<0,05.
Результаты исследования и их обсуждение
Данные о распространенности типов ПЭ представлены в таблице 1.
Таблица 1
Клинические типы постгипоксической энцефалопатии у пациентов, перенесших АКШ
|
Показатель |
«Работающее сердце» (28 пациентов) |
«Искусственное кровообращение» (51 пациент) |
«Нейропротекция» (29 пациентов) |
Значимость различий |
|
Инсульт |
0 |
12 (24%) |
5 (17%) |
р1,2=0,012 р1,3=0,039 |
|
ПОКД |
2 (7%) |
19 (37%) |
3 (10%) |
р1,2=0,008 р1,3>0,05 |
|
Делирий |
0 |
1 (2%) |
0 |
|
Примечание. р1,2 – сравнения групп «Работающее сердце» и «Искусственное кровообращение»;
р1,3 – сравнения групп «Работающее сердце» и «Нейропротекция».
Так, ПЭ была диагностирована у 46 пациентов исследования (43%) – у 2 (7%) из группы «Работающее сердце», у 32 (63%) из группы «Искусственное кровообращение», у 8 (27%) из группы «Нейропротекция».
Наиболее выраженные изменения нейропсихологических тестов были обнаружены у пациентов группы «Искусственное кровообращение». Заметны отклонения в тестах МоСА, рисования часов и запоминания пяти слов, в пробе Шульте, особенно при работе с второй, третьей, пятой таблицами (р<0,05). Можно сделать вывод о том, что у пациентов, перенесших АКШ с использованием АИК, определяется декомпенсация когнитивных процессов в доменах отсроченного воспроизведения и памяти, целенаправленной исполнительной функции и зрительно-пространственного ориентирования, поддержания внимания и работоспособности на постоянном уровне.
Диагноз инсульта во всех случаях был подтвержден выявлением на МРТ сканах в режиме DWI очагов свежей ишемии. Распространенность инсульта у пациентов группы «Нейропротекция» оказалась ниже, чем у пациентов группы «Искусственное кровообращение». Делирий был диагностирован у одного пациента, характеризовался гиперреактивным типом и сопутствовал развитию инсульта.
Таким образом, наименьшая частота церебральных осложнений оказалась у пациентов группы «Работающее сердце», наибольшая – в группе «Искусственное кровообращение». Особенностью ПЭ у пациентов группы «Нейропротекция» стал относительно низкий уровень инсульта (по сравнению с группой «Искусственное кровообращение» – 17% против 24%), редкость ПОКД (10%), причем ее уровень был сопоставим с аналогичным показателем пациентов группы «Работающее сердце» (р1,3>0,05). Известно, что оперативное вмешательство с использованием АИК сопряжено с неблагоприятно действующими факторами, представленными гипоперфузией, микроэмболией, непульсирующим характером мозгового кровотока, реперфузией, активацией системного воспалительного ответа [7]. Полученные же результаты позволяют сделать вывод о возможном нейропротекторном эффекте пептида «Семакс», влияние которого позволило повысить устойчивость нейронов головного мозга к дестабилизирующим воздействиям.
Результаты нашего исследования, выявившие высокий уровень осложнений со стороны центральной нервной системы у пациентов, перенесших АКШ, находят подтверждение в сведениях, которые получают и другие авторы. Так, по некоторым данным, уровень ПОКД достигает 35–80% [8], отличается большей распространенностью именно у оперированных с применением АИК в сравнении с применением техники на работающем сердце, как и показатели инсульта раннего послеоперационного периода. Авторы видят опасность послеоперационных осложнений в том, что они способствуют ухудшению бытовой адаптации пациентов, ускоренному когнитивному снижению и, соответственно, снижению качества жизни [9].
Нейровизуализационное обследование пациентов до операции выявило у большинства (84%) пациентов мелкие округлые очаги глиоза, вероятнее всего сосудистого генеза. Они располагались как субкортикально, так и перивентрикулярно в рамках лейкоареоза. В группе «Работающее сердце» структурных изменений вещества головного мозга после операции обнаружено не было, а в других группах они отличались разнообразием характеристик. Так, в группе «Искусственное кровообращение» из 12 инсультов (размеры очагов от 4 до 15 мм) 8 получили развитие в вертебрально-базилярном бассейне, 4 – в каротидном, причем только 7 из них всех сопровождались грубыми признаками неврологического снижения. Остальные же 5 характеризовались по сравнению с обследованием до операции большей выраженностью симптомов орального автоматизма, негрубым усилением пирамидной или мозжечковой недостаточности. Аналогичные сведения о несоответствии свойств очагов ишемии и клинических синдромов позволяют авторам других исследований называть подобные находки «немые очаги». Чаще всего такие инсульты являются ишемическими, а их лидирующей этиологической причиной при кардиохирургических вмешательствах считают микроэмболию [10]. Несмотря на умеренную степень выраженности неврологических симптомов, сопутствующих «немым» очагам, значение их выявления все же велико – оно может быть неблагоприятным прогностическим признаком и ассоциироваться с возрастанием темпа когнитивного снижения в будущем [11].
У пациентов группы «Нейропротекция» из 5 инсультов (очаги до 9 мм в диаметре) один располагался в каротидном бассейне, а остальные 4 – в вертебрально-базилярном бассейне, они же оказались «немыми». Таким образом, в данной группе частота и тяжесть инсульта были ниже, чем в группе «Искусственное кровообращение».
При сравнении данных фМРТ в покое первой (предоперационной) временной точки всех пациентов исследования с группой «Норма» наиболее значимые изменения наблюдали в усилении активности отрицательных функциональных связей медиальной префронтальной коры (МПФК) с супрамаргинальной извилиной, с островковой корой, в ослаблении активности положительных функциональных связей с фронтальной медиальной корой (p<0,05), а также в усилении положительных функциональных связей МПФК с подмозолистой корой, гиппокампом, передней и задней парагиппокампальными извилинами (p<0,05) (рис. 1). Выявленные моменты могут свидетельствовать о наличии определенного «фона» в рабочей сети головного мозга по умолчанию как вероятного предрасполагающего фактора к формированию функциональных когнитивных нарушений.
При сравнении второй и первой временных точек группы пациентов «Работающее сердце» установили нерезкие изменения – усиление отрицательной функциональной связи МПФК с латеральной сенсорно-двигательной областью (p<0,05) (рис. 2). Эта область имеет эфферентные связи с мозжечком и базальными ганглиями, отвечает за формирование плана и последовательности действий для обеспечения сложных действий, кинетического праксиса. Скорее всего данное изменение является отражением неспецифического изменения обработки сенсомоторных стимулов в сравнении с дооперационным уровнем. Нейропсихологическое тестирование у пациентов данной группы также не выявило грубых изменений, ПОКД определили всего у 7% больных.
Наиболее выраженные изменения как по данным нейропсихологического тестирования, так и по данным группового анализа данных фМРТ выявили в группе пациентов «Искусственное кровообращение» (рис. 3). Так, установили ослабление положительных функциональных связей МПФК с задним отделом поясной извилины. Эти две области являются основными элементами рабочей сети пассивного режима работы головного мозга (СПРРГМ). Действительно, по данным исследователей, при поражении задней поясной извилины наблюдаются трудности при выполнении заданий, требующих выраженного когнитивного контроля [12].
При сравнении данных фМРТ в покое в группе «Нейропротекция» (рис. 4) между второй и первой временными точками определили, во-первых, ослабление положительной функциональной связи МПФК с задним отделом поясной извилины, менее выраженное, чем в группе «Искусственное кровообращение», что может свидетельствовать о нейропротекторном действии пептида. Во-вторых, выявили усиление положительной функциональной связи с правым миндалевидным телом, что говорит о позитивном компенсаторном механизме активации образования, обеспечивающего координацию взаимного влияния эмоций и автоматических реакций
Результаты статистического анализ, графическое представление, здесь и далее: нанесенные на карты схематические представления ослабления и усиления функциональных связей, совмещение с анатомическим атласом головного мозга
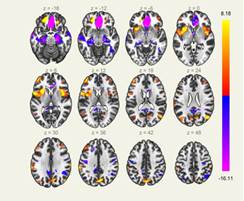
Рис. 1. Сравнение данных фМРТ в покое обеих групп пациентов в первой временной точке по отношению к группе «Норма»
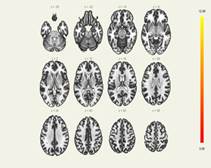
Рис. 2. Сравнение данных фМРТ в покое в группе «Работающее сердце» между второй и первой временными точками
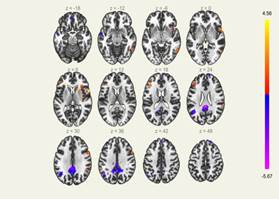
Рис. 3. Сравнение данных фМРТ в покое в группе «Искусственное кровообращение» между второй и первой временными точками
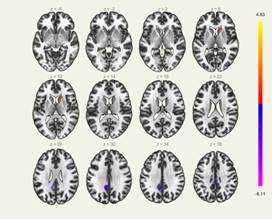
Рис. 4. Сравнение данных фМРТ в покое в группе «Нейропротекция» между второй и первой временными точками
Заключение
Настоящее исследование выявило, что различные клинические типы ПЭ достаточно высоко распространены у пациентов, получивших АКШ. Они характеризуются разнообразием и большей тяжестью в случаях проведения вмешательства с применением АИК в сравнении с техникой на работающем сердце, свидетельствуя о большем дестабилизирующем действии на нейроны головного мозга. Применение пептида «Семакс» в периоперационном периоде сопровождается снижением частоты и тяжести ПЭ, не было сопряжено с нежелательными явлениями и хорошо переносилось пациентами, что позволяет сделать вывод о безопасности и возможности профилактического действия для снижения риска повреждения центральной нервной системы при АКШ. ФМРТ, продемонстрировавшая корреляцию нейровизуализационных результатов с выводами нейропсихологических тестов, – эффективная методика для определения состояния функционального состояния головного мозга, способна выявить ослабление или усиление связей между зонами, ответственными за ключевые механизмы, необходимые для поддержания когнитивных функций.
Библиографическая ссылка
Портик О.А., Царевская Ю.Н., Ефимцев А.Ю., Труфанов Г.Е., Топузова М.П., Алексеева Т.М. ПОСТГИПОКСИЧЕСКАЯ ЭНЦЕФАЛОПАТИЯ У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ: КЛИНИКО-НЕЙРОПСИХОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ, КОННЕКТОМ И ВОЗМОЖНОСТИ НЕЙРОПРОТЕКЦИИ // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29744 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/spno.29744



