Железодефицитная анемия в России регистрируется у 6–40% детского населения [1]. Железо является эссенциальным микроэлементом и, помимо эритропоэза, участвует в синтезе ДНК и нейротрансмиттеров, врожденном иммунном ответе. Поэтому железодефицитная анемия (ЖДА), как крайняя форма дефицита железа (ДЖ), ассоциирована со сниженной толерантностью к физическим нагрузкам, сниженной резистентностью [2]. Кроме того, ЖДА связывают с более низким весом и ростом детей разной степени статистической достоверности [3]. Гетерогенность литературных данных, а также отсутствие понимания того, какая именно степень тяжести ДЖ и/или продолжительность его существования оказывает негативный эффект на организм ребенка, определили цель нашего исследования.
Цель исследования – определить влияние ДЖ в антенатальном периоде и на первом году жизни на физическое развитие детей.
Материалы и методы исследования
Данная статья представляет часть исследования дефицита железа и ЖДА у детей на первом году жизни. Дизайн исследования – проспективное наблюдательное когортное исследование с ретроспективным анализом течения беременности и родов (по данным формы 113/у), включавшее детей, начиная с момента прикрепления к поликлинике (не позднее 14-го дня жизни) до 1 года. Исследование проведено в 2016-2018 гг. в детских поликлинических отделениях Самарского региона (11 детских поликлинических отделений г. Самары и 3 поликлинических отделения г. Тольятти).
Отбор детей для участия в исследовании проводили методом сплошной выборки. Критерии включения: доношенные дети I и II группы здоровья, установленной на первом патронаже по результатам опроса родителей и физикального обследования участковым педиатром; письменное информированное добровольное согласие родителей или законных представителей на участие в исследовании.
Критерии исключения: перинатальный контакт по ВИЧ-инфекции и/или вирусным гепатитам (по данным обменной карты, форма 113/у); прикрепление к детской поликлинике, участвующей в исследовании, позднее 14 сут. жизни.
Данные о длине тела и массе тела при рождении получены из формы 113/у. Осмотр и антропометрия детей производились ежемесячно.
Исследование лабораторных показателей, отражающих статус железа в организме, проводилось детям в возрасте 6 мес. (1 этап) и 12 мес. (2 этап) жизни. Общий анализ крови (ОАК) проводили на автоматическом гематологическим анализаторе Sysmex XT-2000i (Sysmex, Япония). В сыворотке крови на автоматическом биохимическом анализаторе Integra 400 plus (Roche, Швейцария) определяли сывороточный ферритин (СФ) методом иммуноферментного анализа для оценки запасов железа и уровень С-реактивного белка (СРБ), повышение которого при сопутствующем воспалении сопряжено с высокими значениями СФ, что может маскировать снижение запасов железа в депо.
Анемией считали снижение концентрации Hb <110 г/л [2], дефицит железа диагностировали при снижении СФ <30 нг/мл [4]. ЖДА верифицировали при сочетании низкой концентрации Hb (<110 г/л) и СФ (<30 нг/мл). При снижении концентрации Hb и нормальной концентрации СФ (Hb<110 г/л и СФ >30 нг/мл) устанавливался диагноз анемии без дефицита железа.
Всего в исследование включено 449 детей. По различным причинам (переезд, отказ от участия в процессе исследования, невозможность проведения клинического анализа крови или биохимического анализа крови – образование сгустка, забор недостаточного для исследования объема крови) первые 6 месяцев исследования завершили 306 детей, а исследование в полном объеме – 234 ребенка. Дополнительно из анализа исключено 23 ребенка, у которых в 6 месяцев в соответствии с вышеописанными критериями обнаружена анемия без дефицита железа. Всего в окончательный анализ вошло 211 детей. Основные характеристики детей представлены в таблице.
В зависимости от времени возникновения ДЖ, дети независимо распределены на группы: гестационная анемия, ДЖ в 6 мес. и ДЖ в 12 мес. Численный состав групп сравнения и распределение по полу представлены в таблице 1.
Таблица 1
Численный и половой состав групп сравнения
|
Группы сравнения |
Мальчики, n=118 (%) |
Девочки, n=93 (%) |
Всего |
|
Гестационная анемия «+» |
43(%) |
40 (%) |
83 |
|
Гестационная анемия «-» |
75 (%) |
53(%) |
128 |
|
ДЖ в 6 мес. «+» |
50(%) |
46(%) |
96 |
|
ДЖ в 6 мес. «-» |
68(%) |
47(%) |
115 |
|
ДЖ в 12 мес. «+» |
79(%) |
63(%) |
142 |
|
ДЖ в 12 мес. «-» |
39(%) |
30(%) |
69 |
Размер выборки предварительно не рассчитывался. В исследование включались все дети, соответствующие вышеописанным критериям. Анализ результатов исследования, построение таблиц и диаграмм проводили на персональном компьютере с использованием программ Microsoft Excel, Statistica10.0 и SPSS 16.0. Полученные данные обрабатывали с применением методов статистики, использующих элементы основного вариационного и многофакторного анализа с достоверностью 95%. Проверку соответствия статистического распределения нормальному проводили с помощью критерия Пирсона χ-квадрат. Для множественного сравнения средних значений числовых данных применяли непараметрический аналог ANOVA – критерий Краскела-Уоллиса. Для оценки различий между двумя независимыми выборками (несвязанные группы) по признаку, измеренному в количественной шкале и имеющему отличное от нормального распределение, использовали непараметрический критерий Манна-Уитни.
Результаты исследования и их обсуждение
Из 211 детей рождены от беременности, осложненной гестационной анемией, 83 ребенка (мальчики - (43) 51,8%). Необходимо отметить, что практически все случаи анемии во время беременности были легкой степени (3 наблюдения – 3,6% – средней степени тяжести) и во всех случаях проведена терапия анемии. На рис. 1 представлена зависимость массы тела от наличия и сроков возникновения дефицита железа.
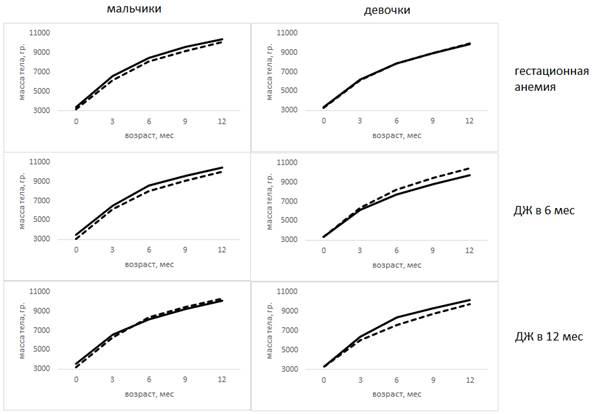
Рис. 1. Зависимость массы тела детей от наличия и сроков возникновения дефицита железа
Примечание: здесь и далее пунктирной линией обозначены значения группы с дефицитом железа, сплошной линией – с его отсутствием.
Так, у девочек масса тела как при рождении, так и на первом году практически не отличалась (p>0,05) во все возрастные периоды. У мальчиков гестационная анемия привела к достоверно более низкой массе тела при рождении (р=0,047) и в 3 месяца (р=0,028). После 3 месяцев масса тела мальчиков в группе гестационной анемии оставалась ниже, чем в группе без анемии, однако различия статистически не значимы (p>0,05). Таким образом, гестационная анемия после терапии оказывает ограниченное влияние на массу тела детей.
Традиционно анемию беременных считают важной причиной рождения недоношенных и маловесных детей, однако некоторые исследования показывают связь гестационной анемии только с преждевременными родами, но не с низкой массой тела при рождении [5]. По данным А.В. Козловской, масса тела у детей, рожденных от женщин с анемией во время беременности, была выше [6]. Данные, полученные в нашем исследовании, вероятно, можно объяснить проведенной терапией. Анемия во время беременности оказывает влияние на риск рождения маловесного ребенка, но ее терапия позволяет в значительной степени нивелировать негативные эффекты.
ДЖ в 6 месяцев обнаружен у 45,5% (96) детей (мальчики – (50) 52,1%), при этом у 37 (38,5%) из них установлена ЖДА, у остальных детей – латентный ДЖ.
Для мальчиков более низкая масса при рождении является фактором риска ДЖ в 6 месяцев: в группе ДЖ средняя масса при рождении 3026,8±619,6 грамма, тогда как в группе здоровых – 3496,8±470,9 грамма (р<0,001). Начиная с 6 месяцев жизни и до 12 месяцев масса тела мальчиков остается достоверно ниже, чем у здоровых сверстников (p<0,05). У девочек выявлено прямо противоположное влияние ДЖ в 6 месяцев. При рождении масса тела девочек групп сравнения не отличалась, но начиная с 3 месяцев масса тела у девочек в группе ДЖ выше, чем в группе здоровых, причем разница прогрессивно нарастает (табл. 2).
Таблица 2
Масса тела девочек на первом году жизни в зависимости от ДЖ в 6 месяцев
|
Группы сравнения |
Масса тела, М±σ |
|||||||||
|
При рождении |
р |
3 месяца |
р |
6 месяцев |
р |
9 месяцев |
р |
12 месяцев |
р |
|
|
ДЖ в 6 месяцев «+» |
3340,0 ±537,7 |
0,828 |
6334,0 ±1020,3 |
0,259 |
8248,3 ±1425,0 |
0,038 |
9428,3 ±1050,9 |
0,002 |
10426,7 ±1032,2 |
0,003 |
|
ДЖ в 6 месяцев «-» |
3316,7 ±487,8 |
6128,7 ±682,8 |
7741,9 ±784,1 |
8775,0 ±928,2 |
9719,2 ±1232,1 |
|||||
Примечание: различия считались значимыми при р <0,05.
Полученные данные интересны с точки зрения отождествления ожирения с вариантом хронического воспаления и его опосредованного влияния на всасывание железа через повышение уровня гепсидина. В ряде работ отмечается взаимосвязь между ожирением у матери во время беременности (ИМТ ≥35 кг/м2) или прибавкой веса во время беременности, превышающей 18 кг, с низким содержанием железа в пуповинной крови; появились работы, указывающие на ожирение матери и избыточный набор веса плодом в качестве факторов риска ЖДА [7]. Кроме того, ДЖ и ожирение могут развиваться в результате одних и тех же пищевых привычек: длительное питание из бутылочки, потребление большого количества неполноценных продуктов, бедных железом, и перекусы [8; 9], что особенно важно в условиях роста числа детей с ожирением в школьном возрасте [10]. По результатам исследования Brotanek J.M. et al. (1641 ребенок в возрасте 1-3 лет), частота дефицита железа у детей с нормальным весом составила 7%, у детей с риском ожирения – 8%, а у детей с ожирением – уже 20%. Из всех исследованных факторов риска развития дефицита железа именно в отношении ожирения удалось выявить наиболее сильную зависимость [8].
ДЖ в 12 месяцев установлен у 142 детей (67,3%), из них мальчики – 79 (55,6%). ЖДА обнаружена у 41 ребенка (28,9%).
Для мальчиков, реализовавших в 12 месяцев ДЖ, так же как и для мальчиков с ДЖ в 6 месяцев, характерна более низкая масса тела при рождении, чем у здоровых (р<0,001). В дальнейшем достоверной разницы в массе тела не обнаружено.
Масса тела девочек с ДЖ в 12 месяцев начиная с 3 месяцев была ниже, чем у здоровых, различия достоверны в течение практически всего первого года жизни: в 3 месяца р=0,013, в 6 месяцев р<0,001, в 9 месяцев р=0,002 и в 12 месяцев р=0,064.
В отношении длины тела получено меньше различий (рис. 2).
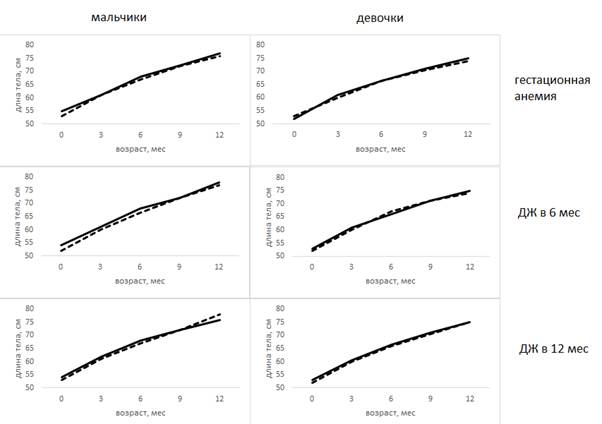
Рис. 2. Зависимость длины тела детей (Ме) от наличия и сроков возникновения дефицита железа
Длина тела девочек при рождении и на первом году жизни не отличалась независимо от наличия ДЖ и времени его возникновения (р>0,05).
У мальчиков ДЖ преимущественно ассоциирован с меньшей длиной тела при рождении и, вероятно, с одной стороны, ДЖ является причиной снижения длины тела при рождении, а с другой - меньшая длина тела при рождении является фактором риска ДЖ на первом году жизни (табл. 3).
Таблица 3
Длина тела мальчиков при рождении в зависимости от сроков возникновения ДЖ
|
Группы сравнения |
Длина тела, см, Мe (Q1; Q3) |
р |
|
Гестационная анемия «+» |
53 (52; 54) |
0,011 |
|
Гестационная анемия «-» |
55 (51; 56) |
|
|
ДЖ в 6 месяцев «+» |
52 (50; 54) |
<0,001 |
|
ДЖ в 6 месяцев «-» |
54 (53; 56) |
|
|
ДЖ в 12 месяцев «+» |
53 (50; 55) |
0,006 |
|
ДЖ в 12 месяцев «-» |
54 (52; 56) |
Примечание: в таблице длина тела указана в виде медианы (25; 75-й процентили).
Влияние пролеченной гестационной анемии на длину тела мальчиков ограничивается ранним неонатальным периодом – начиная с 3 месяцев жизни, длина тела не отличается вне зависимости от наличия анемии у матери во время беременности (р>0,05).
Более низкая длина тела в 3 месяца для мальчиков является фактором риска ДЖ в 6 и 12 месяцев. Среди мальчиков, реализовавших ДЖ в 6 месяцев, средняя длина тела в 3 месяца составила 60 (58; 62) см против 61 (60,5; 63) см в группе здоровых в 6 месяцев (р=0,007). Длина тела в 3 месяца мальчиков, реализовавших ДЖ в 12 месяцев, и здоровых - 61 (59,5; 62) см и 62 (59; 64) см соответственно (р=0,021).
Имеющиеся литературные данные в отношении влияния ДЖ на антропометрические показатели детей крайне противоречивы. В исследовании Soliman A.T. et al. у 40 детей (средний возраст 17,2±7,4 месяца) с подтвержденной ЖДА (средний Hb 82±12 г/л) отмечался более низкий рост и скорость роста, чем у здоровых ровесников [11]. После терапии в течение 3 месяцев и коррекции анемии отмечался значимый рост темпов роста. С другой стороны, некоторые исследования не обнаружили эффекта от применения препаратов железа на линейный рост детей [12], а в исследовании Dewey K.G. et al. скорость роста детей без дефицита железа на фоне сапплементации железа была даже ниже, чем в группе плацебо [13]. Одно из возможных объяснений заключается в отсроченном эффекте дефицита железа на линейный рост. Например, по данным Gahagan S. et al., здоровые дети, получавшие железо в возрасте 12-18 месяцев, в 10 лет были выше своих ровесников, которые не получали дополнительного железа [14]. В то же время исследование Perng W. et al., в которое включено 2714 школьников Боготы, средний возраст на момент включения 8,8±1,8 года, показало противоположные результаты. Средний срок наблюдения пациентов составил 2,5 года. За это время рост и ИМТ мальчиков, находившихся в верхнем квартиле по уровню ферритина на момент начала исследования, увеличились значимо меньше, чем у мальчиков 1 квартиля по ферритину. Для девочек ассоциация между показателями запасов железа и красной крови и ростом не обнаружена [15].
Заключение
В нашем исследовании обнаружено, что гестационная анемия после терапии не оказывает влияния на антропометрические показатели девочек, а ее влияние на массу и длину тела мальчиков ограничивается первыми тремя месяцами жизни. Для мальчиков основным фактором риска ДЖ как в первом, так и во втором полугодии жизни является низкая масса и длина тела при рождении и в первые 3 месяца жизни. Для девочек фактором риска ДЖ в первом полугодии является быстрый темп прибавки массы тела. Негативное влияние ДЖ в первом полугодии на росто-весовые показатели обнаружено только у мальчиков. Выявленные особенности обуславливают необходимость дифференцированной профилактики ДЖ у детей, родившихся с низкой массой тела, а также с высокой скоростью прибавки массы тела.
Библиографическая ссылка
Балашова Е.А. ДЕФИЦИТ ЖЕЛЕЗА И ФИЗИЧЕСКОЕ РАЗВИТИЕ НА ПЕРВОМ ГОДУ ЖИЗНИ // Современные проблемы науки и образования. 2020. № 2. ;URL: https://science-education.ru/ru/article/view?id=29578 (дата обращения: 30.01.2026).
DOI: https://doi.org/10.17513/spno.29578



