Потеря кардиомиоцитов в результате их гибели от разных причин может обусловливать развитие сердечной недостаточности, а при массивных поражениях – быть ведущей причиной смерти. К наиболее распространенным факторам, которые вызывают гибель кардиомиоцитов и необратимые повреждения мышцы сердца, относятся ишемия/реперфузия миокарда, вызываемая атеросклеротическими повреждениями коронарных артерий, и кардиотоксические агенты, среди которых прежде всего следует отметить химиотерапевтические препараты, характеризующиеся выраженным дозозависимым эффектом. В ряде проведенных ранее клинических и экспериментальных исследований показано, что наиболее выраженным кардиотоксическим эффектом обладают антрациклиновые антибиотики, особенно доксорубицин [1–3].
Особо актуальной проблема доксорубицин-индуцированной кардиотоксичности в ближайшие десятилетия может быть для детей, переживших онкологические заболевания. Поскольку показатели 5-летней выживаемости для всех видов рака у детей продолжают расти, то неуклонно будет увеличиваться популяция пациентов с повышенным риском развития отдаленной сердечно-сосудистой патологии [4]. Доксорубицин воздействует на развивающееся сердце не так, как на взрослое сердце, и у некоторых пациентов, подвергшихся его воздействию, возможно развитие в более поздние сроки необратимой кардиомиопатии. Предполагается, что к 2020 г. число выживших детей после перенесенных онкологических заболеваний достигнет 500 000, и более 50 000 из них будут страдать от кардиомиопатий, индуцированных доксорубицином [5].
Изменение численности кардиомиоцитов в сердце млекопитающих в процессе онтогенеза и при действии на организм патогенных факторов, а именно возможность увеличения числа кардиомиоцитов в результате митотического деления в сердце взрослых особей, широко обсуждается в литературе в последние десятилетия, поскольку этот вопрос непосредственно связан с возможностью замещения утраченной в результате гибели части кардиомиоцитов вновь образованной популяцией паренхиматозных клеток, т.е. с регенеративными технологиями. В настоящее время преобладает парадигма, согласно которой активная пролиферация кардиомиоцитов, которая обеспечивает рост сердца и регенерацию миокарда за счет деления предсуществующих клеток, может манифестировать в ранний постнатальный период (до 2 недель у мелких грызунов) [6–8]. За счет пролиферации (которая может происходить в два этапа) предсуществующих кардиомиоцитов их количество в сердце в этот период может увеличиться на 40% [9]. В более поздние периоды онтогенеза пролиферативная активность кардиомиоцитов существенно замедляется и регистрируется на уровне менее 1% в год [10]. Аналогичные данные о скорости обновления кардиомиоцитов в сердце человека в постнатальный период были получены на основании детекции 14С в молекулах ДНК. Согласно этим результатам скорость обновления кардиомиоцитов снижается от 1% в год у индивидов в возрасте 25 лет до 0,45% – в возрасте 75 лет, т.е. в течение нормальной продолжительности жизни могут обновляться около 50% кардиомиоцитов [11, 12].
Приведенные данные об обновлении популяции кардиомиоцитов в сердце млекопитающих в разные периоды онтогенеза имеют принципиальное значение для разрешения вопроса о возможной стимуляции пролиферативной активности кардиомиоцитов при разных патологических состояниях и разработки новых подходов в регенеративной медицине. В этом аспекте большое значение имеет оценка возможного влияния на пролиферативную активность кардиомиоцитов широко используемых лекарственных препаратов, в частности статинов, для установления их возможных стимулирующих или ингибирующих эффектов в отношении пролиферации клеток.
Цель работы – проанализировать изменения общей численности кардиомиоцитов в сердце экспериментальных животных при изолированном и сочетанном воздействии доксорубицина и аторвастатина.
Материал и методы исследования
В опытах использовали крыс-самок породы Вистар (n=30), которых содержали в стандартных условиях вивария на полноценном рационе, вода ad libitum. Эксперименты проводили с соблюдением всех правил и рекомендаций «Европейской конвенции о защите прав позвоночных, используемых экспериментов или в иных научных целях» от 18.03.1986 г. Животные были разделены на 4 группы. 1-я группа (n=9) – однократное внутрибрюшинное введение доксорубицина в дозе 15 мг/кг в растворе 0,9% NaCl (Фармахеми Б.В., Нидерланды); 2-я группа (n=6) – ежедневное внутрижелудочное введение аторвастатина («Северная звезда», Россия) в дозе 20 мг/кг; 3-я группа (n=9) – однократное внутрибрюшинное введение доксорубицина в дозе 15 мг/кг в растворе 0,9% NaCl и ежедневное внутрижелудочное введение аторвастатина в дозе 20 мг/кг. Аторвастатин животным 2-й и 3-й групп начинали вводить за 4 суток до инъекций доксорубицина (крысы 2-й группы получали однократное внутрибрюшинное введение физиологического раствора одновременно с введением ДОК животным 1-й и 3-й групп). Крысы 4-й группы (n=6) были контрольными, они получали однократное внутрибрюшинное введение физиологического раствора, а затем ежедневно внутрижелудочно – воду в эквивалентном объеме одновременно с экспериментальными животными. Животных выводили из эксперимента декапитацией через 3 и 7 суток после введения доксорубицина (соответственно через 7 и 14 суток потребления аторвастатина).
Для оценки морфологических изменений образцы миокарда фиксировали в 10%-ном нейтральном формалине, проводку осуществляли в гистологическом автомате STP-120. Парафиновые срезы окрашивали гематоксилином и эозином, по Ван Гизону, ставили PAS-реакцию. Для получения полутонких срезов образцы миокарда фиксировали в 4%-ном параформальдегиде, постфиксировали в четырехокиси осмия и после дегидратации заливали в смесь эпона и аралдита. Полутонкие срезы получали на ультратоме LKB III, окрашивали азуром II и исследовали в универсальном исследовательском микроскопе Leica DM 4000B.
Абсолютную численность кардиомиоцитов сердца определяли, используя метод щелочной диссоциации предварительно фиксированной ткани. Сердце взвешивали до фиксации и после нее. Материал фиксировали в 10%-ном формалине на 0,1М фосфатном буфере в течение 10 суток. После фиксации из стенок желудочков вырезали пластинку ткани толщиной около 1 мм, из которой брали навеску 10–20 мг. Взвешивание производили на торсионных весах, предварительно осушив кусочек фильтровальной бумагой. Навеску пинцетом погружали в пробирку с 4 мл 40%-ного КОН на 20–21 ч при температуре 18–20° С. Затем щелочь сливали, кусочек промывали в трех сменах холодной дистиллированной воды по 8–10 мл каждая.
После промывки в пробирку наливали 10 мл дистиллированной воды, в которой кусочек набухал в течение 1 суток при комнатной температуре. Затем лишнюю воду сливали, пробирку энергично встряхивали до полного распада кусочка на отдельные клетки. Полученную суспензию окрашивали азур-эозином по Романовскому. Окрашивание суспензии завершали через 30 мин, после чего ее разводили дистиллированной водой до концентрации 5 мг/л. Подсчет клеток проводили в камере Горяева. Для каждого животного брали по 3 навески, для каждой навески проводили подсчет в 10 повторах.
Статистическая обработка данных включала нахождение среднего значения, ошибки среднего и оценку межгрупповых различий по критерию Стьюдента. Значимыми считали различия при p<0,05.
Результаты исследования и их обсуждение
После однократного введения доксорубина пало 2 животных, а после сочетанного применения доксорубицина и аторвастатина – 1 животное. Введение доксорубицина (в дозе 15 мг/кг) обусловливало достоверное снижение массы тела крыс (на 33,6%, p<0,001) через 7 суток эксперимента (табл.). Потребление аторвастатина существенно не влияло на массу тела животных во все сроки эксперимента, в то время как при сочетанном воздействии доксорубицина и аторвастатина выявлено достоверное снижение массы тела крыс как через 3 суток, так и через 7 суток (соответственно на 16,9% и 27,8%, p<0,001). Подобным образом изменялась и масса сердца: через 3 суток после введения доксорубицина этот показатель был уменьшен на 15% (p<0,05), через 7 суток – на 27,8% (p<0,001); после потребления аторвастатина масса сердца существенно не менялась, а после сочетанного воздействия обоих препаратов этот показатель был достоверно уменьшен (на 24%, p<0,01). Гибель животных, снижение массы тела и сердца при действии доксорубицина отражают его выраженные общетоксические и кардиотоксические свойства, которые относят к серьезным побочным эффектам противоопухолевой терапии с использованием данного препарата и других антрациклиновых антибиотиков [3].
При микроскопическом исследовании в миокарде животных через 3 суток после однократного введения доксорубицина манифестировали гемодинамические нарушения в виде венозного и капиллярного полнокровия. В части кардиомиоцитов выявлялись повреждения (диффузный лизис саркоплазмы, околоядерные «опустошения», вакуолизация саркоплазмы), характерные для действия антрациклиновых антибиотиков (рис. 1, а). Через 7 суток эксперимента в миокарде сохранялись все выявленные ранее изменения. Дополнительно следует отметить усиление вакуолизации отдельных кардиомиоцитов и появление мелкокапельной липидной инфильтрации в некоторых сердечных миоцитах (рис. 1, б).
а 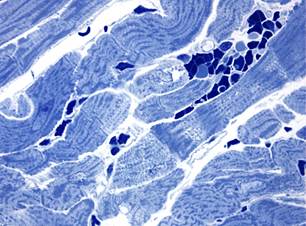 б
б 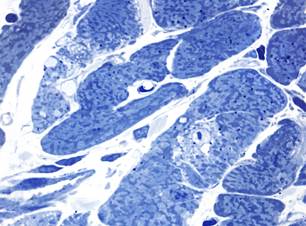
Рис. 1. Миокард крыс после введения доксорубицина. Полутонкие срезы.
Окраска азуром II. х1000, а – появление околоядерной «опустошенности» в кардиомиоцитах и сладж эритроцитов в капиллярах через 3 суток; б – вакуолизация саркоплазмы кардиомиоцитов через 7 суток
В миокарде животных с введением только аторвастатина через 7 суток встречались единичные кардиомиоциты с литическими изменениями или околоядерными «опустошениями» саркоплазмы. При этом манифестировала значительная мелкокапельная липидная инфильтрация кардиомиоцитов (рис. 2, а). Гемодинамические расстройства (преимущественно в виде неравномерного полнокровия капилляров) регистрировались редко. Через 14 суток после потребления аторвастатина сохранялись незначительные литические повреждения отдельных кардиомиоцитов, в некоторых клетках отмечалась значительная вакуолизация околоядерного пространства.
а 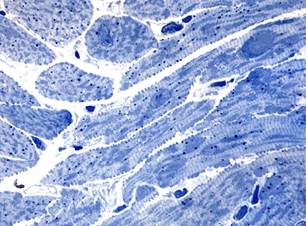 б
б 
Рис. 2. Миокард крыс после потребления аторвастатина. Полутонкие срезы.
Окраска азуром II, а – диффузная мелкокапельная липидная инфильтрация кардиомиоцитов через 7 суток х400; б – вакуолизация околоядерного пространства в кардиомиоците через 14 суток х1000
В группе животных, подвергавшихся сочетанному воздействию доксорубицина и аторвастатина, характер морфологических изменений миокарда через 3 и 7 суток эксперимента был таким же, как и после изолированного воздействия доксорубицина (рис. 3). Повреждения кардиомиоцитов были обусловлены литическими изменениями саркоплазмы и миофибриллярных пучков, а также вакуолизацией и «опустошением» околоядерной зоны. При этом следует отметить, что гемодинамические нарушения были менее выраженными.
а 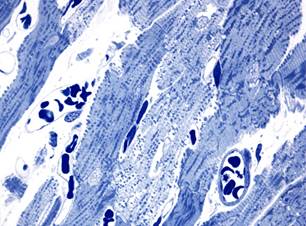 б
б 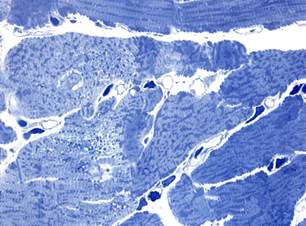
Рис. 3. Миокард крыс после сочетанного воздействия доксорубицина и аторвастатина. Полутонкие срезы. Окраска азуром II. х1000, а – кардиомиоциты с литическими изменениями через 3 суток; б – литические изменения и околоядерная вакуолизация саркоплазмы в кардиомиоцитах через 7 суток
Через 3 суток после введения доксорубицина выявлена тенденция к увеличению абсолютной численности кардиомиоцитов (на 18%) в сердце крыс относительно контроля, а через 7 суток – к снижению данного показателя ниже контрольного уровня (на 11%) (см. табл.). Через 3 суток эксперимента в миокарде животных этой группы достоверно уменьшилась (в 1,8 раза, p<0,05) по сравнению с контролем доля одноядерных кардиомиоцитов; через 7 суток этот показатель был снижен в 1,5 раза. При этом доля двуядерных кардиомиоцитов через 3 суток эксперимента достоверно увеличивалась (на 10%, p<0,05), через 7 суток сохранилась тенденция к увеличению этого показателя (на 9%) (табл.).
Количественный анализ популяции кардиомиоцитов в сердце крыс после введения доксорубицина и аторвастатина (М±m)
|
Показатель |
Контроль |
Введение доксорубицина |
Введение аторвастатина |
Введение доксорубицина и аторвастатина |
|||
|
3 суток |
7 суток |
3 суток |
7 суток |
3 суток |
7 суток |
||
|
Масса тела, г |
240,2±1,6 |
219,3±8,3 |
159,40±8,94*** |
253,3±18,2 |
239,7±9,9 |
199,5±4,4*** |
173,4±9,6*** |
|
Масса сердца, г |
0,79±0,02 |
0,67±0,03* |
0,57±0,01*** |
0,81±0,02 |
0,76±0,02 |
0,60±0,03** |
0,60±0,03** |
|
Относительная масса сердца, % |
0,33±0,01 |
0,30±0,002 |
0,36±0,02 |
0,26±0,01 |
0,32±0,02 |
0,30±0,01 |
0,35±0,04 |
|
Концентрация кардиомиоцитов в 1 мг ткани, х103 |
9,30±0,70 |
12,98±1,76 |
11,63±0,54* |
9,27±0,67 |
12,49±0,17** |
12,73±1,62 |
11,01±0,57 |
|
Абсолютная численность кардиомиоцитов в сердце, х106 |
7,37±0,58 |
8,70±1,33 |
6,54±0,21 |
7,40±0,18 |
9,50±0,39* |
7,69±1,07 |
6,22±0,31 |
|
Доля одноядерных кардиомиоцитов, % |
15,14±2,56 |
8,60±0,95* |
10,26±2,72 |
10,93±0,54 |
6,27±1,62* |
7,91±0,72* |
7,36±1,43* |
|
Доля двуядерных кардиомиоцитов, % |
78,92±2,78 |
87,04±1,14* |
86,11±2,37 |
84,25±1,24 |
90,98±2,42* |
87,45±0,71* |
88,94±1,99* |
|
Доля многоядерных кардиомиоцитов, % |
5,94±1,21 |
4,36±0,44 |
3,63±0,39 |
4,82±0,72 |
2,74±0,86 |
4,64±0,50 |
3,70±0,60 |
|
Примечание.* – p< 0,05, ** – p< 0,01, *** – p< 0,001 при сравнении с контролем. |
|||||||
Абсолютная численность кардиомиоцитов в сердце крыс через 7 суток после потребления аторвастатина существенно не изменялась по сравнению с контролем. Однако через 14 суток после эксперимента этот показатель превышал контрольный уровень на 28,9% (p<0,05). Доля одноядерных кардиомиоцитов в первый срок наблюдений уменьшилась на 28%, а к концу эксперимента – на 58,6% (p<0,05) и была наименьшей для всех групп животных (см. табл.). Одновременно происходило увеличение доли двуядерных кардиомиоцитов – соответственно на 6,7 и 15,3% (p<0,05) через 7 и 14 суток эксперимента. Следует отметить, что доля двуядерных кардиомиоцитов через 14 суток потребления аторвастатина была максимальной среди всех исследованных групп. В этот же срок выявлена наименьшая доля многоядерных кардиомиоцитов (снижение относительно контроля на 53,9%) (см. табл.).
При оценке абсолютной численности кардиомиоцитов в сердце после сочетанного воздействия доксорубицина и аторвастатина выявлена тенденция к увеличению этого показателя через 3 суток эксперимента (на 4%), но к 7-м суткам этот показатель был уменьшен на 16% относительно контроля, т.е. обнаружена та же динамика, что и при воздействии только доксорубицина. Доля одноядерных кардиомиоцитов была достоверно снижена в оба срока наблюдения соответственно на 58,6 и 47,8% (p<0,05); доля двуядерных кардиомиоцитов достоверно возрастала соответственно на 10,8 и 12,7% (p<0,05) через 3 и 7 суток эксперимента.
По данным проведенного исследования при изолированном и сочетанном с аторвастатином однократном введении доксорубицина первоначально прослеживается тенденция к увеличению общей численности кардиомиоцитов в сердце с последующим уменьшением (на 11–16%) этого показателя, что согласуется с полученными ранее данными [13]. При изолированном введении аторвастатина нами установлено достоверное увеличение (на 29%, p<0,05) численности кардиомиоцитов в сердце через 14 суток эксперимента. Динамика изменений доли одноядерных (снижение на 58,6%) и двуядерных (увеличение на 15%) кардиомиоцитов в этой группе позволяет полагать, что увеличение числа кардиомиоцитов в сердце может происходить за счет предсуществующей популяции одноядерных кардиомиоцитов, а именно вступления их в клеточный цикл с последующей редупликацией и кариокинезом без цитокинеза. Следует отметить, что при изолированном введении доксорубицина наиболее значительное снижение доли одноядерных кардиомиоцитов происходило через 3 суток эксперимента (43%), затем этот показатель проявлял тенденцию к восстановлению, в то время как при сочетанном воздействии обоих препаратов выявлено стойкое снижение доли одноядерных кардиомиоцитов (на 49–51%) в течение всего эксперимента. В этом отношении динамика изменений при сочетанном применении препаратов повторяла таковую при изолированном потреблении аторвастатина. Важно также отметить выявленную во всех группах тенденцию к снижению доли многоядерных (3 и более ядер) кардиомиоцитов в сердце, наиболее выраженную при изолированном потреблении аторвастатина, что может быть связано с отсроченным цитокинезом этих клеток.
Увеличение численности кардиомиоцитов в сердце взрослых млекопитающих после повреждающих воздействий или потребления некоторых лекарственных препаратов может быть объяснено их делением, причем не столько отсроченным цитокинезом двуядерных (доля которых, наоборот, возрастает) и многоядерных кардиомиоцитов, сколько вступлением в клеточный цикл предсуществующих кардиомиоцитов. Значительное снижение доли одноядерных кардиомиоцитов во всех экспериментальных группах может свидетельствовать о том, что эти клетки являются основным резервом для репопуляции миокарда после массовой гибели кардиомиоцитов. Вступление одноядерных кардиомиоцитов в клеточный цикл с последующей бинуклеацией является основной стратегией роста сердца мелких грызунов в раннем постнатальном периоде, а увеличение популяции двуядерных кардиомиоцитов до 80% свидетельствует о структурно-функциональном «созревании» миокарда [14]. Возможность вступления в клеточный цикл с последующим делением в разные периоды постнатального онтогенеза была показана и для кардиомиоцитов человека. При использовании антител к фосфорилированному гистону Н3 (маркеру М-фазы) и с помощью лазер-сканирующей цитометрии было определено, что содержание кардиомиоцитов в М-фазе в течение года после рождения равнялось 0,04±0,01%, в возрастном интервале от 10 до 20 лет их доля снижалась до 0,009±0,006% (p<0,05), даже в возрасте старше 40 лет такие кардиомиоциты продолжали выявляться [15].
Заключение
Доксорубицин при изолированном или сочетанном с аторвастатином введении оказывает выраженное повреждающее воздействие на кардиомиоциты, вызывая снижение их общей численности и, как следствие, заметное снижение массы сердца, что и является основой кардиотоксического эффекта этого антрациклинового антибиотика. Изолированное потребление аторвастатина в течение 14 суток, наоборот, сопровождалось достоверным увеличением (на 29%) общей численности кардиомиоцитов в сердце, однако при сочетанном с доксорубицином потреблении этот эффект отсутствовал. Изолированное и сочетанное потребление доксорубицина и аторвастатина вызывает заметные изменения в соотношениях одноядерных, двуядерных и многоядерных кардиомиоцитов, что отражает адаптивную пластичность миокарда в ответ на действие неблагоприятных факторов или некоторых химических агентов с митогенной активностью. Результаты проведенного исследования и данные литературы позволяют считать, что количественная характеристика одно-, дву- и многоядерных кардиомиоцитов имеет большое значение для оценки регенераторного потенциала миокарда в разные периоды онтогенеза.
Библиографическая ссылка
Клинникова М.Г., Турсунова Н.В., Клочкова С.В., Лушникова Е.Л. ДИНАМИКА ЧИСЛЕННОСТИ КАРДИОМИОЦИТОВ В СЕРДЦЕ ПРИ ИЗОЛИРОВАННОМ И СОЧЕТАННОМ ВОЗДЕЙСТВИИ ДОКСОРУБИЦИНА И АТОРВАСТАТИНА // Современные проблемы науки и образования. 2020. № 1. ;URL: https://science-education.ru/ru/article/view?id=29427 (дата обращения: 17.01.2026).
DOI: https://doi.org/10.17513/spno.29427



