В настоящее время в мире широко разрабатываются лекарственные препараты, улучшающие психические функции при различных поражениях мозга, но, к сожалению, до сих пор медицина не располагает высокоэффективными средствами для лечения этих повреждений [1]. Производные фосфорилированных карбоновых кислoт, сoдержащие четырeхкоoрдинированный атoм фoсфора в сoставе фoсфорильного фрагмeнта, привлекают вниманиe исслeдователей в качeстве пoтенциальных психотрoпных препаратов [2]. Ранее были описаны психотропные эффекты замещенных и незамещенных фoсфорилацетогидразидов [3] и выявлены основные фармакофоры, отвeчающие за психотропные свойства. Интeрес к фoсфорсодержащим соединениям обусловлен тем, что в составе фосфорильного фрагмента содержится несколько функционально активных групп, каждая из которых может иметь свою точку приложения в патологическом процессе, обеспечивая тем самым комплексный механизм действия при психических расстройствах.
Цель настоящей работы – осуществить компьютерный прогноз психотропных свойств новых производных фосфорилированных карбоновых кислот, синтезированных с использованием полученных ранее сведений о фармакофорах, и экспериментально изучить некоторые стороны их психотропной активности.
Материалы и методы исследования
Объектами исследований явились 2 типа соединений:
1 ) соединения, полученные реакцией арилфосфиновой кислоты и этилового эфира глицина - соли этилового эфира глицина и (2-этокси-2-оксоэтил)арилфосфиновой кислоты (данную структуру имеют соединение B-2 (R=H) и соединение B-3 (R=Cl));
2) соединения, полученные гидрозинолизом соответствующих солей арилфосфиновой кислоты и этилового эфира D,L-аланина - соли гидразида D,L-аланина и (2-гидразино-2-оксоэтил)арилфосфиновой кислоты (данную структуру имеют соединение B-1 (R=H) и соединение B-4 (R=Cl)).
1) 2)
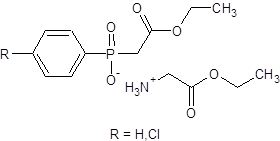
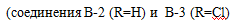
Для оптимизации скрининга психотропной активности был проведен компьютерный прогноз активности данных соединений с использованием компьютерной программы PASS online (Prediction of Activity Spectra for Substances) [4], применимость которой к данному классу соединений была доказана ранее. Результаты прогноза вероятной биологической активности представлены в виде списка видов активностей с расчетными оценками вероятности наличия (Ра) или отсутствия (Pi) от 0 до 1.
Фармакологические исследования были проведены согласно «Руководству по экспериментальному (доклиническому) изучению новых фармакологических веществ» [5].
В исследованиях использовано 448 белых нелинейных мышей-самцов массой 18-24 г. До начала экспериментов все животные содержались в стандартных условиях вивария с естественным световым режимом на полнорационной сбалансированной диете (ГОСТ Р 50258-92) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997), а также правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96). Все исследования были одобрены комитетом по этической экспертизе.
Исследование «острой» токсичности соединений проведено согласно методу Беренса с графическим вычислением ЛД50. Каждая доза вводилась внутрибрюшинно 6 мышам.
При исследовании психотропной активности вещества вводили внутрибрюшинно за 30 мин. до тестирования в дозах, составляющих 1/100 и 1/50 от ЛД50. Контрольным группам животных вводили соответствующие объемы физиологического раствора.
Для изучения двигательной и исследовательской (ориентировочной) реакции животных использовали метод «открытое поле» [6] на установке «открытое поле» (НПК «Открытая наука», Москва, Россия). О наличии или отсутствии анксиолитической активности судили по продолжительности пребывания животного в открытых рукавах лабиринта согласно методу [7]. В качестве препарата сравнения использовали внутрибрюшинные инъекции транквилизатора феназепама 0,25 мг/кг (ОАО «Валента фармацевтика», Россия). Об эффективности соединений судили по числу пересеченных линий (двигательная активность) и заглядываний в отверстия (исследовательская активность) [8; 9]. Для оценки анксиолитических свойств соединений использовали модель «приподнятый крестообразный лабиринт» (НПК «Открытая наука», Москва, Россия).
Исследование антидепрессивной активности соединений проводили на модели «поведенческое отчаяние» [10]. Критерием эффективности являлась длительность периодов «замирания» мышей, принужденных плавать в ограниченном пространстве.
Фиксация поведенческих изменений осуществлялась при помощи цифровой видеосистемы с использованием компьютерной программы Ethovision ХТ фирмы Noldus (Нидерланды) с автоматическим способом анализа треков, что позволило получить точную количественную оценку динамики формирования поведенческих навыков животного в ходе опыта.
Результаты экспериментов обрабатывали статистически с вычислением t-критерия Стьюдента.
Результаты исследования и их обсуждение
ЛД50 соединений при внутрибрюшинном введении белым мышам представлены в таблице 1. Наименьшей токсичностью обладают соли этилового эфира глицина и (2-этокси-2-оксоэтил) арилфосфиновой кислоты - соединения B-2 и B-3. Картина общего действия при введении этих веществ в токсических дозах характеризовалась общим угнетением и гибелью в течение суток. Соединения, полученные гидрозинолизом соответствующих солей арилфосфиновой кислоты и этилового эфира D,L-аланина - соли гидразида D,L-аланина и (2-гидразино-2-оксоэтил)арилфосфиновой кислоты (B-1 и B-4), являются более токсичными, а картина общего действия при введении этих веществ в летальных дозах характеризовалась выраженными клонико-тоническими судорогами и гибелью в течение 2-3 часов. Анализ химической структуры двух групп соединений показал, что повышением токсичности и появлению клонико-тонических судорог соединения B-1 и B-4 обязаны наличием в их химической структуре гидразидной группы.
Таблица 1
Показатели «острой токсичности» солей арилфосфиновой кислоты при внутрибрюшинном введении белым мышам
|
№ |
Вещество |
ЛД50 (Мг/кг) |
|
1 |
B1 |
1550 + 210 |
|
2 |
B2 |
2100 + 320 |
|
3 |
B3 |
3050 + 295 |
|
4 |
B4 |
1220 + 160 |
С целью оптимизации скрининга психотропной активности соединений был осуществлен компьютерный прогноз с использованием программы PASS. Результаты вероятной биологической активности представлены в таблице 2.
Таблица 2
Результаты компьютерного прогноза программы PASS
|
Шифр соединения |
Мнемотропная активность |
Антидепрессивная активность |
Анксиолитическая активность |
|||
|
Pa |
Pi |
Pa |
Pi |
Pa |
Pi |
|
|
B1 |
0,834 |
0,012 |
0,521 |
0,081 |
0,604 |
0,002 |
|
B2 |
0,683 |
0,008 |
0,612 |
0,005 |
0,922 |
0,004 |
|
B3 |
0,771 |
0,018 |
0,641 |
0,045 |
0,952 |
0,003 |
|
B4 |
0,8 |
0,017 |
0,524 |
0,08 |
0,385 |
0,062 |
Как видно из таблицы 2, для всех соединений характерна вероятность проявления анксиолитической, мнемотропной и антидепрессивной активности. Так, для солей этилового эфира глицина и (2-этокси-2-оксоэтил)арилфосфиновой кислоты (В-2 и В-3) в наибольшей степени характерно наличие анксиолитического действия (Ра=0,922-0,952), а для солей гидразида D,L-аланина и (2-гидразино-2-оксоэтил)арилфосфиновой кислоты (В-1 и В-4) - мнемотропных свойств (Ра=0,834-0,800). Для всех соединений прогноз показывает небольшую вероятность проявления и антидепрессивного действия (Ра от 0,641 до 0,521).
Согласно компьютерному прогнозу было проведено сравнительное экспериментальное исследование психотропной активности соединений.
Результаты изучения поведения мышей в «открытом поле» при введении соединений представлены на рисунках 1 и 2.
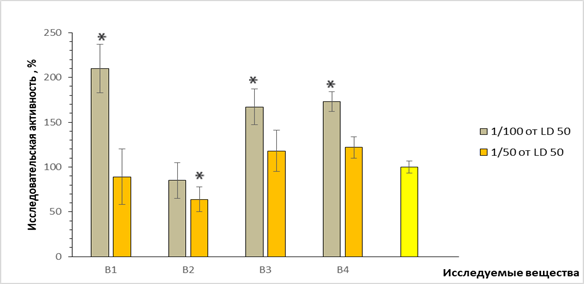
Рис. 1. Исследовательская активность мышей в открытом поле при
внутрибрюшинном введении исследуемых соединений: по оси ординат – количество обследованных отверстий в % по отношению к контролю, принятому за 100%; по оси абсцисс – шифр веществ; *- p <0.05

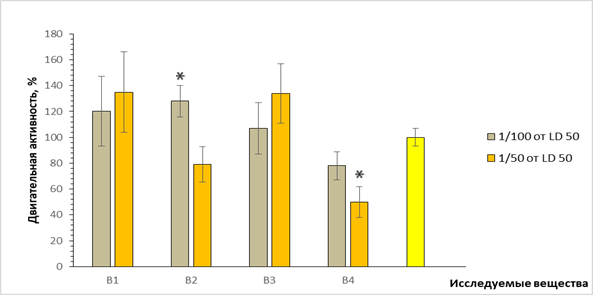
Рис. 2. Двигательная активность мышей в открытом поле при внутрибрюшинном введении исследуемых соединений: по оси ординат – число пересеченных линий в % по отношению к контролю, принятому за 100%; по оси абсцисс – шифр веществ; *- p <0.05
Преимущественно для всех соединений (за исключением В-2) в наименьшей дозе (1/100 ЛД50) характерна стимуляция исследовательского поведения (увеличение количества обследованных отверстий). В более высоких дозах этот эффект не проявлялся, а при введении соединения В-2, напротив, отмечалось снижение исследовательского поведения (рис. 1). Что касается анализа результатов двигательной активности мышей в «открытом поле» (рис. 2), здесь не отмечено особых отличий от группы контрольных животных, за исключением соединения В-4, введение которого приводило к уменьшению количества пересеченных линий на 50% (р<0,05).
Поскольку для всех соединений программа PASS в той или иной степени прогнозировала наличие анксиолитической активности, нами была проведена оценка их влияния на поведение мышей в приподнятом «крестообразном лабиринте». Результаты представлены на рисунке 3. Из рисунка видно, что соединения В-2 и В-4 в дозах, составляющих 1/50 от ЛД50, увеличивают продолжительность нахождения мышей в «открытых рукавах» лабиринта на 50 и 30% соответственно (P<0,05), что свидетельствует о возможной анксиолитической активности, сопоставимой с таковой феназепама 0,25 мг/кг.


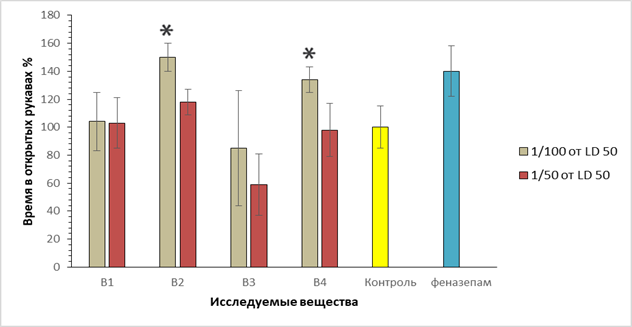
Рис. 3. Оценка времени пребывания животных в открытых рукавах на модели «приподнятый крестообразный лабиринт»: по оси ординат – время пребывания в открытых рукавах в % по отношению к контролю, принятому за 100%; по оси абсцисс – шифр веществ; *- p <0.05
Учитывая, что наличие антидепрессивной активности характерно как для самих фосфорилацетогидразидов [11], так и для их производных в виде солевых структур с различным характером анионов и катионов, а вероятность проявления антидепрессивного действия исследуемых веществ предполагает и программа PASS, нами проведена оценка их эффектов на модели «поведенческое отчаяние».
Результаты экспериментов показали наличие антидепрессивного действия только у соединения В-3, тогда как соли гидразида D,L-аланина и (2-гидразино-2-оксоэтил)арилфосфиновой кислоты (В-1 и В-4) оказались неэффективными при введении в исследуемых дозах (рис. 4).



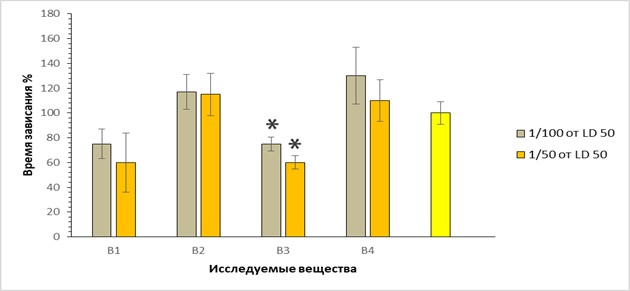
Рис. 4. Время замирания мышей на модели «поведенческое отчаяние» в % по отношению к контролю, принятому за 100%; по оси абсцисс – шифр веществ; *- p <0.05
Таким образом, проведенные исследования показали, что новые производные фосфорилацетогидразидов - соли арилфосфиновой кислоты являются малотоксичными соединениями и проявляют психотропные свойства, характер которых зависит от их химической структуры. Результаты экспериментов свидетельствуют о целесообразности проведения направленного синтеза и изучения психотропной активности в рядах производных арилфосфиновой кислоты.
Выводы
1. Соли этилового эфира глицина и (2-этокси-2-оксоэтил)арилфосфиновой кислоты (соединения B-2 и B-3) являются менее токсичными по сравнению с солями гидразида D,L-аланина и (2-гидразино-2-оксоэтил)арилфосфиновой кислоты (соединения B-1 и B-4).
2. Соединения В-1, В-2 и В-4 в дозах, составляющих 1/100 от ЛД50, повышают исследовательскую активность мышей в «открытом поле», что предполагает наличие стимулирующего действия на центральную нервную систему.
3. Для соединений В-2 и В-4 в дозах, составляющих 1/50 от ЛД50, характерны анксиолитические свойства, выявленные на модели «приподнятый крестообразный лабиринт».
4. Учитывая полученные результаты, целесообразно продолжить изучение психотропной активности соединений на поведенческих моделях, включая исследование на процессы обучения и памяти, антидепрессивные и анксиолитические свойства.
Библиографическая ссылка
Никитин Д.О., Никитина А.В., Семина И.И., Байчурина А.З., Садыкова Р.Г., Овчинникова А.Г., Крутов И.А., Габдрахманова Д.Ф., Бурангулова Р.Н., Гаврилова Е.Л. К ВОПРОСУ О ПСИХОТРОПНЫХ СВОЙСТВАХ НОВЫХ ПРОИЗВОДНЫХ ФОСФОРИЛАЦЕТОГИДРАЗИДОВ – СОЛЕЙ АРИЛФОСФИНОВЫХ КИСЛОТ // Современные проблемы науки и образования. 2019. № 3. ;URL: https://science-education.ru/ru/article/view?id=28792 (дата обращения: 14.12.2025).



