Жизнь на земле представляет собой постоянную череду изменяющихся условий, включая смену дня и ночи, времен года, климата [10]. В этой связи целый ряд процессов в организме характеризуется выраженной цикличностью. Физиологическая синхронизация функций различных систем организма обеспечивает человеку высокий уровень работоспособности, большую продолжительность жизни и крепкое здоровье [9]. Вместе с тем следует отметить, что человечество шагнуло вперед, и искусственная среда почти полностью заменила естественную [12]. Так, круглосуточная работа техники на производстве требует постоянного присутствия специалиста. Изменения режима освещения также могут быть вызваны авиаперелетами, которые приводят к резкой смене часовых поясов [11]. Подобные искусственные изменения продолжительности дня способны привести к развитию светового десинхроноза [8].
Десинхроноз представляет собой процесс рассогласования циркадианных, то есть врожденных суточных и околосуточных ритмов. Поэтому воздействия, нарушающие естественные регуляторные механизмы, могут индуцировать развитие широкого спектра патологических изменений [6]. Очень важно оценить состояние самых динамичных систем организма, в том числе мочевыделительной, функционирование которой имеет выраженные биологические ритмы. В этой связи, срыв регулирующих механизмов при десинхронозах может рассматриваться как одна из причин, приводящих к развитию патологии почек. Согласно статистике, заболевания почек и мочевыводящих путей появляются независимо от пола и возраста. По данным федеральной службы государственной статистики в Российской Федерации от этих болезней страдает 17 % населения (данные на 2014 год), в том числе с диагнозом, установленным впервые в жизни 6,9 %. К сожалению, эти показатели выросли за 3 года (в период с 2010 по 2014 года) на 8,1 % и 4,7 % соответственно [3].
Учитывая первостепенную роль мочевыделительной системы в поддержании внутреннего гомеостаза организма, ее патология может приводить к ухудшению работы всех систем организма, в частности сердечно-сосудистой. Поражение почек ведет к активации секреции ренина, то есть стимуляции работы ренин-ангиотензин-альдостероновой системы, которая за счет повышения тонуса сосудов приводит к развитию вторичной симптоматической артериальной гипертензии, провоцируя атеросклеротическое повреждение кровеносных сосудов. Кроме того, усиление реабсорбции натрия обеспечивает задержку жидкости в организме, а альдостерон повышает проницаемость сосудистой стенки, приводя к развитию отеков и нарушая транскапиллярный обмен [2].
Анализ научной литературы, посвященной проблеме морфологических изменений в почках при световом десинхронозе, свидетельствует, что этот вопрос остается наименее изученным. В связи с этим целью настоящей работы является изучение влияния светового десинхроноза на морфофункциональное состояние почек в эксперименте на белых крысах.
Материалы и методы
Экспериментальное исследование было проведено в весенне-осенний период на базе научной лаборатории кафедры гистологии, цитологии и эмбриологии ФГБОУ ВО Саратовского государственного медицинского университета им. В.И. Разумовского Министерства здравоохранения Российской Федерации. Все эксперименты выполнены в соответствии с приказом Минздрава СССР от 12 августа 1977 года № 755 «О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных» (по состоянию на 20 марта 2016 года), Федеральным законом «О защите животных от жестокого обращения» от 1 декабря 1999 года, Женевской конвенцией «Internetional Guiding Principals for Biomedical Involving Animals» (Geneva, 1990) и Хельсинкской декларацией о гуманном отношении к животным, а также с рекомендациями комитета по этике ФГБОУ ВО Саратовского государственного медицинского университета им. В.И. Разумовского Министерства здравоохранения Российской Федерации.
Исследование проведено на белых беспородных крысах-самцах, массой тела 200±50 г. Животные были разделены на две группы: контрольную, включающую 12 особей, находившихся в условиях естественного освещения, и опытную – 12 особей, которым моделировался световой десинхроноз с помощью изменения режима освещения лаборатории. Животные подвергались воздействию комбинации естественного в дневное время и искусственного освещения в ночное время, обеспечиваемого лампой дневного света, эквивалентной по мощности лампе накаливания в 60 Вт.
На двадцать первые сутки животные выведены из эксперимента путем передозировки препаратов для наркоза (внутримышечная комбинация Телазола (ZoetisInc, США) в дозе 0,1 мл/кг и Ксиланита (Нита-Фарм, Россия) в дозе 0,3 мл/кг). После этого была удалена правая почка, которую фиксировали 10 %-м нейтральным формалином. Фрагменты почечной ткани обезвоживали в спиртах возрастающей концентрации (80–100º), заливали в парафин. С помощью микротома готовили срезы толщиной 3–5 мкм, которые окрашивали гематоксилином и эозином.
Оценку морфологического состояния почек проводили по качественным и количественным критериям. Морфометрическое исследование выполнено в 30 полях зрения [1] гистологических срезов почек каждого животного контрольной и опытной групп с использованием медицинского микровизора проходящего света mVizo-103. Определяли размеры почечного тельца, капсулы Шумлянского – Боумена, собирательных трубочек, почечных канальцев и площадь клубочкового аппарата.
Весь цифровой материал подвергнут статистической обработке с использованием пакета прикладных статистических программ «STATISTICA 10» (StatSoft®, США). Значимыми считали изменения при p<0,05. Для каждого исследуемого параметра вычисляли медиану (Ме) и межквартильный размах. Достоверность полученных значений оценивали при помощи U-критерия Манна – Уитни.
Результаты
В ходе морфологического исследования гистологических срезов почек 12 лабораторных животных, которые подвергались воздействию комбинации естественного освещения днем и искусственного – ночью, отмечены изменения со стороны интерстициальной ткани и гломерулярного аппарата почки. Визуально изменения гломерулярного аппарата проявляются сегментированием клубочков, приобретение ими «лапчатого» вида. В капиллярах почечного тельца, а также в междольковых сосудах прослеживается стаз эритроцитов (Рис. 1). Также, отмечается явное изменение формы почечного тельца в сторону большей эллипсоидности по сравнению с практически круглыми тельцами крыс контрольной группы.
При морфометрии установлено, что у животных опытной группы происходит статистически значимое увеличение размера почечного тельца по длинной оси на 24 % (Табл.). Кроме того, увеличивается соотношение между диаметром Мальпигиева тельца по длинной оси и диаметром по короткой оси. В опытной группе диаметр почечного тельца по длинной оси в среднем на 29 % больше, чем по короткой оси, а в контрольной – лишь на 8 % (Табл.), что отражает изменение формы почечного тельца.
Помимо полнокровия наблюдались кровоизлияния в перитубулярной зоне коркового вещества (рис. 1).
А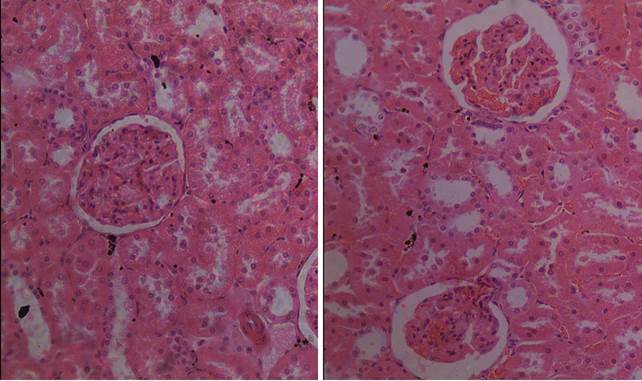 Б
Б
Рис. 1. Корковое вещество почки у животных контрольной (А) и опытной (Б) групп.
Окраска гематоксилином и эозином. Объектив 20х
У животных опытной группы регистрируется статистически значимое уменьшение площади сосудистого пучка в среднем на 22 % до 7 тыс. мкм2 по сравнению с контролем (табл.). Периметр сосудистого пучка у животных опытной группы не претерпевает значимого изменения по сравнению с контролем (табл.). Увеличение размеров почечного тельца и уменьшение площади сосудистого пучка у животных опытной группы сопровождается увеличением пространства между париетальным и висцеральным листками капсулы Шумлянского – Боумена в 2,2 раза до 20 мкм, против 9 мкм в контрольной группе (табл.).
В корковом веществе почек контрольной группы вместе с изменениями почечного тельца выявляются структурно функциональные нарушения канальцевой системы нефронов. Так, в отдельных канальцах визуализируется слущивание апикальных полюсов нефротелия и щеточных каемок с элементами кариорексиса и кариолизиса эпителиальных клеток.
В среднем по группе не отмечается значимого изменения диаметра канальцев нефрона по сравнению с животными контрольной группы (табл.).
Результаты морфометрического исследования
|
Определяемый параметр |
Контроль (n=12) |
Опытная группа (n=12) |
Значимость различий |
|
Диаметр почечного тельца по длинной оси, мкм |
128 (120; 137) |
159 (149; 166) |
р=0,000001 |
|
Диаметр почечного тельца по короткой оси, мкм |
118 (110; 123) |
123 (116; 129) |
р=0,107304 |
|
Площадь сосудистого пучка, тыс.мкм2 |
9 (8; 10) |
7 (4; 9) |
р=0,000003 |
|
Периметр сосудистого пучка, мкм |
347 (330;364) |
337 (287; 368) |
р=0,431976 |
|
Пространство между листками капсулы Шумлянского – Боумена, мкм |
9 (8; 11) |
20 (17; 23) |
р=0,000001 |
|
Диаметр канальца нефрона, мкм |
43 (37; 50) |
43 (38; 48) |
р=0,976781 |
|
Диаметр собирательной трубочки, мкм |
36 (30; 43) |
46 (38; 51) |
р=0,021492 |
Примечания: в каждом случае приведены медиана, верхний и нижний квартили;
р – по сравнению с контрольной группой.
В мозговом веществе почек животных группы сравнения отмечается выраженный интерстициальный отек. Структура стенок некоторых собирательных трубочек находилась в состоянии дезорганизации (рис. 2).
При морфометрии у белых крыс, подвергавшихся воздействию комбинации естественного и искусственного освещения, выявлено увеличение диаметра собирательной трубочки в среднем на 28 % до 46 мкм по сравнению с контролем – 36 мкм (табл.).
А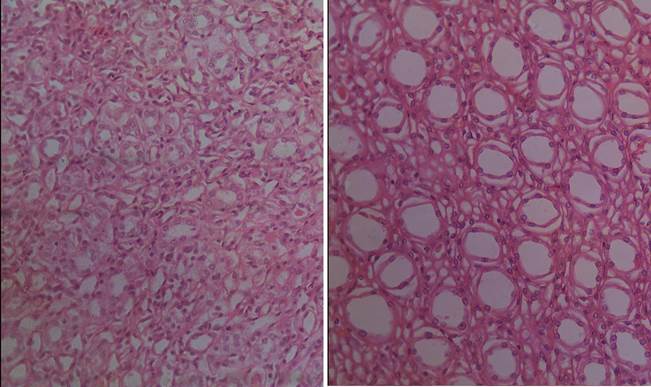 Б
Б
Рис. 2. Мозговое вещество почки у животных контрольной (А) и опытной (Б) групп.
Окраска гематоксилином и эозином. Объектив 20х
Обсуждение
Результаты проведенного эксперимента свидетельствуют о том, что воздействие комбинации естественного освещения днем и искусственного – ночью, индуцирует развитие выраженных структурно-функциональных изменений как в корковом, так и в мозговом веществе почек белых крыс. Вместе с тем центральным вопросом, подтолкнувшим к проведению данного исследования, является до сих пор неясный механизм развития морфологических нарушений при воздействии такого стрессорного фактора, как световой десинхроноз.
В настоящее время доказана взаимосвязь нарушения циркадианных ритмов с развитием стресс-реакции, определяющую роль в которой играет гипоталамо-гипофизарно-надпочечниковая система, повышающая уровень стрессорных медиаторов и гормонов в ответ на действие альтерирующих агентов [9, 10, 12]. Одним из подобных нейропептидов является кортикотропин-рилизинг-гормон или кортиколиберин, действующий на кортикотропоциты аденогипофиза, которые начинают расщеплять прогормон проопиомеланокортин, в результате чего образуется адренокортикотропный гормон. Кортиколиберин с током крови достигает клеток пучковой зоны коры надпочечника и стимулирует синтез и секрецию глюкокортикостероидов, действие которых приводит к повышению системного артериального давления и чувствительности миокарда и стенок сосудов к катехоламинам, что в целом может рассматриваться как риск кардиоваскулярной патологии [5].
Аналогично световая депривация по системе межнейрональных синапсов оказывает действие на заднюю группу ядер гипоталамуса. Возбуждение от этого высшего центра симпатической части вегетативной нервной системы передается по нервным волокнам к клеткам ядер серого вещества боковых рогов спинного мозга всех грудных и трех верхних поясничных сегментов. Постганглионарные волокна подходят к клеткам мозгового вещества надпочечников, где стимулируют секрецию кактехоламинов [12]. Выделение гормонов стресса в кровь объясняет угнетение активных механизмов регуляции микрокровотока, уменьшение площади сосудистого пучка, расширение пространства между листками капсулы Шумлянского – Боумена, стаз эритроцитов в капиллярной сети клубочка.
Согласно современным данным литературы, световая депривация также оказывает влияние на работу супрахиазматического ядра переднего гипоталамуса, контролирующего ритмы секреции ионов Na+ и Ca2+ в почках, а также супраоптических и паравентрикулярных ядер, регулирующих экскрецию ионов K+ и диурез [2]. Нарушение регуляции транспорта ионов объясняет возникновение выраженного интерстициального отека и структурных нарушений в канальцевой системе нефронов у животных. Изменение эпителия почечных канальцев также может свидетельствовать о развитии такого метаболического проявления стресса, как гипоксия. Притом, гипоксическое повреждение канальцев в сочетании с уменьшением площади сосудистого пучка является признаком ишемии [7], что, вероятно, является следствием спазма сосудов.
Выявленные в ходе эксперимента отклонения от нормы отражают значительные изменения внутриорганной гемодинамики почек. Это, в свою очередь, согласуется с результатами других авторов, свидетельствующими о резком нарушении механизмов регуляции микроциркуляции, угнетении общей модуляции кровотока, снижении перфузии и абсолютных амплитуд эндотелиальных, миогенных, кардиальных и дыхательных колебаний при световом десинхронозе [4, 5].
Заключение
Полученные результаты позволяют заключить, что световой десинхроноз в стадию структурных нарушений приводит к развитию серьезных морфологических изменений в почках белых крыс в условиях эксперимента. Представленные данные обосновывают целесообразность рассмотрения светового десинхроноза в качестве фактора развития патологии мочевыделительной системы.
Библиографическая ссылка
Антонова В.М., Злобина О.В., Иванов А.Н., Бугаева И.О., Захарова Н.Б., Пучиньян Д.М. МОРФОФУНКЦИОНАЛЬНОЕ СОСТОЯНИЕ ПОЧЕК В СТАДИЮ СТРУКТУРНЫХ НАРУШЕНИЙ СВЕТОВОГО ДЕСИНХРОНОЗА В ЭКСПЕРИМЕНТЕ // Современные проблемы науки и образования. 2017. № 1. ;URL: https://science-education.ru/ru/article/view?id=26137 (дата обращения: 06.02.2026).



