Лейомиома матки является одним из самых распространенных заболеваний у женщин всего мира. Статистика свидетельствует о том, что частота встречаемости данной патологии составляет 12–25% от всех гинекологических заболеваний и достигает максимальных значений в позднем репродуктивном и пременопаузальном возрасте [14; 15]. По данным Сидоровой И.С. этот показатель еще выше и составляет 55%. Однако существует мнение, что истинная доля этого заболевания (как у нас в стране, так и за рубежом) находится на уровне 77% [1]. Частота встречаемости миомы матки у женщин репродуктивного возраста достаточно высока и достигает 25–35% [11], а после 30 лет риск возникновения миомы матки возрастает еще более: до 76–80% [14].
Быстрый рост опухоли наблюдается в перименопаузальном (у 43,6%) и репродуктивном возрасте (у 48–60% больных), что нередко служит одной из причин бесплодия [13].
Число случаев первичного бесплодия у больных миомой матки составляет 18–24%, вторичного — 25–56% [5]. У 15–22% женщин, страдающих миомой матки, наблюдается привычное невынашивание беременности, т.е. в 2–3 раза чаще, чем у женщин без миомы [2]. Определенную роль в развитии бесплодия при миоме матки играют механические факторы [4]. Миома матки может быть причиной бесплодия, когда узел располагается в области трубного угла, сдавливает интерстициальную часть трубы и нарушает ее проходимость.
Наличие подслизистой или межмышечной миомы служит постоянным раздражающим фактором и нередко ведет к нарушению сократительной активности миометрия. При миоме матки нередко изменяется ее полость, отмечаются неровности рельефа эндометрия, что затрудняет проходимость сперматозоидов и яйцеклетки. Кроме того, нарушения рецепторного аппарата, возникающие у больных миомой матки, могут препятствовать адекватной подготовке эндометрия к реализации генеративной функции [1]. Однако маточный фактор, по-видимому, редко является единственной и непосредственной причиной бесплодия у таких больных.
Малоизученными остаются генетические, а также иммунологические причины формирования бесплодия. За последнее время достигнут определенный прогресс в изучении влияния дисбаланса в иммунной системе и аутоиммунных нарушений на развитие бесплодия.
Одной из форм иммунологического бесплодия является состояние, характеризующееся выработкой у женщин специфических антител в ответ на чужеродные антигены под действием различных факторов [16].
В 1990-х гг. при проведении клинических испытаний вакцины для регуляции фертильности, созданной на основе β-субъединицы хорионического гонадотропина человека (ХГЧ), у всех исследуемых женщин индуцировалась продукция высокого уровня антител к ХГЧ (анти-ХГЧ) и наблюдался контрацептивный эффект [3; 12]. Изучение иммунологического профиля молекулы ХГЧ показало, что, кроме α-субъединицы, общей для всех гликопротеиновых гормонов (ХГЧ, фолликулостимулирующего гормона — ФСГ, лютеинизирующего гормона — ЛГ и тиреотропного гормона), общие антигенные детерминанты есть и на β-субъединице. Так, ХГЧ и ЛГ имеют высокую степень гомологии (85%) β-субъединиц и связываются с одним и тем же рецептором.
В середине 1990-х гг. была разработана методика иммуноферментного анализа для определения анти-ХГЧ антител в сыворотке крови. При изучении свойств антител установлено, что они направлены как к α-, так и к β-субъединицам ХГЧ и перекрестно реагируют с ЛГ и ФСГ [7;10].
Цель исследования
Провести сравнительный анализ содержания профилей эмбриотропных аутоантител к ХГЧ в сыворотке крови пациенток с миомой матки и здоровых пациенток, а также выявить динамику изменения данного показателя после проводимого лечения миомы матки (консервативной миомэктомии и эмболизации маточных артерий).
Материалы и методы исследования
Оценка среднего содержания профилей аутоантител к ХГЧ проводилась 34 пациенткам репродуктивного возраста с миомой матки, из которых 16 пациенткам впоследствии выполнялась консервативная миомэктомия (вторая группа) и 18 пациенткам с миомой матки, которым впоследствии была выполнена эмболизация маточных артерий (третья группа). Полученные результаты сравнивались с уровнем профилей эмбриотропных аутоантител к ХГЧ у 30 здоровых пациенток репродуктивного возраста, которые составили контрольную группу (группа первая).
Исследования проводились методом твердофазного иммуноферментного анализа с использованием специализированных наборов реагентов (ЭЛИ-П-Комплекс, производство МИЦ «Иммункулус», Москва). Фотометрирование проводили при длине волны 450 нм с помощью спектрофотометра Multiskan FC («Termo scieniric», Финляндия). Расчет средней индивидуальной иммунореактивности каждого анализируемого образца сыворотки крови (в процентах от среднепопуляционных, контрольных значений), а также отклонения (в процентах от среднего нормализованного уровня) иммунореактивности анализируемого образца сыворотки крови с каждым из используемых антигенов производили с использованием компьютерной программы ОFFIS-3.
Оценка полученных результатов производилась согласно алгоритму, предоставленному производителем набора реагентов ЭЛИ-П-Комплекс МИЦ «Иммункулус»: нормальное значение сывороточных концентраций АТ-маркеров находится в диапазоне –20… +10% от уровня СИР (средняя индивидуальная иммунореактивность), пограничные (умеренные) отклонения: +11…+20% и –21… –30%, при этом соответствующие АТ-маркеры указывают на относительно небольшие изменения в соответствующих органах, достоверные (выраженные) отклонения находятся в диапазоне: более +20% или менее –30%, тогда АТ-маркеры указывают на существенные изменения в соответствующих органах и системах [9, 219].
Консервативная миомэктомия пациенткам исследуемой группы производилась четырьмя доступами: лапаротомным, лапароскопическим, вагинальным с лапароскопической ассистенцией, а также минилапаротомным под контролем лапароскопии – с использованием аппаратура фирмы Karl Storz.
Эмболизация маточных артерий всем пациенткам проводилась под местной анестезией на ангиографических комплексах последнего поколения Axiom Artis (Siemens) и Innova 3100 (GEMS). Доступ к маточным артериям осуществлялся посредством пункции правой бедренной артерии по стандартной методике Сельдингера. В качестве эмболизата использовались микроэмболы 700–1000 Нм PVA (COOK, США). В качестве контрастного вещества использовали 60 и 76% урографин, омнипак. На одну инъекцию расходовали от 5–10 мл (при суперселективном введении) до 30–35 мл (при выполнении тазовой артериографии) контрастного вещества.
Результаты исследования и их обсуждение
Среди клинических проявлений миомы матки преобладали: болевой синдром, нарушения менструального цикла по типу менометроррагий, нарушения функций тазовых органов по типу учащенного мочеиспускания либо, напротив, задержек мочеиспускания, а также сочетания болевого синдрома и менометроррагий (рис. 1).
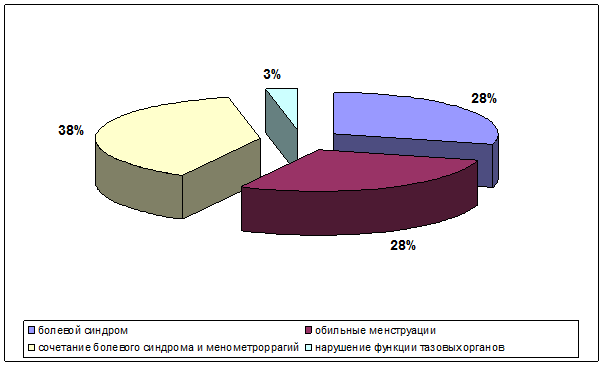
Рис. 1. Структура клинических проявлений миомы матки в исследуемых группах пациенток
Нами установлено, что у пациенток с миомой матки отмечался достаточно высокий процент бесплодия: 47,1% (16) (р<0,001), причем частота встречаемости первичного и вторичного бесплодия была сопоставима: 43,7% (7) и 56,3% (9) соответственно (р=0,5).
В контрольной группе молодых здоровых женщин средний уровень аутоантител к ХГЧ находился в пределах –3,00±0,98% . В группе пациенток с миомой матки значения содержания аутоантител к ХГЧ были в пределах нормы в 50% случаев, и у 50 % пациенток отмечалось повышение уровня аутоантител различной степени выраженности (р<0,001) (рис. 2). Повышенный уровень аутоантител к ХГЧ отмечался у 62,5% (10) пациенток с миомой матки и сопуствующим бесплодием (р<0,001). Необходимо отметить, что 7 женщин из группы пациенток с миомой матки и повышенным уровнем ХГЧ не предъявляли жалоб на бесплодие, но и не планировали беременность.
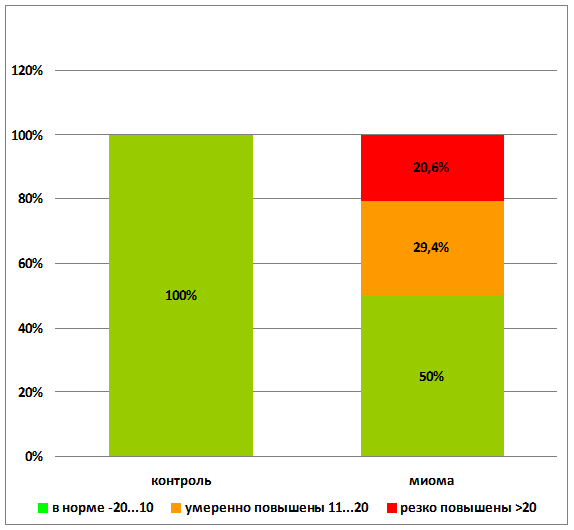
р<0,001
Рис. 2. Качественные показатели профилей аутоантител к ХГЧ до лечения миомы матки
Таким образом, повышение уровня аутантител к ХГЧ у пациенток с миомой матки является косвенным свидетельством проявления анти-ХГЧ синдрома и, возможно, приводит к нарушениям процесса имплантации оплодотворенной яйцеклетки и нарушению формирования хориона. Кроме того, можно сделать предположение о том, что наличие миомы матки является фактором риска по возникновению бесплодия и невынашивания беременности вследствие повышения уровня аутоантител к ХГЧ.
Пациенткам с миомой матки и сопутствующим бесплодием в качестве метода лечения в зависимости от особенностей расположения узлов и их кровоснабжения была выбрана консервативная миомэктомия –11 пациенткам (68,8%), и только в 5 случаях — эмболизация маточных артерий (31,2%) (данный метод лечения применялся пациенткам с вторичным бесплодием). При этом повышенные уровни аутоантител к ХГЧ были выявлены у 43,7% пациенток, которым впоследствии была выполнена консервативная миомэктомия, и у 55,5% пациенток, которым выполнялась эмболотерапия (рис. 4).
Через 5 месяцев после проводимого лечения миомы матки отсутствие каких-либо жалоб отмечали 67% пациенток (р<0,001), практически в 2 раза уменьшилось число пациенток с проявлениями болевого синдрома (р=0,007) и в 14 раз сократилось количество женщин, страдавших маточными кровотечениями (р<0,001) (рис. 3).
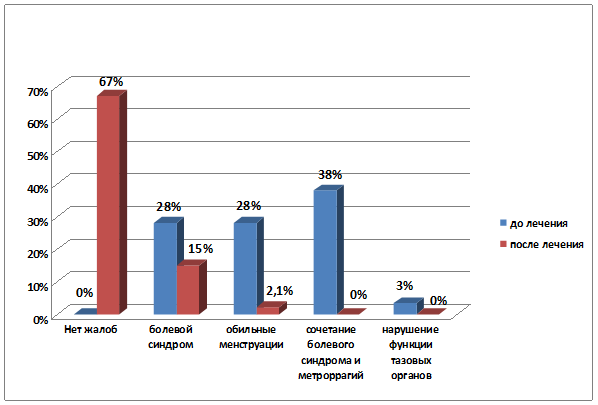
р=0,003
Рис. 3. Динамика клинических проявлений миомы матки до и после проведенного лечения
Кроме оценки динамики клинических проявлений, установлено снижение среднего уровня содержания профилей аутоантител к ХГЧ в сыворотке крови у пациенток после консервативной миомэктомии на 61% (р=0,003), а у пациенток после эмболизации маточных артерий – на 107% (вплоть до отрицательных значений) (р<0,001). Средние показатели содержания аутоантител к ХГЧ были сопоставимы в обеих группах (р=0,629). Более высокие темпы снижения уровня и нормализации показателей содержания аутоантител к ХГЧ были отмечены у пациенток после эмболизации маточных артерий (р=0,05) (рис. 4).
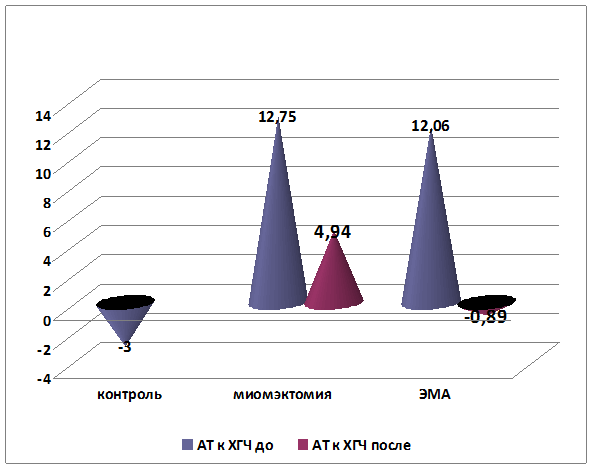
р=0,014.
Рис. 4. Динамика изменения уровня показателей профилей аутоантител к ХГЧ до и после лечения (%)
Нормализация и даже снижение показателей аутоантител к ХГЧ до умеренных значений наступила у 68,7% пациенток после консевативной миомэктомии (р<0,001) и у 88,9% пациенток после эмболизации маточных артерий (р<0,001). Необходимо отметить, что количество женщин с резко повышенным уровнем аутоантител к ХГЧ сократилось у женщин после консервативной миомэктомии на 12,4%, а после эмболотерапии — на 5,5% (р<0,001) (рис. 5).
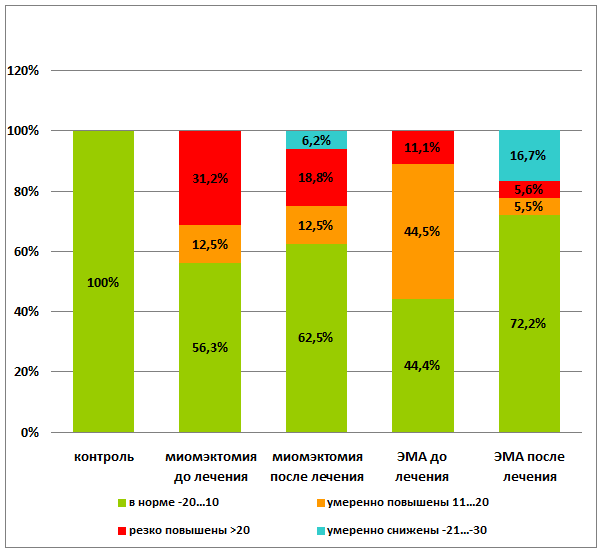
р=0,002.
Рис. 5. Динамика изменения уровня качественных показателей профилей аутоантител к ХГЧ до и после лечения
При анализе динамики изменения показателей аутоантител к ХГЧ у пациенток с миомой матки и с сопутствующим бесплодием снижение содержания данных аутоантител наступило как после консервативной миомэктомии, так и после эмболизации маточных артерий (рис. 6).
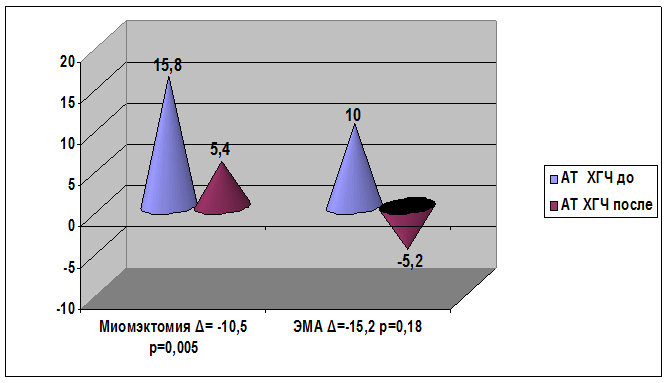
Рис. 6. Сравнительный анализ изменения содержания профилей аутоантител к ХГЧ после консервативной миомэктомии и эмболизации маточных артерий у пациенток с миомой матки и сопутствующим бесплодием
После проведенного лечения в течение 2 лет беременность наступила у 7 пациенток после консервативной миомэктомии (в 2 случаях в результате ЭКО) и у 3 пациенток после ЭМА. У каждой из пациенток, реализовавших впоследствии свою репродуктивную функцию, отмечалась нормализация уровня аутоантител к ХГЧ, средний уровень профилей аутоантител к ХГЧ у данного контингента женщин составил +2,06±3,15%. Во всех случаях беременность завершилась срочными оперативными родами путем операции кесарево сечение, при этом родились дети с хорошей оценкой по шкале Апгар.
Обсуждение и выводы
В ходе нашего исследования было выявлено, что уровень аутоантител к ХГЧ у пациенток с миомой матки достоверно выше по сравнению со здоровым контингентом женщин. Снижение содержания рецепторов к ХГЧ в клетках миомы, избыток свободного ХГЧ и повышение уровня аутоантител к ХГЧ у пациенток с миомой матки являются косвенным свидетельством проявления анти-ХГЧ синдрома и, возможно, приводят к нарушениям процесса имплантации оплодотворенной яйцеклетки и нарушению формирования хориона. Кроме того, можно сделать предположение о том, что наличие миомы матки является фактором риска возникновения бесплодия и невынашивания беременности вследствие повышения уровня аутоантител к ХГЧ.
После проведенного органосохраняющего лечения — консервативной миомэктомии и эмболизации маточных артерий — нормализация уровня аутоантител к ХГЧ произошла в обеих группах. Однако более значимая положительная динамика была обнаружена в группе пациенток, которым была выполнена эмболизация маточных артерий. Таким образом, эмболотерапия представляет интерес в качестве органосохраняющего метода лечения миомы матки не только для женщин, уже реализовавших свою репродуктивную функцию, но и для пациенток, сохраняющих репродуктивные планы.
Полученные нами данные патогенетически обоснованы результатами проведенных ранее исследований. Рядом авторов было выявлено более низкое содержание рецепторов к ХГЧ/ЛГ, способных связывать ХГЧ с более низкой молекулярной массой, в клетках лейомиомы по сравнению с нормальным миометрием. Избыток свободного ХГЧ приводил к снижению его связывания с рецепторами в нормальном миометрии ([19], что, возможно, служило причиной бесплодия у пациенток с миомой матки. Связывание антител с ХГЧ приводит к нарушению взаимодействия гормона с рецептором, что ведет к регрессии желтого тела и прерыванию беременности. Также антитела к ХГЧ способны усиливать антителозависимую цитотоксичность Т-лимфоцитов, направленную на клетки трофобласта, продуцирующие ХГЧ. Выделяемые при этом провоспалительные цитокины вызывают некроз децидуальной ткани [12].
J.L. Környei et al. (1998) экспериментально доказали стимулирующий эффект, который оказывает ХГЧ на рост миомы матки посредством механизма молекулярной мимикрии с ЛГ. Причем аутоантитела к рецепторам ХГЧ/ЛГ и к ХГЧ блокировали данный эффект [18].
В более позднем исследовании А. Horiuchi et al. (2000) выявили патогенетические механизмы стимулирующего влияния ХГЧ на рост и прогрессию миомы матки посредством увеличения синтеза пролиферативного ядерного клеточного антигена, циклина Е и белка cdc2 [17].
Таким образом, содержание уровня профилей аутоантител к ХГЧ в сыворотке крови и динамику их изменения можно рассматривать в качестве критерия, характеризующего возможность реализации репродуктивной функции пациентки, а также возможности правильной коррекции ее нарушений.
Рецензенты:
Калинкина О.Б., д.м.н., доцент кафедры акушерства и гинекологии № 1 СамГМУ. ГБОУ ВПО СамГМУ Минздрава России, кафедра акушерства и гинекологии № 1, г. Самара;
Шляпников М.Е., д.м.н., профессор кафедры акушерства и гинекологии ИПО СамГМУ. ГБОУ ВПО СамГМУ Минздрава России, кафедра акушерства и гинекологии ИПО, г. Самара.
Библиографическая ссылка
Спиридонова Н.В., Басина Е.И., Клыкова О.В., Щукин В.Ю. КЛИНИКО-ПРОГНОСТИЧЕСКИЕ АСПЕКТЫ СОДЕРЖАНИЯ АУТОАНТИТЕЛ К ХГЧ У ПАЦИЕНТОК С МИОМОЙ МАТКИ РЕПРОДУКТИВНОГО ВОЗРАСТА // Современные проблемы науки и образования. 2015. № 4. ;URL: https://science-education.ru/ru/article/view?id=21303 (дата обращения: 25.02.2026).



