Кожа является барьерным органом, в котором представлены клеточные и гуморальные факторы врожденного и адаптивного иммунитета. В современной литературе кожа рассматривается как орган иммуногенеза из-за присутствия в ней различных популяций иммунокомпетентных клеток: Т-, В-лимфоциты, NК- и дендритные клетки, столь значимые для развития иммунного ответа [1]. Многие авторы относят к иммунной системе кожи и кератиноциты, т.к. они продуцируют широкий спектр регуляторных молекул (ростовых факторов, цитокинов), чем обусловлено их участие в иммунной защите кожи. В коже обнаружено большинство известных интерлейкинов, нарушение продукции которых лежит в основе патогенеза ряда кожных заболеваний, в частности псориаза и атопического дерматита [2].
В настоящее время показана роль иммунной системы в противоопухолевом ответе организма [3,4]. При этом основная функция принадлежит клеточному иммунитету, опосредованному естественными киллерными клетками и специфическими цитотоксическими Т-лимфоцитами. Куртасова Л.М. и соавторы [6] обнаружили у больных базальноклеточным раком кожи изменения иммунофенотипического спектра лимфоцитов периферической крови. У данной категории пациентов наблюдается понижение количества зрелых Т-лимфоцитов (CD3+), повышается содержание CD16+ клеток, увеличивается число клеток, экспрессирующих маркер поздней активации (HLA-DR+). Имеются данные по выявлению в опухолях БКР и в окружающих ее тканях маркеров CD4, CD8, CD68. Выявлена вариабельность количественной и качественной характеристики клеточного инфильтрата в различных гистотипах. Установлена максимальная выраженность клеточной реакции в поверхностно-распространяющейся форме и минимальная интенсивность в инфильтративной [9].
Молочков В.А. и соавторы [7] указывают на важную роль цитокинов в канцерогенезе некоторых опухолей кожи (меланома, плоскоклеточный и базальноклеточный раки кожи). К активации пролиферативных процессов в коже приводит провоспалительный цитокин TNF-α (фактор некроза опухоли), способствующий индукции экспрессии молекул внутриклеточной адгезии, миграции активированных иммунокомпитентных клеток и увеличению продукции сосудистого фактора роста [8].
В связи с вышесказанным целью данной работы является сравнительная характеристика факторов локального иммунитета в микроокружении базальноклеточного рака кожи с различной распространенностью и с учетом возраста больных.
Материалы и методы
Исследования проводились у 45 онкологических пациентов обоего пола с первичным базальноклеточным раком кожи T1-4N0M0. Возраст больных колебался от 21 до 86 лет. По частоте встречаемости в зависимости от распространенности опухолевого процесса, оцениваемой согласно классификации злокачественных новообразований кожи AJCC, больные распределялись следующим образом: 21 пациент (46,7 %) с T2N0M0, 12 больных (26,7 %) с T3N0-хM0-х, 10 больных (22,2 %) с T1N0M0 и 2 (4,4 %) с T4N0M0. Удаленные опухоли подвергались патоморфологическому исследованию для подтверждения диагноза. Отдельные фрагменты опухолевой ткани, перитуморальной зоны (визуально неизменной ткани, прилежащей к опухоли) и здоровой кожи, взятой при проведении пластических операций неонкологическим больным (n=15), гомогенизировали с помощью дезагрегирующего устройства BD Medimachine. В гомогенатах определяли популяционный и субпопуляционный состав лимфоцитов на проточном цитометре FACSCantoII (BD) с панелью антител T-, B-, NK (CD45, CD3, CD4, CD8, CD19, CD16/56), а также содержание цитокинов IL-1ß, IL-6, IL-8, IL-18, TNF-α методом ИФА с тест-системами производства «Вектор-Бест» (Новосибирск) и «Цитокин» (С-Петербург).
Результаты выражали в процентах от общего количества лимфоцитов (для клеток лимфоцитарных субпопуляций) и в пг/мл (для цитокинов), пересчитанных на 1 г белка, количество которого определяли биуретовым методом; таким образом, получали удельное содержание каждого цитокина в исследуемых тканях.
У всех больных было получено добровольное информированное согласие на использование биологического материала для научных исследований. Статистический анализ материала проводился с использованием MicrosoftExcel (Windows XP). Данные представлены в виде M ± m. Разницу отличий оценивали по критерию Стьюдента и считали достоверной при р< 0,05.
Результаты
Результаты представлены в табл. 1–5 и на рис. 1. Табл. 1 и 2 демонстрируют суммарные показатели по всем обследованным больным. Число исследованных образцов перитуморальной области было значительно меньше, чем образцов опухолевой ткани, т.к. их удавалось взять не всегда и в минимальном объеме, особенно при локализации опухоли на лице. Поэтому во многих образцах перитуморальной области цитокины и лимфоциты не были найдены; в таблицах приведены данные только по тем, где они были обнаружены.
Таблица 1
Удельное содержание некоторых провоспалительных цитокинов в опухолевой и непораженной ткани больных БКР
|
Образцы тканей |
Уровни цитокинов (пг/мл/г белка) |
||||
|
IL-1ß |
IL-6 |
IL-8 |
IL-18 |
TNF-α |
|
|
Опухоль (n=45) |
48,8±8,5* |
13,5±2,2 |
50,0±6,5* |
164,8±32,1** |
2,4±0,4 |
|
Перитуморальная зона (n=5) |
67,9±32,2 |
26,8±17,1 |
48,8±15,0 |
311,2±32,3 |
2,1±0,4 |
|
Здоровая ткань (n=12) |
15,7±6,3 |
18,5±10,8 |
17,2±7,6 |
257,1±66,5 |
1,7±0,2 |
Примечание. * – статистически достоверные отличия от показателя здоровой ткани; ** – статистически достоверные отличия от показателя ткани перитуморальной зоны (р<0,05).
Как видно из табл. 1, в опухоли содержится статистически значимо более высокое количество IL-1ß и IL-8, по TNF-α и IL-6 различий не выявлено, а уровень IL-18, в ткани БКР оказался ниже по сравнению с тканью перитуморальной области, но не имел статистически достоверных отличий от показателя здоровой ткани.
Таблица 2
Субпопуляционный состав лимфоцитов в опухолевой и непораженной ткани больных БКР
|
Образцы тканей |
Субпопуляции лимфоцитов (%) |
||||
|
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16/56+ |
|
|
Опухоль (n=30) |
90,5±1,3 |
58,6±2,0 |
28,6±1,8** |
4,4±0,2* |
2,5±0,5 |
|
Перитуморальная зона (n=5) |
93,5±1,9 |
69,3±7,2* |
16,4±7,0* |
2,5±1,6 |
1,8±0,7 |
|
Здоровая ткань (n=15) |
89,5±3,6 |
53,6±3,0 |
36,1±5,8 |
0,7±0,3 |
7,1±2,8 |
Примечание. * – статистически достоверные отличия от показателя здоровой ткани; ** – статистически достоверные отличия от показателя ткани перитуморальной зоны (р<0,05).
Уровни субпопуляций лимфоцитов продемонстрировали ряд различий между тканью опухоли, перитуморальной области и здоровой тканью (табл. 2). Так, содержание CD3+CD4+ клеток оказалось максимальным в ткани перитуморальной зоны, статистически достоверно превышая показатель здоровой ткани. Уровень CD3+CD8+ лимфоцитов, напротив, был в ней минимальным из всех исследуемых образцов. Содержание CD19+ клеток достигало наивысшего значения в опухолевой ткани. Количество CD16/56+ лимфоцитов в образцах опухоли и перитуморальной зоны было ниже, чем в непораженной коже, однако, широкая индивидуальная вариабельность данных не позволяет считать эти различия статистически значимыми. Следует отметить, что в 9 из 14 исследованных образцов здоровой кожи лимфоцитов не было обнаружено, в табл. 2 приведены данные по 5 образцам, где лимфоциты были найдены в количестве, необходимом для выполнения проточной цитофлюориметрии.
При разделении общей группы больных в зависимости от возраста были показаны некоторые особенности исследованных показателей у больных различных возрастных групп. Результаты представлены в табл. 3.
Таблица 3
Удельное содержание некоторых провоспалительных цитокинов в опухолевой и непораженной ткани больных БКР у больных различных возрастных групп
|
Образцы тканей |
Возраст больных (годы) |
Уровни цитокинов (пг/мл/г белка) |
|||
|
IL-1ß |
IL-6 |
IL-8 |
TNF-α |
||
|
Опухоль |
29-50 (n=4) |
75,3±19,1* |
17,4±8,8 |
56,1±15,9* |
2,4±0,6 |
|
50-70 (n=10) |
25,7±6,2** |
16,3±4,7* |
44,5±10,9* |
2,5±0,87 |
|
|
71-85 (n=18) |
39,4±5,6* ** |
10,9±2,8 |
41,5±4,6* |
2,3±0,5 |
|
|
Здоровая ткань |
29-50 (n=4) |
3,8±1,0 |
1,4±0,5 |
7,2±5,3 |
1,8±0,5 |
|
50-70 (n=10) |
24,7±18,5 |
4,5±3,9 |
1,2±0,1 |
1,5±0,2 |
|
|
71-85 (n=18) |
10,1±7,1 |
23,9±16,1 |
14,1±6,6 |
2,1±0,3 |
|
Примечание. * – статистически достоверные отличия от показателей здоровой ткани; ** – статистически достоверные отличия от показателей младшей возрастной группы (р<0,05).
Как видно из табл.3, наблюдается статистически достоверно более высокое содержание IL-1ß в опухолевой ткани больных в возрасте до 50 лет по сравнению с остальными возрастными категориями. Для IL-8 подобные отличия отмечались в виде тенденци. В образцах больных всех возрастных групп показаны статистически достоверно более высокое содержание IL-8 в опухоли, чем в непораженной коже, для IL-1ß такие отличия были выявлены в образцах младшей и старшей возрастных групп, а в средней группе в опухоли оказался выше уровень IL-6. Уровни TNF-α не имел статистически значимых различий ни между возрастными группами, ни между тканью опухоли и немалигнизированных образцов по каждой из возрастных групп. Значительная индивидуальная вариабельность данных была отмечена не только в ткани опухоли, но и в здоровой коже.
Следует отметить, что при сравнении показателей цитокинового состава здоровой кожи отмечены различия между разными возрастными группами: так, у больных в возрасте до 50 лет отмечен максимальный уровень IL-18 (499±36,2 против 219,7±88,2 у больных в возрасте 50–70 лет и 162,7±39,1 у больных старшей возрастной группы; по сравнению с обеими группами различия статистически достоверны, (р<0,05). Наблюдалось также более высокое содержание IL-1ß и IL-6 IL-8 у больных старше 50 лет по сравнению с больными младше 50 лет, однако, из-за значительной вариабельности индивидуальных данных статистически достоверных различий между ними выявить не удалось.
Таблица 4
Субпопуляционный состав лимфоцитов в опухолевой ткани больных БКР у больных различных возрастных групп
|
Возраст больных (годы) |
Субпопуляции лимфоцитов (%) |
||||
|
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16/56+ |
|
|
29-50 (n=4) |
92,8±2,5 |
56,7±5,3 |
35,2±5,5* |
1,2±0,7* |
5,5±4,1 |
|
50-70 (n=10) |
92,3±1,2 |
65,0±3,2* |
23,3±3,8* |
2,8±0,88 |
2,23±0,5 |
|
71-85 (n=18) |
89,3±2,0 |
55,5±2,6* |
29,0±1,9 |
5,9±1,9* |
1,7±0,4 |
Примечание. * – статистически достоверные различия между возрастными группами (р<0,05).
Сравнение тканевого содержания лимфоцитов различных субпопуляций у больных разных возрастных групп показало, что уровень CD3+CD4+ был максимальным в средней возрастной группе, статистически достоверно превышая обнаруженный у больных старше 70 лет (табл. 4). Содержание CD3+CD8+ лимфоцитов, напротив, было в средней возрастной группе минимальным и оказалось статистически значимо ниже, чем у больных младшей группы. Выявлен наиболее высокий процент В-лимфоцитов в ткани БКР старшей возрастной группе и минимальный – в младшей. Содержание NК-клеток, хотя и было в младшей группе выше, чем в остальных, статистически достоверных различий между ними обнаружить не удалось.
Результаты сравнительного определения данных показателей в опухолевой и немалигнизированной ткани представляется возможным продемонстрировать только по одной возрастной группе, а именно – средней (рис. 1).
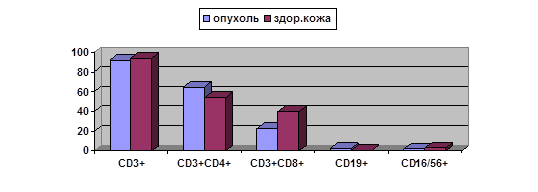
Рис. 1. Субпопуляционный состав лимфоцитов в опухолевой и непораженной ткани больных БКР у больных различных возрастной группы 50–70 лет
Из данных, представленных на рис. 1, видно, что в опухоли больных данной группы выявлены статистически значимо более высокое содержание CD3+CD8+ лимфоцитов и более низкое количество CD3+CD4+ клеток, чем в образцах здоровой кожи больных соответствующего возраста. Эти результаты несколько отличаются от полученных без разделения на возрастные группы (табл. 2).
Кроме возрастного разделения было проведено разделение больных БКР в зависимости от распространенности процесса по классификации TNM. Полученные данные представлены в табл. 5.
Таблица 5
Удельное содержание некоторых провоспалительных цитокинов в опухолевой ткани больных БКР у больных с различной распространенностью опухоли
|
Стадия |
Уровни цитокинов (пг/мл/г белка) |
|||
|
IL-1ß |
IL-6 |
IL-8 |
TNF-α |
|
|
T1N0M0 |
57,6±22,2 |
18,1±6,3 |
45,7±11,6 |
2,4±0,5* |
|
T2N0M0 |
41,3±7,3 |
8,7±3,1 |
39,9±5,7 * |
6,8±4,6 |
|
T3N0M0 |
40,2±7,8 |
17,2±4,4 |
38,1±6,7 * |
2,8±0,8 * |
|
T4N0M0 |
52,0±24,0 |
13,5±4,0 |
67,1±5,5 |
1,2±0,05 |
Примечание. * – статистически достоверные отличия от показателей стадии T4N0M0; (р<0,05).
Как видно из табл. 5, при наиболее распространенной БКР в ее ткани определяются более высокие уровни IL-8 и меньшие TNF-α, что может характеризовать микроокружение опухоли как неблагоприятное в плане дальнейшей диссеминации. Хемокин IL-8 способствует адгезии и инвазии опухолевых клеток, а минимальное значение TNF-α предполагает дистантное влияние опухоли, приводящее к истощению цитотоксического потенциала ткани при стадии T4.
Итак, установлен ряд различий по содержанию факторов локального иммунитета у больных БКР. Показаны более высокие уровни провоспалительных цитокинов, преимущественно IL-1 и IL-8, в опухоли по сравнению с непораженной тканью, а также более высокое количество CD3+CD4+ и более низкое CD3+CD8+ в перитуморальной зоне по сравнению со здоровой тканью, при этом ткань опухоли содержит больше В-клеток. Выявлены некоторые различия, связанные с распространенностью БКР, а также возрастом больных.
Рецензенты:
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Библиографическая ссылка
Пржедецкий Ю.В., Златник Е.Ю., Новикова И.А., Шарай Е.А., Позднякова В.В., Комарова Е.Ф., Закора Г.И., Бахтин А.В., Селютина О.Н. ИММУНОЛОГИЧЕСКОЕ МИКРООКРУЖЕНИЕ БАЗАЛЬНОКЛЕТОЧНОГО РАКА КОЖИ // Современные проблемы науки и образования. 2015. № 3. ;URL: https://science-education.ru/ru/article/view?id=19785 (дата обращения: 15.02.2026).



